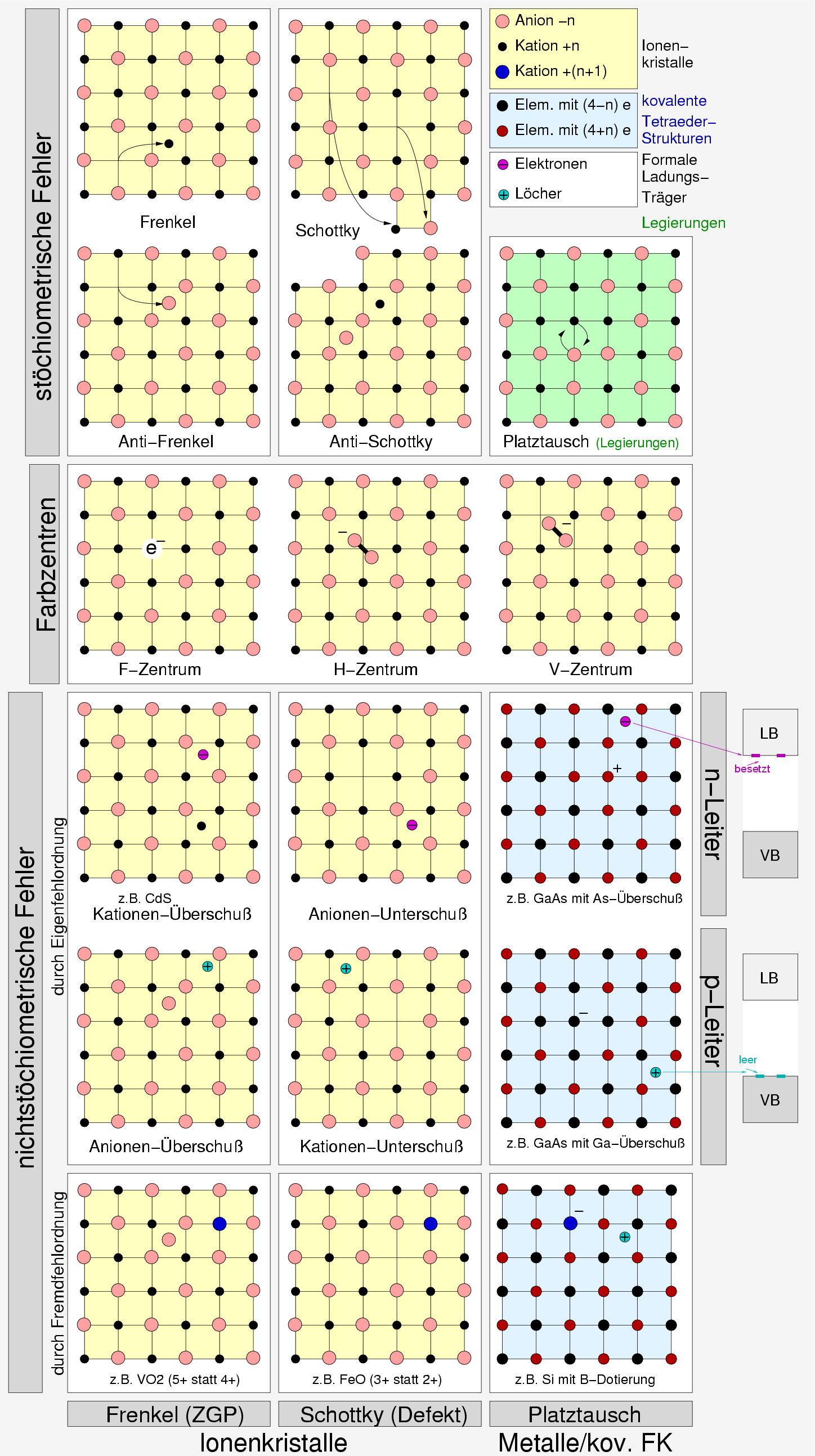
|
| Abb. 1.2.1. Übersicht über Punktdefekte ‣ SVG |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Strukturchemie | Interm. Phasen | Oxide | Silicate | Strukturtypen | AFP |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
Vorlagen

|
| Abb. 1.2.1. Übersicht über Punktdefekte ‣ SVG |
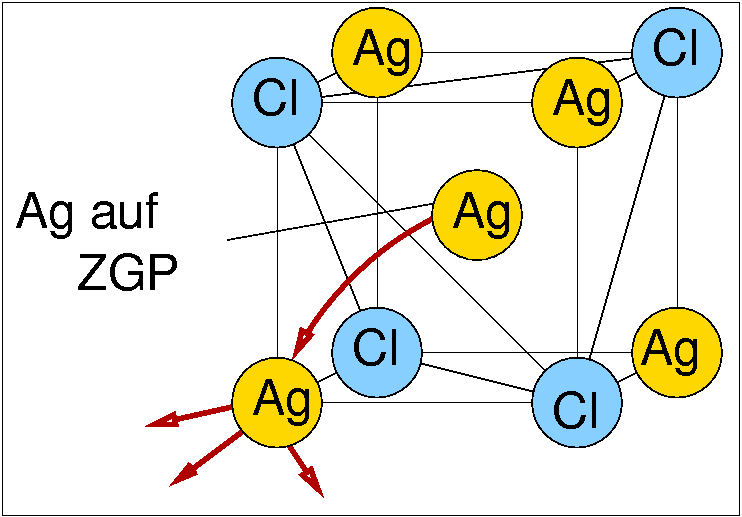
|
| Abb. 1.2.X. Mechanismus der Ionenleitung in AgCl ‣ SVG |
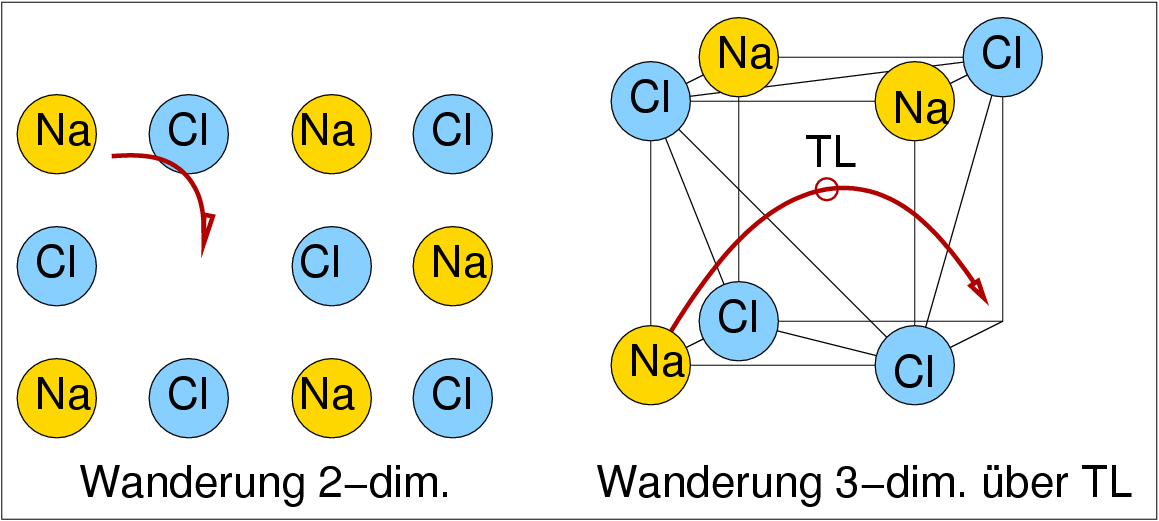
|
| Abb. 1.2.X. Mechanismus der Ionenleitung in NaCl ‣ SVG |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Strukturchemie | Interm. Phasen | Oxide | Silicate | Strukturtypen | AFP |