|
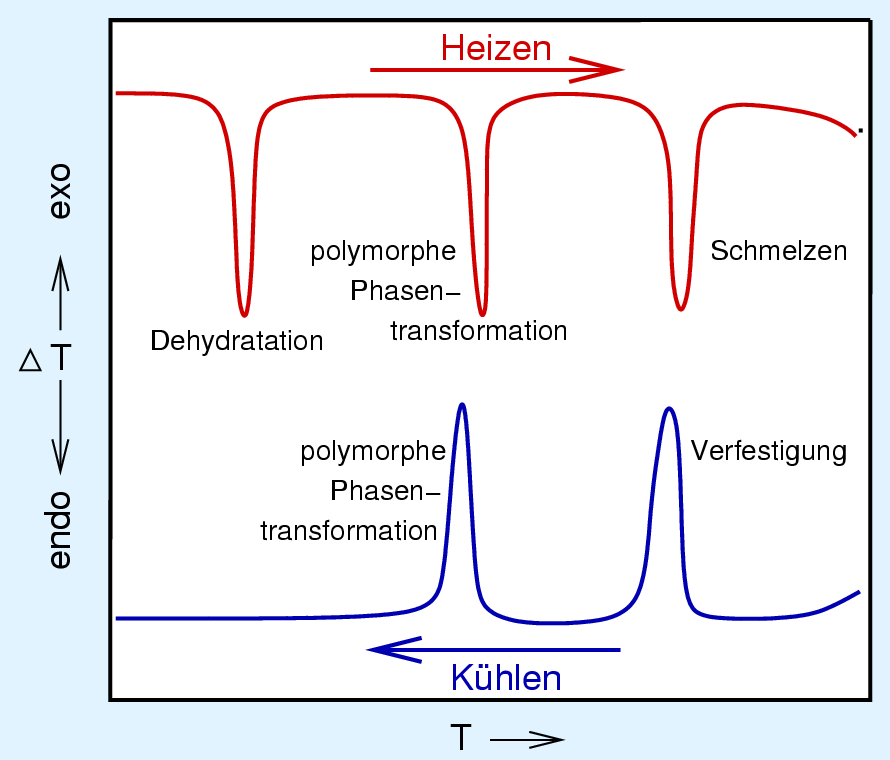
| Abb. 2.3.1. DTA-Kurve einer wasserhaltigen Substanz ‣ SVG |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Strukturchemie | Interm. Phasen | Oxide | Silicate | Strukturtypen | AFP |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
Vorlagen
| Reaktion/Transformation | Effekt |
|---|---|
| Phasentransformation 1. Ordnung | endo |
| Phasenübergang höherer Ordnung | Schritt in der Basislinie |
| Verdampfung | endo |
| Schmelzen | endo |
| metastabil ---> stabil | exo |
| Zersetzungsreaktion | endo oder exo |
| flüssig-fest-Reaktion | endo oder exo |
| fest-fest-Reaktion | endo oder exo |
| Polymerisation | exo |
| Chemisorption | exo |

|
| Abb. 2.3.1. DTA-Kurve einer wasserhaltigen Substanz ‣ SVG |
|
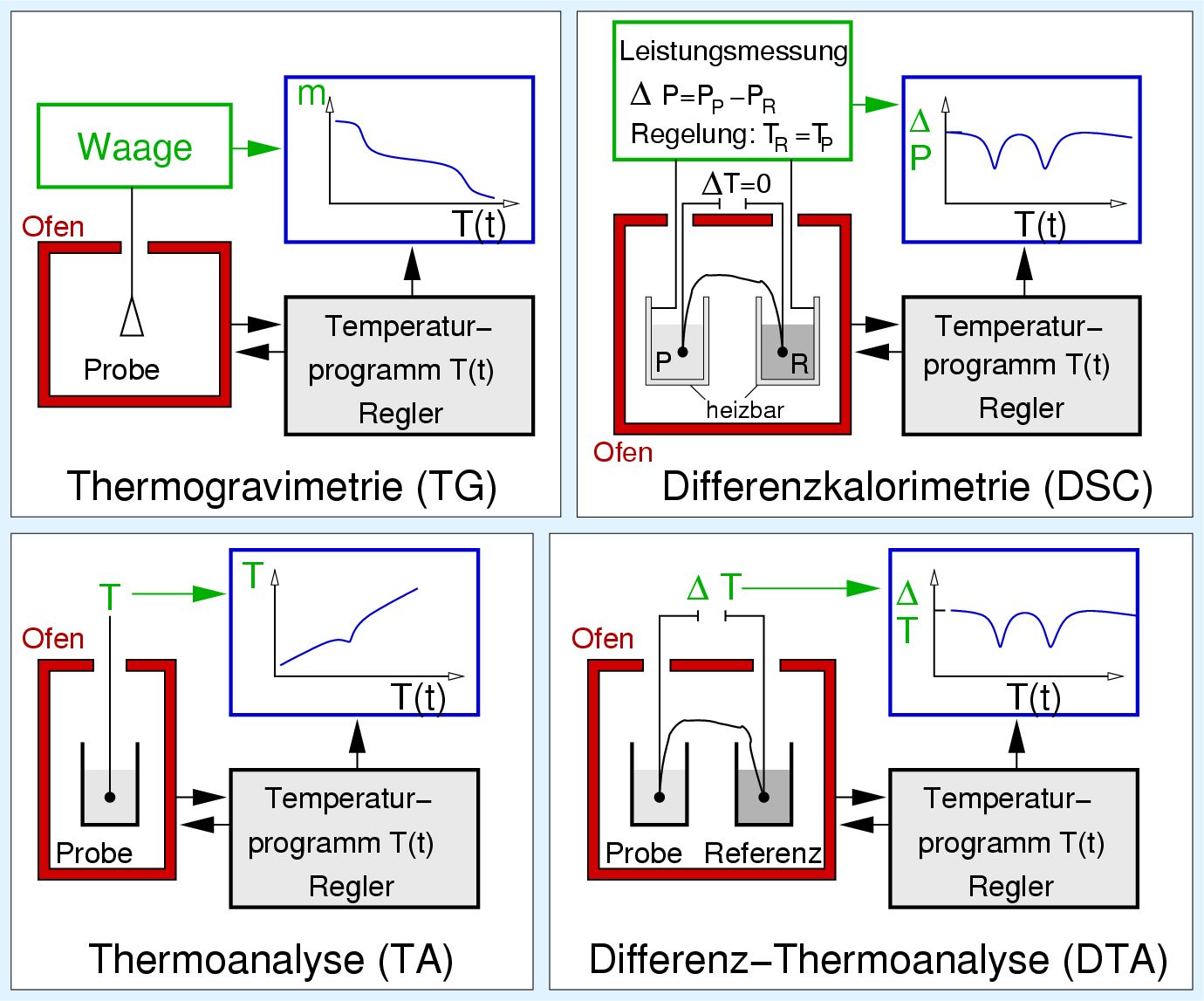
| Abb. 2.3.2. DTA und Phasendiagramm ‣ SVG |

|
| Abb. 2.3.2. DTA und Phasendiagramm ‣ SVG |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Strukturchemie | Interm. Phasen | Oxide | Silicate | Strukturtypen | AFP |