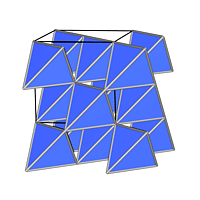
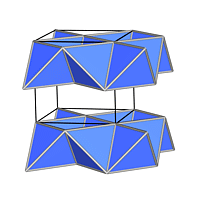
| hexagonal dichte Packung | Anteil besetzter oktaedrischer Lücken | Formel | kubisch dichte Packung |
 | 1 | MX |  |
| NiAs , VRML/Packung | NaCl , VRML | ||
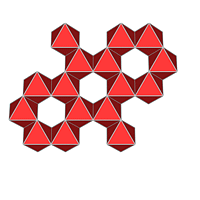 | 2/3 | M2X3 | - |
| Al2O3 (Korund), VRML | - | ||
 | 1/2 | MX2 |  |
| CdI2, VRML | CdCl2, VRML | ||
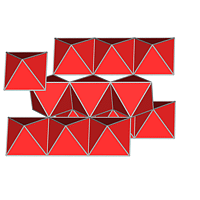 | 1/2 | MX2 | - |
| CaCl2, VRML | - | ||
 | 1/2 | MX2 |  |
| PbO2, VRML | TiO2 (Anatas), VRML | ||
 | 1/2 | MX2 | - |
| AlOOH, VRML | - | ||
 | 1/3 | MX3 | - |
| ZrI3, VRML | - | ||