Vorlesung Chemie der Nichtmetalle
5. Chalkogene: O, S, Se, Te, Po
5.1. Elemente
|
Übersicht
Die Elemente der Gruppe werden Chalko-gene (gr: Kupfer-bildner) genannt, da
viele Metallsalze Oxide oder Sulfide sind. Im einzelnen handelt es sich um die Elemente
- Sauerstoff (O, englisch oxygen)
- Schwefel (S)
- Selen (Se)
- Tellur (Te)
- Polonium (Po)
Sauerstoff ist nach Wasserstoff das häufigste Element,
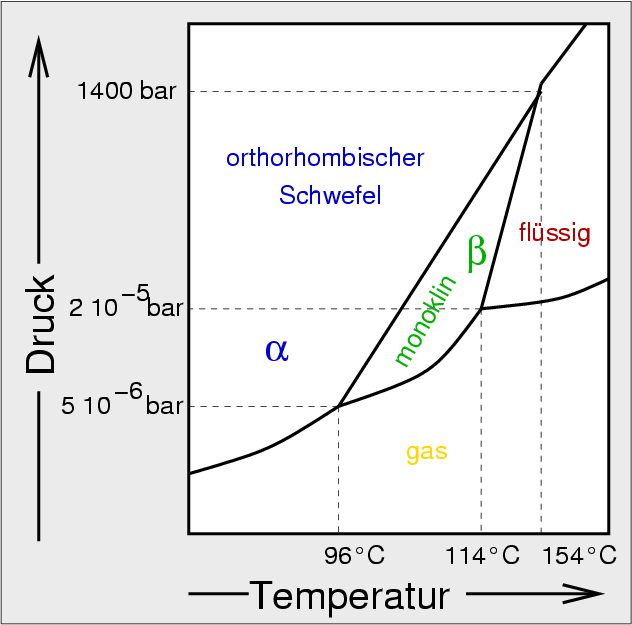
Schwefel steht an 16. Stelle in der Häufigkeit. Elementarer Schwefel
war bereits im alten Ägypten bekannt und wurde zum Ausräuchern und in der Medizin verwendet.
Selen und Tellur wurden beide erst sehr spät entdeckt.
Polonium hat keine stabilen Isotope und ist nach Heimat der Entdeckerin
M. Curie (Polen) genannt.
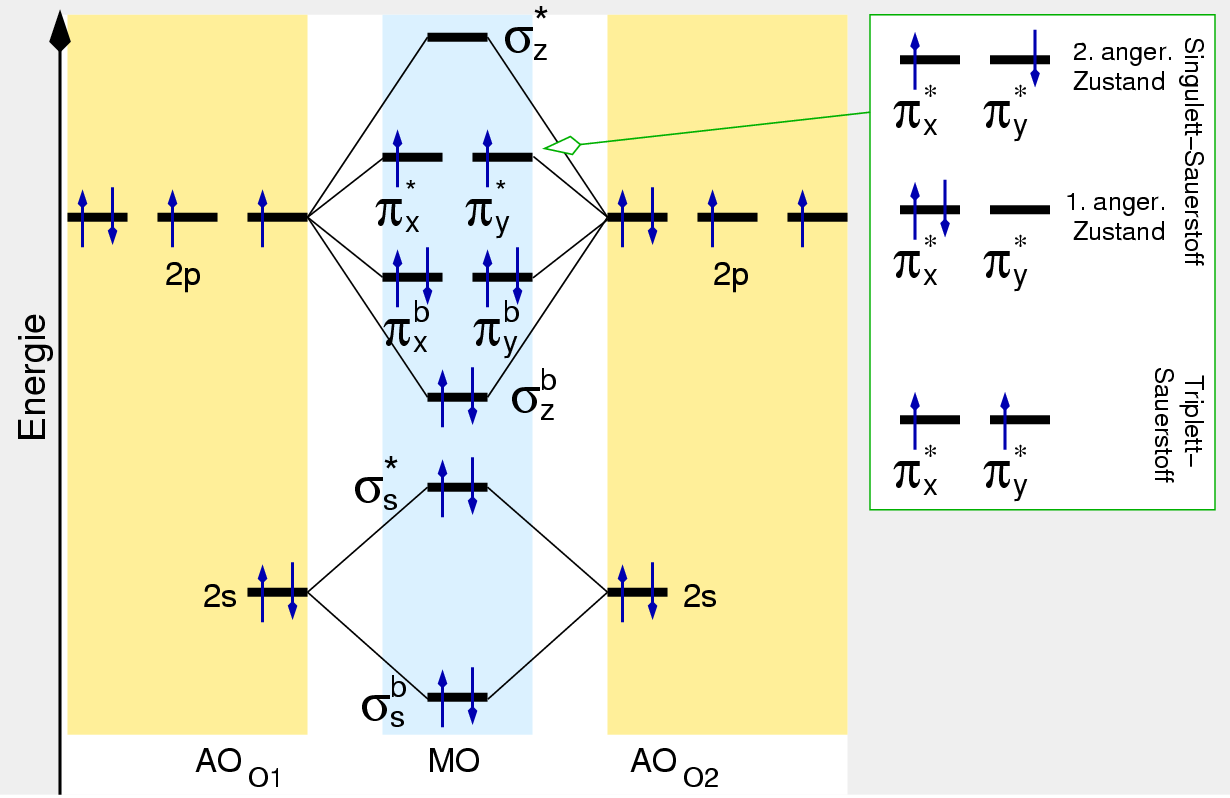
Die Elemente der VI. Hauptgruppe bzw. der 16. Gruppe haben die Elektronenkonfiguration
s2p4, d.h. sie sind in kovalenten Verbindungen 2-bindig
und bilden in Salzen 2-fach negative Anionen.
Die physikalischen Parameter der Atome sind in Tabelle 5.1.1. zusammengestellt.
| |
Sauerstoff |
Schwefel |
Selen |
Tellur |
Polonium |
| EA [eV] |
-1.46 |
-2.07 |
-2.02 |
-1.97 |
|
| EN |
3.5 |
2.4 |
2.5 |
2.0 |
|
| IE [eV] |
13.6 |
10.4 |
9.8 |
9.0 |
|
| E0 [V] |
+1.23 |
+0.144 |
+0.40 |
-0.69 |
|
| EX2->2X [kJ/mol] |
499 |
430 |
308 |
225 |
|
| Mp [oC] |
-219 |
120 |
217 |
452 |
254 |
| dX-X [pm] |
66 |
104 |
117 |
137 |
|
| rX2- [pm] |
140 |
184 |
198 |
222 |
|
| sonstige Tendenzen |
-> Affinität zu elektronegativen Elementen zunehmend -> |
| -> metallischer Charakter zunehmend -> |
| -> Affinität zu elektropositiven Elementen abnehmend -> |
| -> Reaktionsfähigkeit und Oxidationsvermögen abnehmend -> |
Tab. 5.1.1. Physikalische Parameter elementarer Chalkogene
Im Vergleich zu den Halogenen ist die Elektronegativität der Chalkogene deutlich kleiner,
die Elektronenaffinitäten EA sind weniger negativ
und die Ionisierungsenergien IE kleiner. Damit ist die
Bildung von Anionen weniger exotherm, die Bildung von Kationen ist
begünstiger als bei den Halogenen.
Vorkommen
- Sauerstoff
ist das häufigstes Element der Erdkruste und macht
46 Massen-% der Lithosphäre, 23 Massen-% der Atmosphäre
und 85 Massen-% in der Hydrosphäre aus.
Einige Verbindungen sind dabei extrem häufig wie z.B.
SiO2,
H2O oder einige Metalloxide.
- Schwefel steht an 16. Stelle in der Häufigkeit
aller Elemente. Er kommt elementar in Lagern aus reinem Schwefel vor.
Im Erdöl und in der Kohle sind ebenfalls erhebliche Mengen
Schwefel(verbindungen) enthalten, so dass das bei der Verbrennung
gebildete SO2 ein gravierende Umweltproblem darstellt.
Weitere wichtige Vorkommen sind sulfidische Erze
(Kiese, Glanze, Blenden)
wie z.B. FeS2 (Pyrit) oder ZnS (Zinkblende) sowie
Sulfate wie z.B. BaSO4 (Schwerspat) oder
CaSO4 . 2H2O (Gips).
- Selen
kommt als Begleiter von elementarem Schwefel vor, Se-Minerale
sind dagegen sehr selten.
- Tellur
kommt in Telluriden gemeinsam mit Sulfiden vor,
z.B. in Schwermetall-Telluriden wie Ag2Te oder
Pb2Te.
Elementar (gediegen) ist Tellur selten.
Daneben finden sich auch natürlich vorkommende Tellurite
mit dem Anion [TeIVO3]2-
- Von Polonium gibt es 27 verschiedene Isotope
mit Massen zwischen 192 und 218. Am einfachsten herzustellen ist 21084Po,
das bei Bestrahlung von 20984Bi mit Neutronen und Protonen
entsteht. Alle Polonium-Isotope zerfallen mit stark unterschiedlichen
Halbwertszeiten zwischen 138 Tagen (21084Po) und
102 Jahren (20984Po) in α-Form-Zerfällen zu den
entsprechenden Blei-Isotopen. Polonium kommt in den Uran-Zerfallsreihen
vor und ist deswegen in der Pechblende enthalten.
Gewinnung und Verwendung
- Sauerstoff
wird durch fraktionierte Destillation der Luft nach dem seit 1905 betriebenen Linde-Verfahren
gewonnen (s. unter Gewinnung der Edelgase).
Elementarer Sauerstoff schmilzt bei -219 oC, die flüssige Form
ist blau. Der Siedepunkt betägt -183 oC.
Die Weltproduktion von Sauerstoff beträgt ca. 100 .106 t.
Im vorletzten Jahrhundert war die einzige Methode zu Herstellung die Zersetzung von
Bariumperoxid:
2 BaO + O2 <⟶ 2 BaO2
Reinst-O2 kann durch Elektrolyse von KOH erhalten werden.
60 % des gewonnenen Sauerstoffs werden für die Stahlverarbeitung (Entkohlung) benötigt.
Die Löslichkeit von O2 in H2O beträgt bei 25 o
0.049 l/l und ist die Voraussetzung für das Leben im Wasser.
- Schwefel kann je nach Vorkommen auf
verschiedenen Wegen gewonnen werden:
- Zur Gewinnung aus Lagern elementaren Schwefels (z.B. in Lousiana)
wird das sogenannte Frash-Verfahren verwendet.
Hierbei wird nach einem 1891 entwickelten Verfahren
in den unterirdischen (ca. 500 m tief) Schwefel-Lagern
der Schwefel mit Wasserdampf aufgeschmolzen und dann mit Druckluft gefördert.
Hierzu wird ein Dreifachrohr verwendet, das so aufgebaut ist, dass
gleichzeitig Wasser und Druckluft in das Bohrloch hinein und geschmolzener
Schwefel aus ihm heraus geführt werden können.
Der gewonnene Schwefel hat eine Reinheit von bis zu 99.9 %.
- Heute übersteigt die Gewinnung von Schwefel
aus saurem Erdgas, das bis zu 20 % H2S enthalten kann,
die aus der Frash-Produktion erhaltenen Anteile. Die Darstellung
elementaren Schwefels wird hier in den folgenden Teilschritten durchgeführt
- Absorption von H2S an Monoethanolamin.
- Gewinnung des Schwefels nach dem Claus-Verfahren (seit 1880)
in den folgenden Teilreaktionen:
- Bei niedrigen Temperaturen kann bei der Verbrennung von H2S eine partielle Oxidation
erreicht werden:
H2S + 1/2 O2 ⟶ 1/8 S8 + H2O
- Beim Claus-Prozess wird bis zum SO2 oxidiert:
H2S + 3/2 O2 ⟶ SO2 + H2O
- und anschließend mit weiterem Schwefelwasserstoff eine Symproportionierung
an Oxidkatalysatoren bei 300oC durchgeführt:
2 H2S + SO2 ⟶ 3/8 S8 + 2 H2O
Die Herstellung elementaren Schwefels aus Erdöl gelingt analog.
- Für die Verwendung in der Produktion von Schwefelsäure H2SO4
wird Pyrit abgeröstet:
FeS2 + 7/2 O2 ⟶ 2 SO2 + Fe2O3
- Für die Gewinnung von S-Verbindungen aus Anhydrid/Gips sind folgende Prozesse wichtig:
- Beim sogenannten Müller-Kühne-Prozeß
wird Calciumsulfat in einem Drehrohrofen bei 1300 oC mit Koks
umgesetzt:
2 CaSO4 + C 2 CaO + 2 SO2 + CO2
- Für die Herstellung von Düngemitteln
kann ein Gemisch von Ammoniak/CO2 in eine Gipsaufschlämmung
eingeleitet werden:
CaSO4 + (NH4)2CO3 ⟶ CaCO3 + (NH4)2SO4
85 % des gewonnen Schwefels werden für die Produktion von Schwefelsäure
verwendet. Kleine Mengen werden zum Vulkanisieren, für
die Herstellung von CS2, Zinnober usw.
bzw. als Brennstoff in Na-S-Zellen (s. Abb. 5.1.1.) eingesetzt.
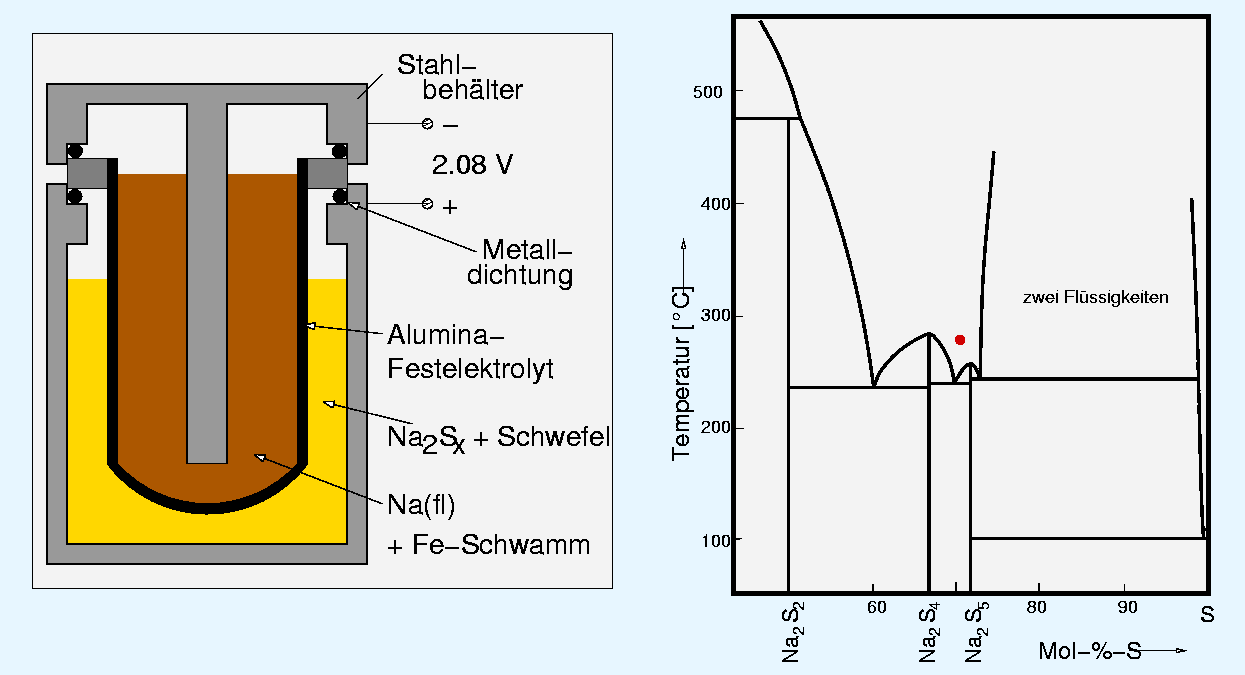 |
| Abb. 5.1.1. Natrium-Schwefelzelle (links)
und Phasendiagramm Na-S (rechts)
‣SVG
|
- Selen und Tellur
werden aus dem Anodenschlamm der Cu-Elektrolyse gewonnen. Die Weltjahresproduktion liegt bei 1500 t (Se) bzw. 150 t (Te).
Selen wird wegen seiner Halbleitereigenschaften in der Xerographie (Kopierer) verwendet.
CdSe ist ein Rotpigment, auch Cd-Sulfoselenide finden als Pigmente noch Verwendung.
Halbleitende Se- und Te-Verbindungen wie z.B. Bi2Se3 werden als
Thermoelektrika verwendet.
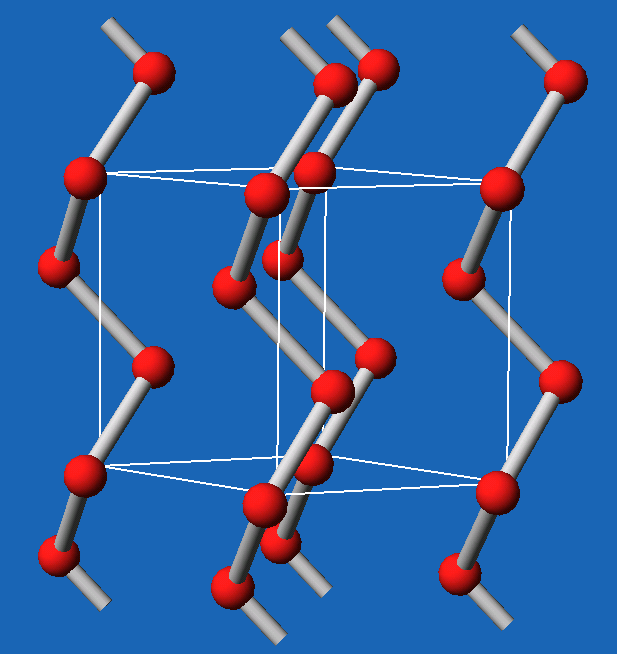
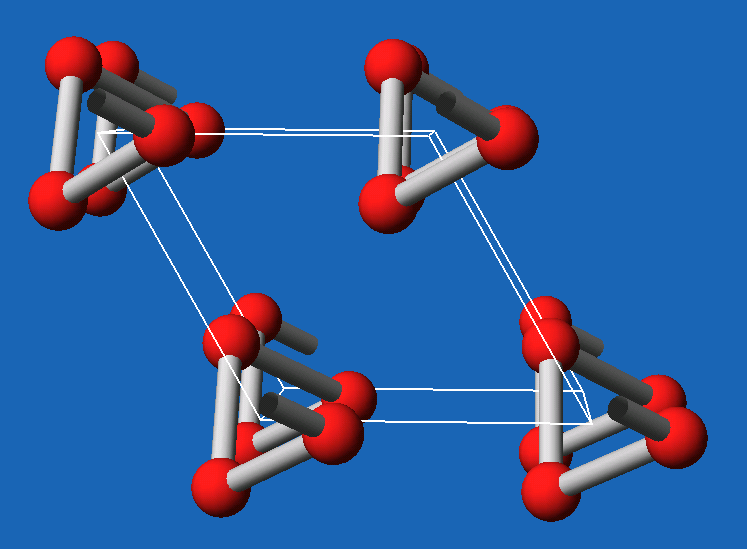
Eigenschaften, Strukturen, Modifikationen
Weitere Details zur Strukturchemie der Chalkogene finden sich
im Kap. 2.2.3. der Vorlesung
Anorganische Strukturchemie.
Element-Ionen
Die Chalkogene bilden verschiedene Anionen und Kationen mit Element-Element-Bindungen,
die in Tabelle 5.1.2. zusammengestellt sind.
| Sauerstoff |
Schwefel |
| Beispiel |
Name |
Salz |
Beispiel |
Name |
Salz |
| Anionen |
| O2- |
Oxid |
MgO, Na2O |
S2- |
Sulfid |
ZnS |
| O22- |
Peroxid |
Na2O2 |
S22- |
Disulfid |
FeS2 |
| O2- |
Hyperoxid |
KO2 |
... |
|
|
| O3- |
Ozonid |
CsO3 |
Sn2- |
Polysulfide |
|
| Kationen |
| O2+ |
Dioxigenyl |
O2[PtF6] |
S42+ |
Tetraschwefel-Dikation |
S4[SO3F]2 |
| |
S82+ |
Octaschwefel-Dikation |
S8[SO3F]2 |
| |
S192+ |
Nonadecaschwefel-Dikation |
|
Tab. 5.1.2. Sauerstoff- und Schwefel-Anionen und -Kationen
Weitere Details zur Strukturchemie der Oxid-Ionen finden sich im Kap. 3.1 der Vorlesung
Strukturchemie der Oxide. Polysulfide sind aus der Analytik gut bekannt.
Bindungstheoretisch besonders interessant sind die Polyschwefel-Dikationen mit
aromatischen Bindungsanteilen bzw. S-S-Teilbindungen (s. hierzu die sehr ausführlichen
Abschnitte im Steudel, Nichtmetallchemie).