Vorlesung Chemie der Nichtmetalle
8. Nichtmetall der 3. Hauptgruppe: Bor
8.3. Borane
|
Die Bor-Wasserstoff-Verbindungen bilden eine sehr große Gruppe vor allem bindungstheoretisch
interessanter Verbindungen. Die einfachste und wichtigste Verbindung ist:
B2H6 (Diboran)
Es handelt sich um ein Molekül mit 2-Elektronen-3-Zentren-Bindung und
kann auf verschiedene Weisen hergestellt werden:
- BCl3 + 3 LiAlH4 ⟶ 2 B2H6 + 3 LiAlCl4
- 4BF3 + 3 NaBH4 ⟶ 2 B2H6 + 3 NaBF4
Diboran ist ein farbloses, giftiges Gas, das sich oberhalb 50o in Polyborane,
oberhalb 300o in die Elemente zersetzt und von
H2O zu B(OH)3 und 6 H2 hydroysiert wird.
Beim Verbrennen entsteht Boroxid:
B2H6 + 3 O2 ⟶ B2O3 + 3 H2O; ΔH0= -2066 kJ/mol
Das Molekül enthält zwei offene 3-Zentren-2-Elektronen-Bindungen, die Bor-Atome sind
jeweils verzerrt tetraedrisch koordiniert.
Poly-Borane
Polyborane lassen sich allgemein auf verschieden Wege herstellen:
- MgB2 + nichtoxidierende Säuren
- Pyrolyse von Boranen
Die Polyborane sind wie Dibroran sehr giftig, bis B4 sind sie gasförmig,
bei B5-9 flüssig. Alle Verbindungen sind hydroyseemfindlich und selbstentzündlich.
Von den Boranen leiten sich Anionen (formal BxHy + H-, Boranate)
und die Carbaborane: BxHxC2 (statt Di-Anion) ab.
Tab. 8.3.1. Borane in der Übersicht (mit VRML-Links)
Alle höhreren Borane lassen sich von geschlossenen Polyedern, die nur Dreieckflächen
als Begrenzungsflächen aufweisen, ableiten. Dies sind:
- Oktaeder (6)
- pentagonale Bipyramide (7)
- (8)
- (9)
- zweifach überkapptes quadratisches Antiprisma (10)
- Ikosaeder (12)
In allen Verbindungen ist B immer 4-fach (verzerrt tetraedrisch)
koordiniert. Außer in den Closoverbindungen lassen sich immer zwei Sorten von H-Atomen
unterschieden: Die exo-ständigen H-Atome sind einfache B-H-Bindung. Sie weisen vom Clusterzentrum
weg. Am Rand der 'nicht-closo'-Cluster liegen offene
B-H-B-2-Elektronen-3-Zentren-Bindungen.
Die Wade-Regeln für Bor/Borane, die aber auch auf andere
elektronenarme Verbindungen wie z.B. die "Ubergangsmetallcluster
oder Metallide übertragen werden können, machen Aussagen über die
generelle Form der Moleküle im Zusammenhang mit den für die chemische
Bindung im Cluster verbleibende Gerüstelektronenpaaren:
- Closo-Borane (1. Zeile der Tabelle 8.3.1.) haben N+1 Gerüstelektronenpaare.
Die Strukturen bestehen aus geschlossenen Polyedern.
Neutrale BnHn+2 ist unbekannt, man kennt
aber die anionischen Boranate der allgemeinen
BnHn2- für n = 6 - 12.
Die Molekülstrukturen bestehen aus geschlossenen Käfigen
aus Bor-Atomen, die jeweils ein H-Atom tragen (exohedarles H). Dabei
zeigt die Bindung B-H auf das Zentrum des Polyeders zu, diese Bindungen
sind normale 2-Elektronen-2-Zentren-Bindungen.
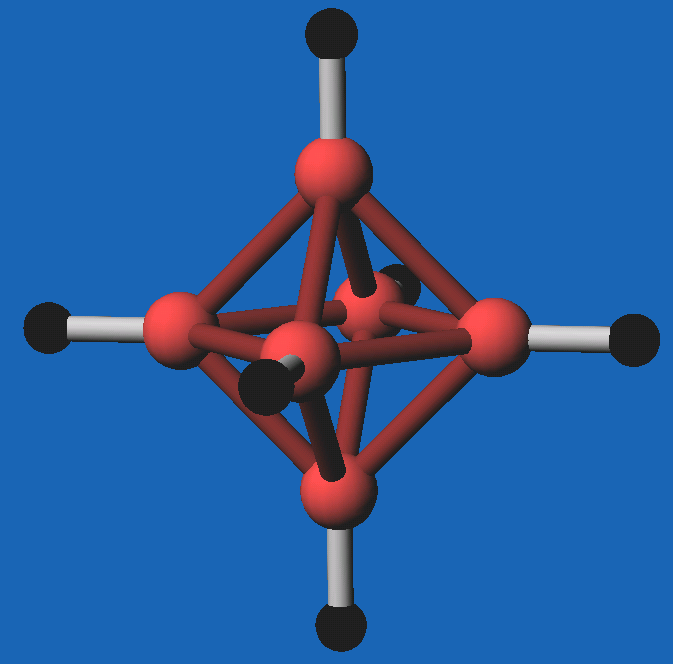
Die Elektronen-Bilanz z.B. für B6H62-
(ideales Oktaeder, a. Abb. 8.3.1.)
ergibt:
6*3 (6*B) + 6 (6*H) + 2 (Ladung) = 26 - 2*6 (6 Exo-H) = 14/2 = 7
 |
 |
| Abb. 8.3.1.
B6H62-: Molekülanion
‣VRML
|
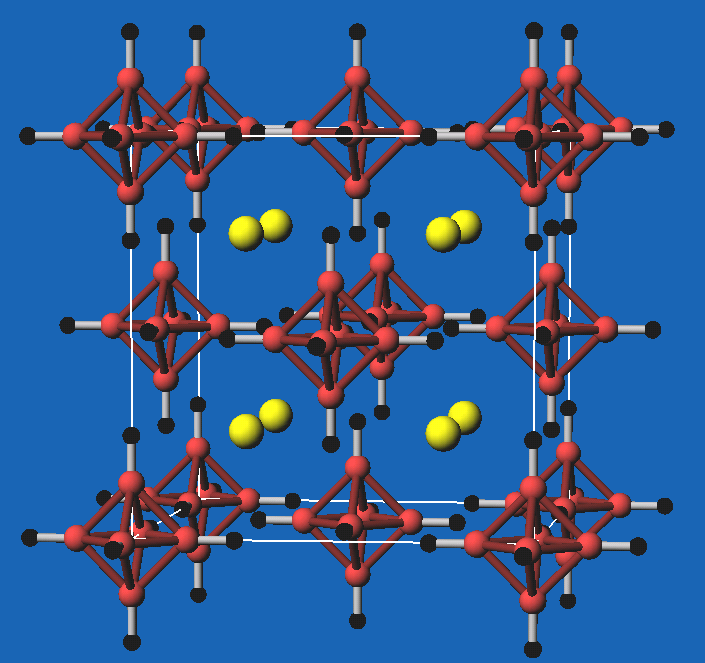
Abb. 8.3.2. K-Salz dazu
‣VRML
|
Mit 10-Ecken ergibt sich als Grundpolyeder ein zweifach überkapptes quadratisches
Antiprisma, s. Abb. 8.3.3. und 8.3.4. für das Cu-Salz.
 |
 |
| Abb. 8.3.3.
B10H102--Molekülanion
‣VRML
|
Abb. 8.3.4. Cu-Salz dazu
‣VRML
|
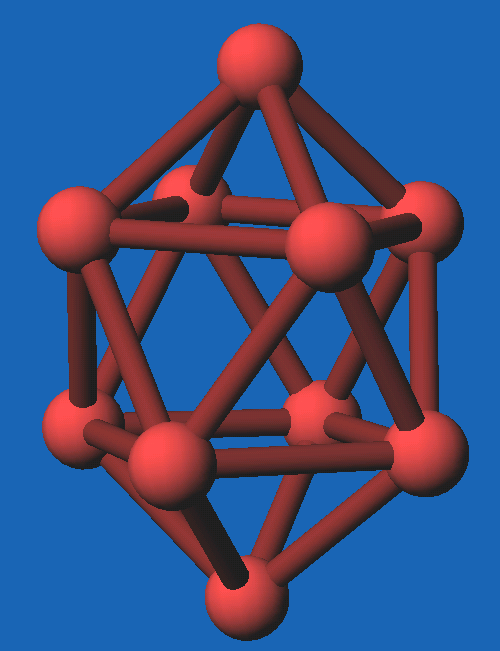
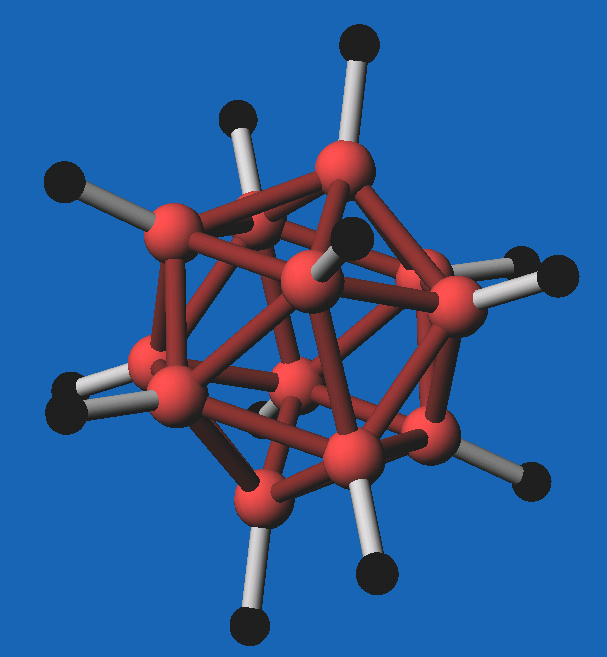
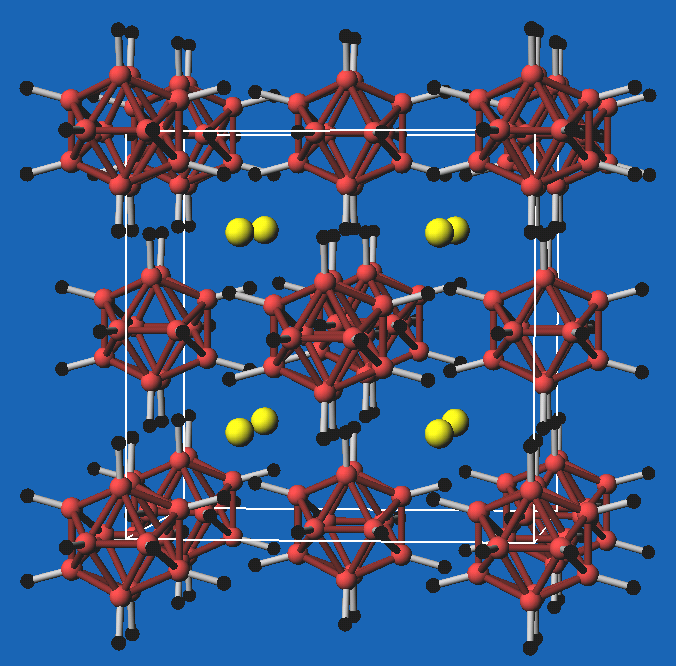
Ikosaedrische Cluster liegen im Boranat [B12H12]2-
vor. In Abb. 8.3.5. und 8.3.6. sind die Abbildungen zum Rb-Salz dargestellt:
 |
 |
| Abb. 8.3.5.
B12H122--Molekülanion
‣VRML
|
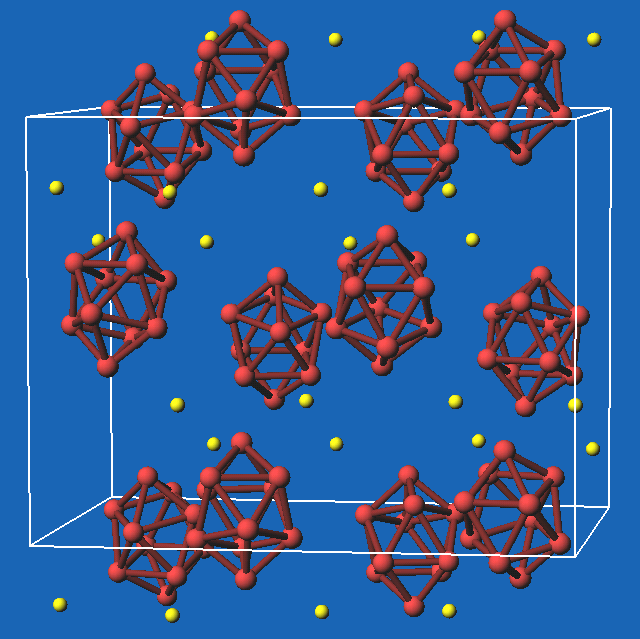
Abb. 8.3.6. Rb-Salz dazu
‣VRML
|
- Nido-(Nest)-Borane (2. Zeile der Tabelle 8.3.1.) haben N+2 Gerüstelektronenpaare.
Dem Grundpolyeder fehlt eine Ecke. Neutrale Borane haben die
Summenformel BnHn+4, die anionischen
Verbindungen die Formeln BnHn+3- bzw.
BnHn+22-.
Die Strukturen bestehen aus geschlossenen Polyedern, denen eine
der B-Ecken fehlt. An den damit entstehenden Kanten befinden sich
offene B-H-B 2-Elektronen-3-Zentren-Bindungen. In den Abbildungen
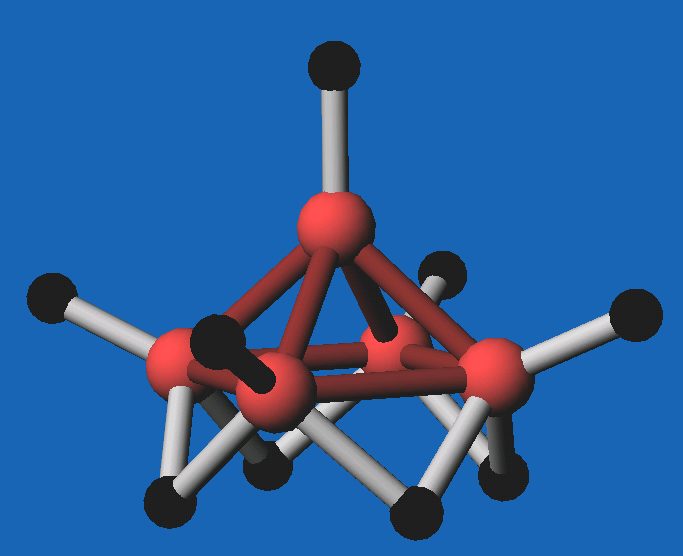
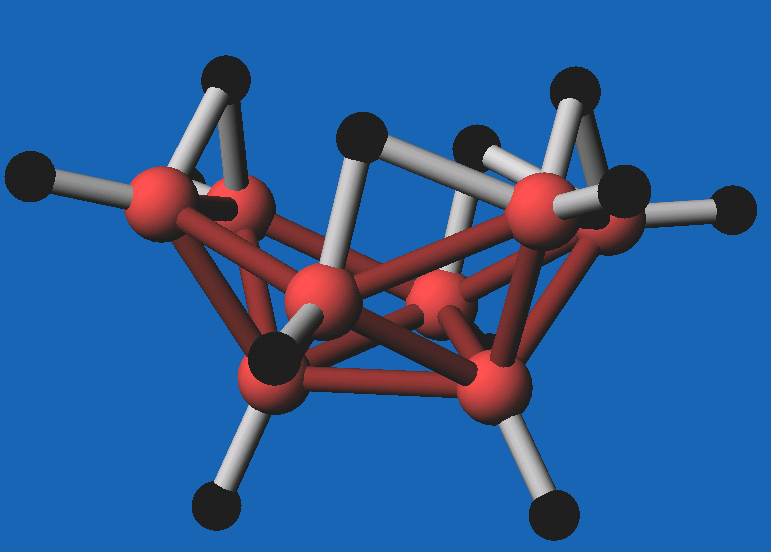
8.3.7. bis 8.3.9 sind als Beispiele die neutralen Borane
B5H9, B8H12 und
B10H14 abgebildet.
 |
 |
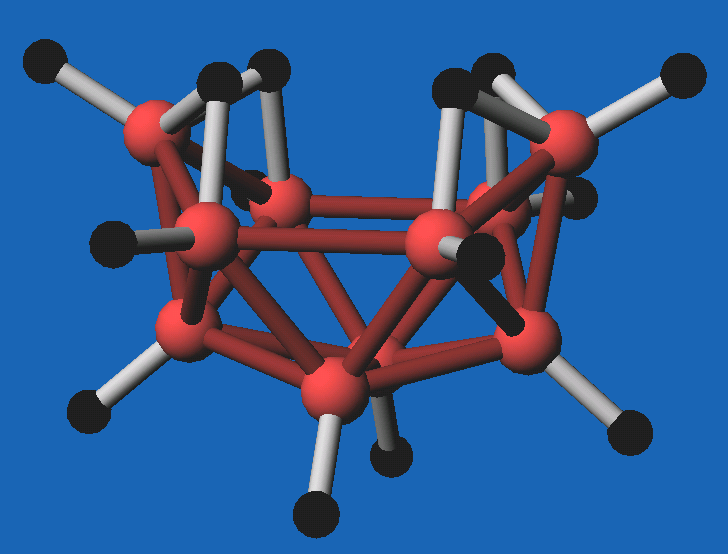 |
| Abb. 8.3.7.
B5H9
‣VRML
|
Abb. 8.3.8.
B8H12
‣VRML
|
Abb. 8.3.9.
B10H14
‣VRML
|
Die Elektronenbilanz für B5H9 ergibt sich nach:
5*3 (B-Atome) + 9 (H-Atome) = 24 - 2*5 (Exo-H) = 14/2 = 7 Elektronenpaare = N+2
- Arachno-(Spinne)-Borane (3. Zeile der Tabelle 8.3.1.) haben N+3 Gerüstelektronenpaare,
dem Grundpolyeder fehlen zwei Ecken. Die neutralen Wasserstoffverbindungen
haben die Formel BnHn+6, die anionisch sind
BnHn+5- bzw. BnHn+42-.
Wie bei den Nido-Boranen liegen an den durch die
Defekte im Grundpolyeder entstehenden offenen Kanten B-H-B 2-Elektronen-3-Zentren-Bindungen
vor.
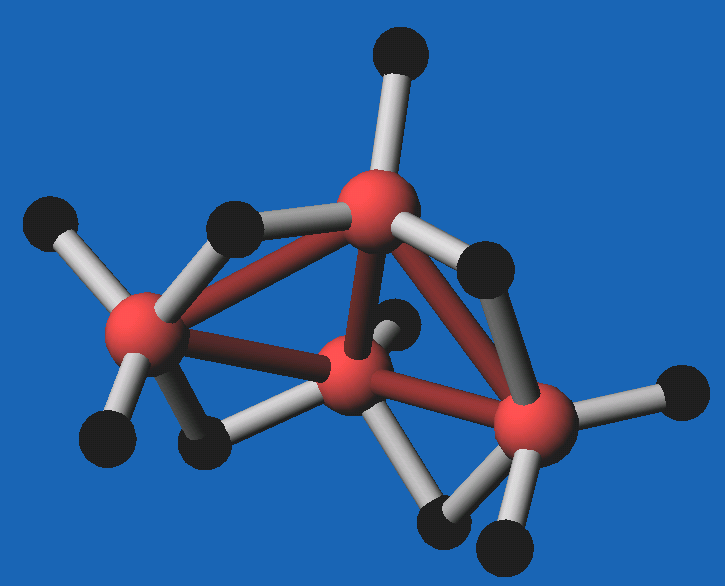 |
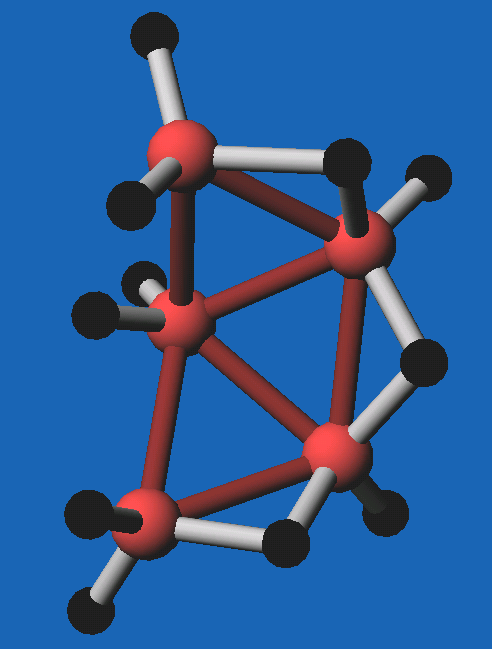 |
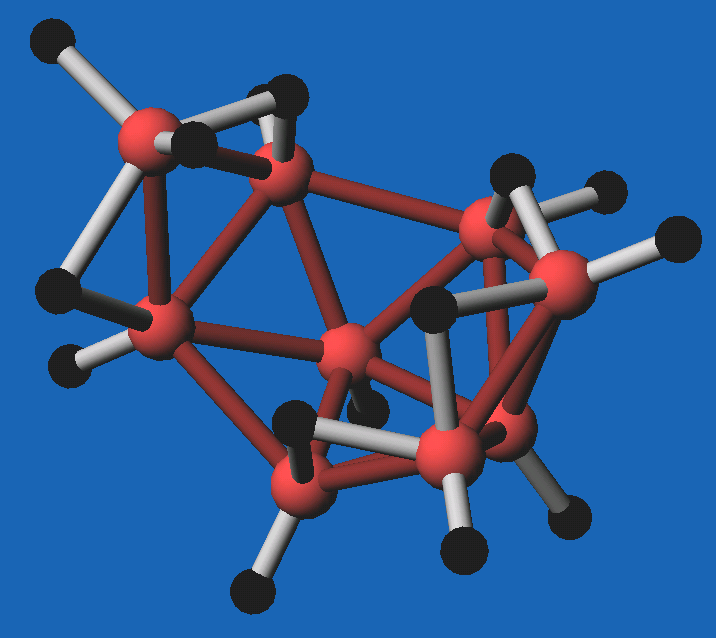 |
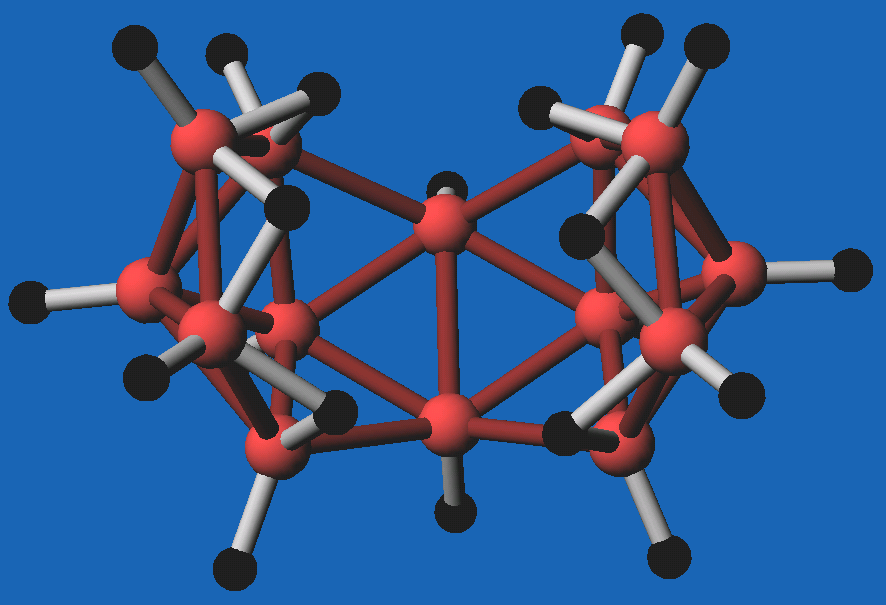 |
| Abb. 8.3.10.
B4H10
‣VRML
|
Abb. 8.3.11.
B5H11
‣VRML
|
Abb. 8.3.12.
B9H15
‣VRML
|
Abb. 8.3.13.
B14H20
‣VRML
|
Die Elektronenbilanz von B4H10 ergibt sich z.B. zu
4*3 (B-Atome) + 10 (H-Atome) = 22 - 2 * 4 (Exo-H) = 14 / 2 = 7 = N+3
- Hypho-(Netz)-Borane mit N+4 Gerüstelektronenpaaren (4. Zeile
der Tabelle 8.3.1.) sind selten.
Dem Grundpolyeder, der meist schon nicht mehr sinnvoll zu erkennen ist, fehlen drei Ecken.
Neben diesen Grundboranen gibt es weitere interessante Verbidungen.
- Beispiele für komplizierte Gerüste mit konkaven Polyederflächen sind
in den folgenden Abbildungen gezeigt:
 |
 |
 |
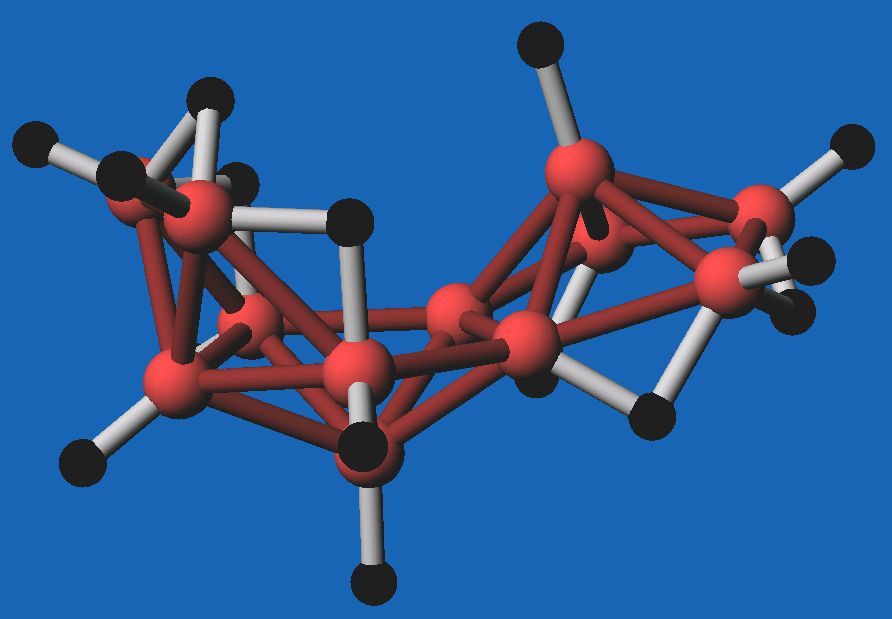
| Abb. 8.3.14.
B12H16
‣VRML
|
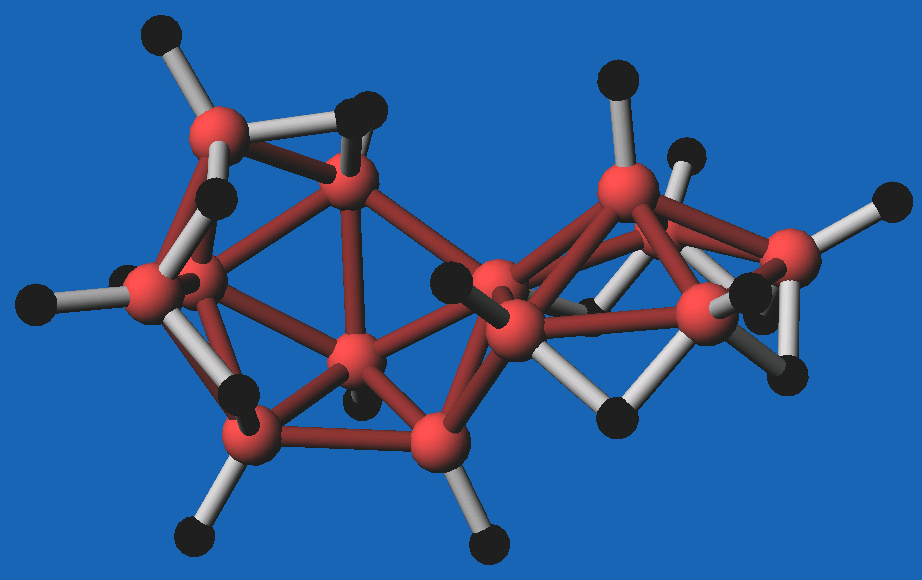
Abb. 8.3.15.
B13H19
‣VRML
|
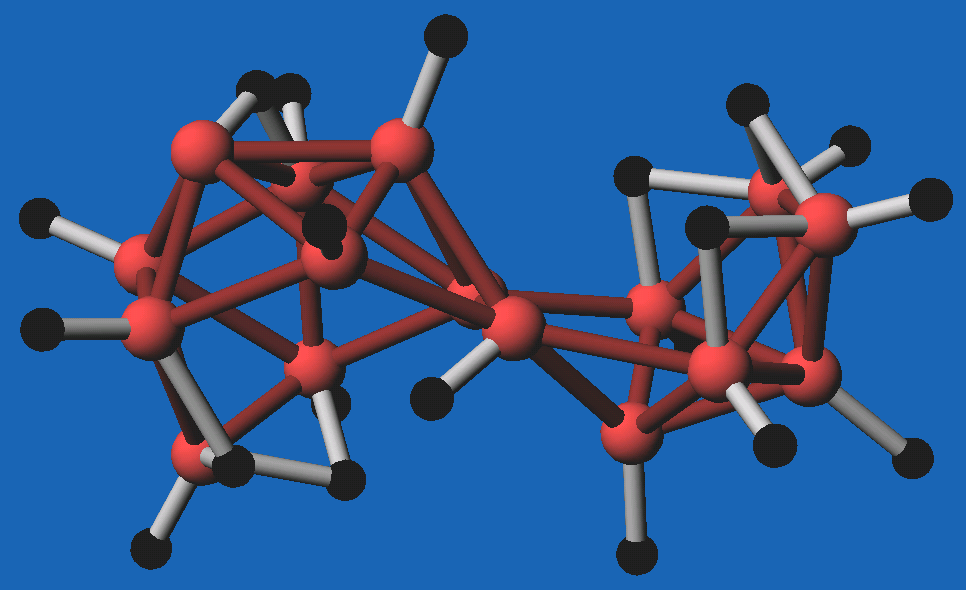
Abb. 8.3.16.
B16H20
‣VRML
|
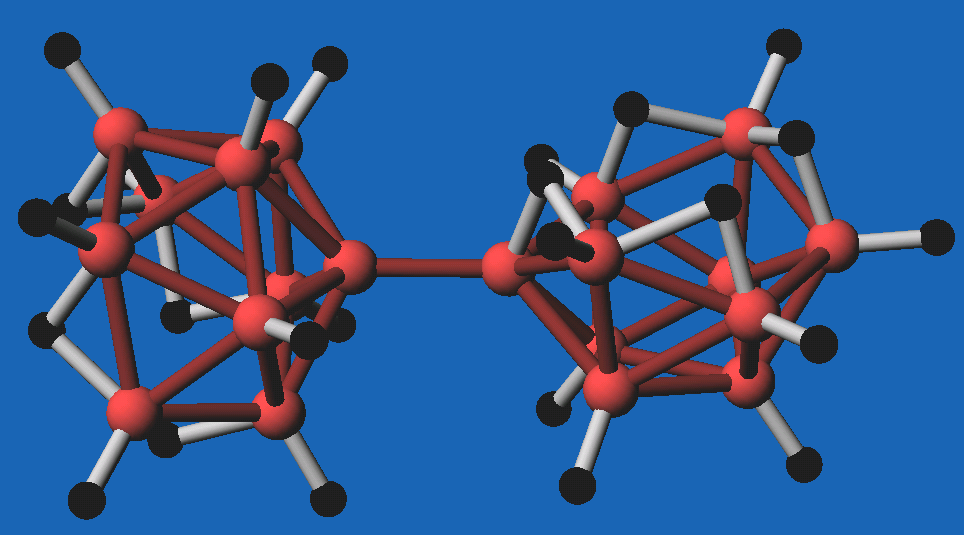
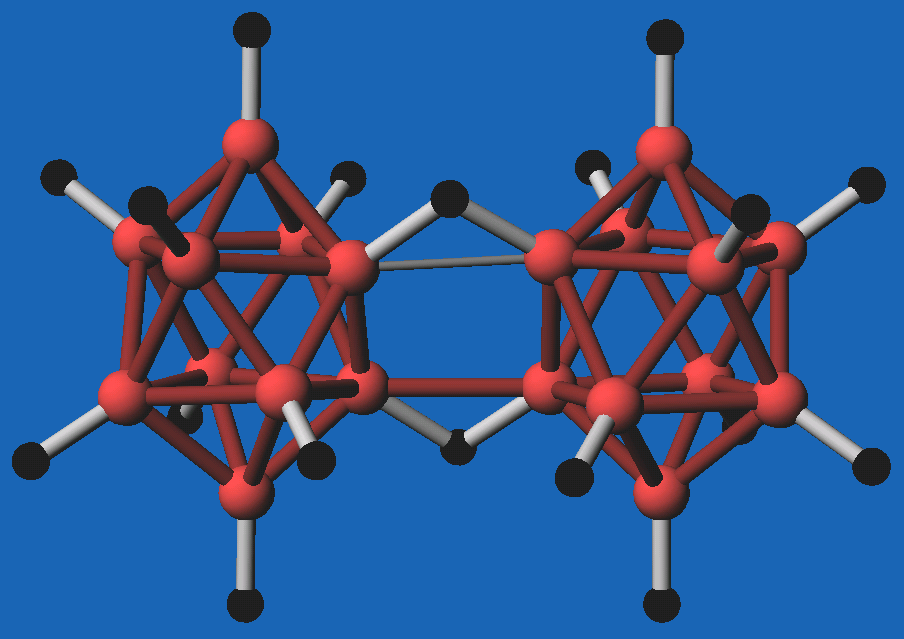
- Bei den sog. Conjuncto-Boranen sind die oben beschriebenen einfachen
Borane über verschiedene Bindungen zusätzlich miteinander verknüpft:
 |
 |
| Abb. 8.3.16.
B20H26
‣VRML
|
Abb. 8.3.17.
Rb2B20H18
‣VRML
|

















