SiO2 und Silicate
Eine Kurzeinführung in die Strukturprinzipien
SiO2
Die wichtigsten Modifikationen von SiO2 hier als VRML-Bilder:
Genauere Erklärungen hierzu (inkl. Phasenbeziehungen usw.) finden sich
in der Vorlesung Strukturchemie der Oxide (Kap. 2.5.) .
Silicate
Silicate sind Hauptbestandteil der Erdkruste. Sie enthalten neben Silicium und Sauerstoff
verschiedene Metall-Kationen wie z.B. Na+, K+, Ca2+ usw.
Ihre Strukturen lassen sich
sämtlich aus über O-Ecken unterschiedlich verknüpften
SiO4-Tetraedern beschreiben. Je nach Zusammensetzung ergeben sich
dabei Bauverbände 'zwischen' den Grenzfällen:
- SiO2 (Tetraeder über alle O-Ecken verknüpft (O:Si=2)) und
- Verbindungen mit isolierten SiO4-Tetraedern (O:Si=4)
Die folgenden Abbildungen zeigen Beispiele für Silicate im
wesentlichen geordnet nach fallendem O:Si-Verhältnis (entsprechend
der Strunz-Systematik, Benennung nach Liebau)
In allen Fällen sind die SiO4-Tetraeder blau dargestellt,
die weiteren Kationen sind durch Kugeln gekennzeichnet.
In einzelnen
Strukturen sind auch die Koordinationspolyeder um die Kationen
mit eingezeichnet. Die VRML-Bilder enthalten nur die Polyeder!
1. Insel-(Neso)-Silicate
Die Insel- oder Neso-Silicate enthalten isolierte SiO4-Tetraeder
mit der Formalladung 4-.
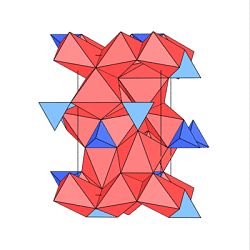 In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
Die Gruppe der Granate basiert dagegen auf einer kubisch dichten
Kugelpackung
von Oxid-Ionen. Hier gleichen 2- und 3-wertige Kationen die Ladung
der Silicatanionen aus. Der allgemeine Formeltyp ist
A3B2[SiO]4.
Die 2-wertigen A-Kationen sind 8-fach, die 3-wertigen B-Kationen 6-fach von
Oxid-Ionen umgeben. Beispiele für Granate sind:
| Name |
Formel |
Farbe |
| Pyrop |
Mg3Al2[SiO]4 |
rotbraun |
| Almandin |
Fe3Al2[SiO]4 |
blutrot |
| Grossular |
Ca3Al2[SiO]4 |
bräunlich |
| Andradit |
Ca3Fe2[SiO]4 |
gelbgrün |
| Spessartin |
Mn3Al2[SiO]4 |
gelbrot |
| Uwarowit |
Ca3Cr2[SiO]4 |
dunkelgrün |
2. Gruppen-(Soro)-Silicate
Die Gruppen- oder Soro-Silicate enthalten über Ecken zu kleineren
Einheiten verknüpfte Silicat-Tetraeder.
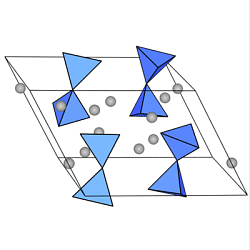 Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
 Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
3. Ring-(Cyclo-)-Silicate
In den Ring- oder Cyclo-Silicaten sind [SiO4]-Tetraeder &uum;ber
zwei der vier Ecken so miteinander verknüpft, daß letztlich Ringe
unterschiedlicher Größe entstehen.
Die kleinsten Ringe sind die Dreiringe [Si3O9] 6-
wie sie z.B. im Benitoit (BaTi[Si3O9])
vorliegen. Die Abbildung links zeigt die Struktur, die Ba2+-Ionen sind grau
die Ti4+-Ionen rot gezeichnet.
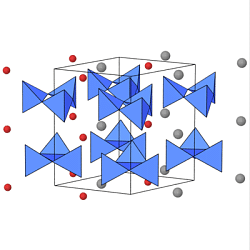

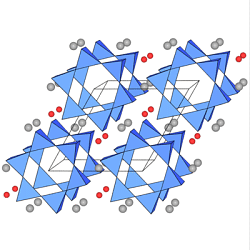 In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
Die Ringe können auch zu
Doppelringen verknüpft sein. Beispiel für ein Mineral mit
4-er-Doppelringen ist der
Ekanit (ThKCaNa[Si8O24]) .
In der Abbildung unten sind die Th-Ionen grau, K schwarz und Ca/Na weiss dargestellt.

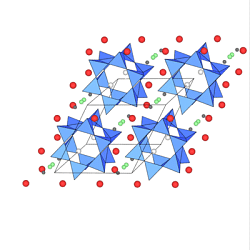 Im Milarit (KCa2AlBe2[Si12O30])
(Abb. oben rechts, K: weiss, Ca: grün, Al/Be: rot, H2O: grün)
liegen entsprechend Doppelsechsringe [Si12O30]12- vor.
Im Milarit (KCa2AlBe2[Si12O30])
(Abb. oben rechts, K: weiss, Ca: grün, Al/Be: rot, H2O: grün)
liegen entsprechend Doppelsechsringe [Si12O30]12- vor.
4. Ketten/Band-(Ino)-Silicate
Die Ketten- und Bandsilicate enthalten eindimensonal unendlich ausgedehnte
Silicat-Teilstrukturen. Einfachketten bestehen nur aus einer Silicattetraederkette.
Je nach Translationsperiode der Kette unterscheidet man
Einer-Einfachketten (Identität nach einem Tetraeder),
Zweier-Einfachketten (Identität nach zwei Tetraedern) und so fort. In den
Bandsilicaten sind zwei oder mehrere Einfachketten zu Bändern verknüpft.
Einfachketten
Einer-Einfachketten sind nicht bekannt.
Die Minerale mit Zweiereinfachketten
lassen sich nach der Zellmetrik zwei unterschiedlichen Gruppen zuordnen:
| Orthopyroxene |
(Laueklasse mmm) |
|
Klinopyroxene |
(Laueklasse 2/m) |
| Enstatit |
Mg2[Si2O6] |
|
Klinoenstatit |
Mg2[Si2O6] |
| Braunit |
(Mg,Fe)2[Si2O6] |
|
Diopsid |
CaMg[Si2O6] |
Unten sind als Beispiele der
Klinoenstatit Mg[SiO3] (links) und
BaSiO3 (Mitte)
dargestellt. Die Erdalkalikationen sind jeweils als graue Kugeln gezeichnet.
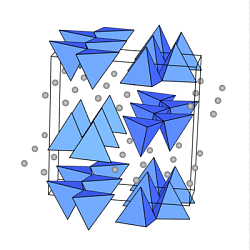

 In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
 Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
5. Schicht-(Phyllo)silicate
Die Schichtsilicate bestehen aus Tetraederschichten (TS), die durch Kondensation
von Zweier-Einfachketten aufgebaut werden können.
Die Tetraeder einer Schicht sind dabei alle in eine Richtung ausgerichtet und
es ist stets eine Oktaederschicht (OS) ankondensiert.
Je nachdem, wie die Oktaederschicht aufgebaut ist, unterscheidet man
in tri-oktaedrische (Oktaederschichten wie z.B. Mg(OH)2)
und di-oktaedrische (Oktaederschichten wie z.B. in Al(OH)3)
Schichtsilicate.
Die weitere Unterteilung erfolgt nach der Schichtenfolge in
kationenarme Schichtsilicate (Schichtfolge TS-OS-TS) und
kationenreiche Schichtsilicate (Schichtfolge Ts-OS).
Aus diesen beiden Unterscheidungen folgen die folgenden Zusammensetzungen:
| |
|
Mg(OH)2-OS |
Al(OH)3-OS |
| TS-OS |
kationenreich |
M3(OH)4[T2O5] |
M2(OH)4[T2O5] |
| TS-OS-TL |
kationenarm |
M3(OH)2[T4O10] |
M2(OH)2[T4O10] |
Als Beispiel sind in den untenstehenden Abbildungen
Muskovit (ganz links), Kaolin (halblinks),
Talk (halbrechts) und Serpentin (ganz rechts)
dargestellt.
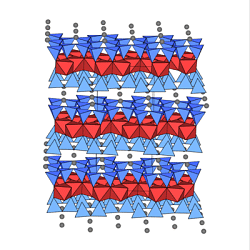
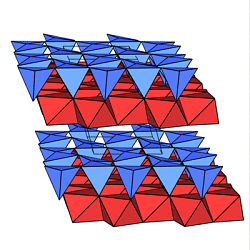
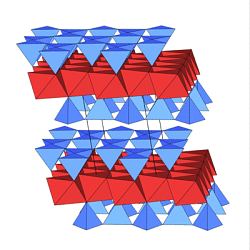

6. Gerüst-(Tecto)-Silicate
Die SiO4-Tetraeder sind wie in den Modifikationen von
SiO2 über alle Ecken zu einem
dreidimensionalen Raumnetz verknüpft. Es handelt sich eigentlich
um Alumosilicate, in denen ein Teil des Si durch Al ersetzt ist und
die dadurch entstehende negative Gerüstladung wird durch Kationen
ausgeglichen.
Die Darstellung der Tetraeder (links) ist sehr unübersichtlich, daher
werden meist vereinfacht
nur noch die Si-Zentren dargestellt. 'Bindungen' bedeuten dann
Verknüpfungen zwischen
SiO4-Tetraedern über ein gemeinsames O-Atom (Abbildungen
rechts).
Feldspäte
VRML (Anorthit)

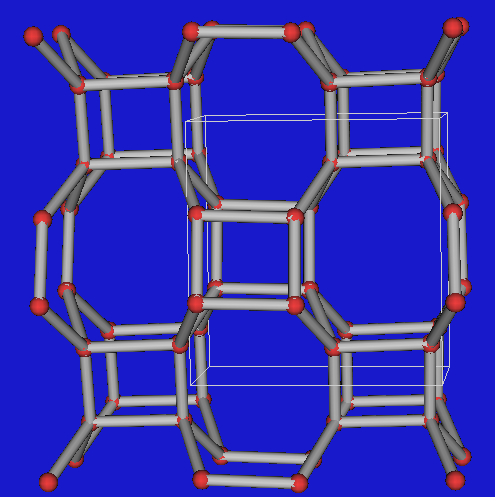
Sodalite
Sodalith (VRML);


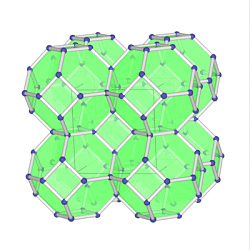 Zeolithe
Zeolithe
 In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
In der Gruppe der Olivine wird die negative Ladung der
Silicat-Anionen durch zwei zweiwertige Kationen/pro Si-Atom ausgeglichen; die Formel ist
demnach A2SiO4.
Olivine sind Mischkristalle aus den Phasen Mg2SiO4
(Forsterit) und Fe2SiO4 (Fayalit).
Die isolierten [SiO4]4--Tetraeder sind hier blau, die
Oktaeder um Mg rot dargestellt. In der Darstellung
einer Schicht sind die isolierten
Tetraeder und die verzweigten kantenverknüpften Ketten aus [AO6]-Oktaedern
gut zu erkennen.
Bei der Anordnung dieser Schichten zur Gesamtstruktur
bleiben die Tetraeder isoliert, die Oktaeder sind an keiner Stelle über Flächen
verknüpft, obwohl die dichten O-Schichten senkrecht zur Zeichenebene
mit der Stapelfolge ABAB angeordnet sind.
 Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
Disilicate enthalten das Anionen
Si2O76-,
das aus zwei über eine gemeinsame O-Ecke verknüpften
SiO4-Tetraedern aufgebaut ist.
Wichtigstes Mineral dieser Gruppe ist
der
Thortveitit (Sc,Y)2[Si2O7].
Technisch wichtig (Hochofenschlacke, Zementklinker) ist der in der Natur nur seltene
Rankinit Ca2Si2O7
 Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.
Links eine Abbildung von Rankinit (Ca: graue Kugeln),
rechts die Struktur des Minerals
Zunyit (Al13Si5O20(OH)14F4Cl) ,
in dem die seltenen pentameren Silicatanionen
[Si5O16]12- vorliegen.
Die 12 Oktaeder und das eine Tetraeder um Al,
die gemeinsam die von den Heteropolysäuren bekannte Keggin-Struktur bilden,
sind grün dargestellt. Die Halogenid-Ionen sind als rote Kugeln gekennzeichnet.


 In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit).
In der Mitte sind die Vierring-Anionen [Si4O12]8- im
Sr-Tetrasilicat
Sr4[Si4O12] dargestellt (Sr=graue Kugeln).
Rechts die Sechsring-Anionen
[Si6O18]12- im
Beryll Al2Be3[Si6O18]
(Be=grau, Al=rot)
(Edelstein-Varietäten des Berylls sind Smaragd (Al3+ durch Cr3+ ersetzt) und
Aquamarin (Ersatz von Al3+ durch Fe2+/3+).
Turmaline enthalten ebenfalls Sechsringe.
Es handelt sich um eine Reihe isotyper Phasen der Zusammensetzung
(Na,Ca)(Mg,Fe,Al,Li)[(OH)4/(BO3)3/Si6O18]
(Beispiel: Schörl=schwarzer Turmalin mit
einem Na+ und drei Fe2+-Ionen pro Formeleinheit). 



 In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
In den Silicaten mit Dreier-Einfachketten
(z.B. im Wollastonit Ca[SiO3]
(Abb. oben rechts) wird die Identität erst nach drei Tetraedern erreicht.
 Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.
Die Bandsilicate werden auch
Amphibole oder Hornblenden genannt.
Als Beispiel für diese Silicatgruppe ist die
Zweier-Doppelkette im
Tremolit (
Ca2Mg5[Si8O22(OH)2) gezeigt.
Die Sauerstoff-Oktaeder um Mg2+ sind rot dargestellt.








 Zeolithe
Zeolithe