

| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |
 |
 |
| 2.5.1. Obsidian | 2.5.2. Tektit |
Das technisch wichtige Quarzglas weist einen Erweichungspunkt von ca. 1500 oC, einen geringen thermischen Ausdehnungskoeffizienten, hohe Transparenz für UV-Licht und große chemische Indifferenz auf. Es findet weite Verwendung, hauptsächlich auch im Labor, ist jedoch schwerer zu verarbeiten als 'Normalglas'. In der Struktur liegen eckverknüpfte SiO4-Tetraeder ohne Fernordnung vor. Andere amorphe Formen von technischer Bedeutung sind
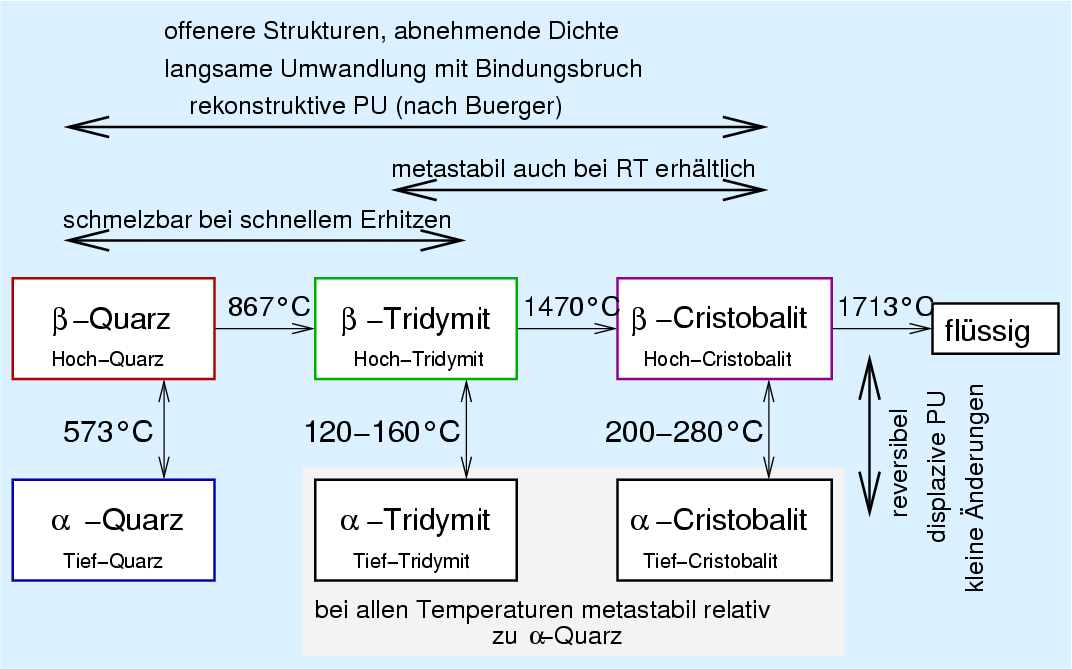 |
2.5.3. Phasenumwandlungen von SiO2 |
Das vollständige p-T-Phasendiagramm (Abb. 2.5.4.) zeigt die Umwandlungspunkte der kristallinen Phasen sowie die Stabilitätsbereiche in Abhängigkeit von Temperatur und Druck. Zusätzlich zu den Normaldruckphasen sind damit die Hochdruckphasen Coesit, Keatit und Stishovit bekannt.
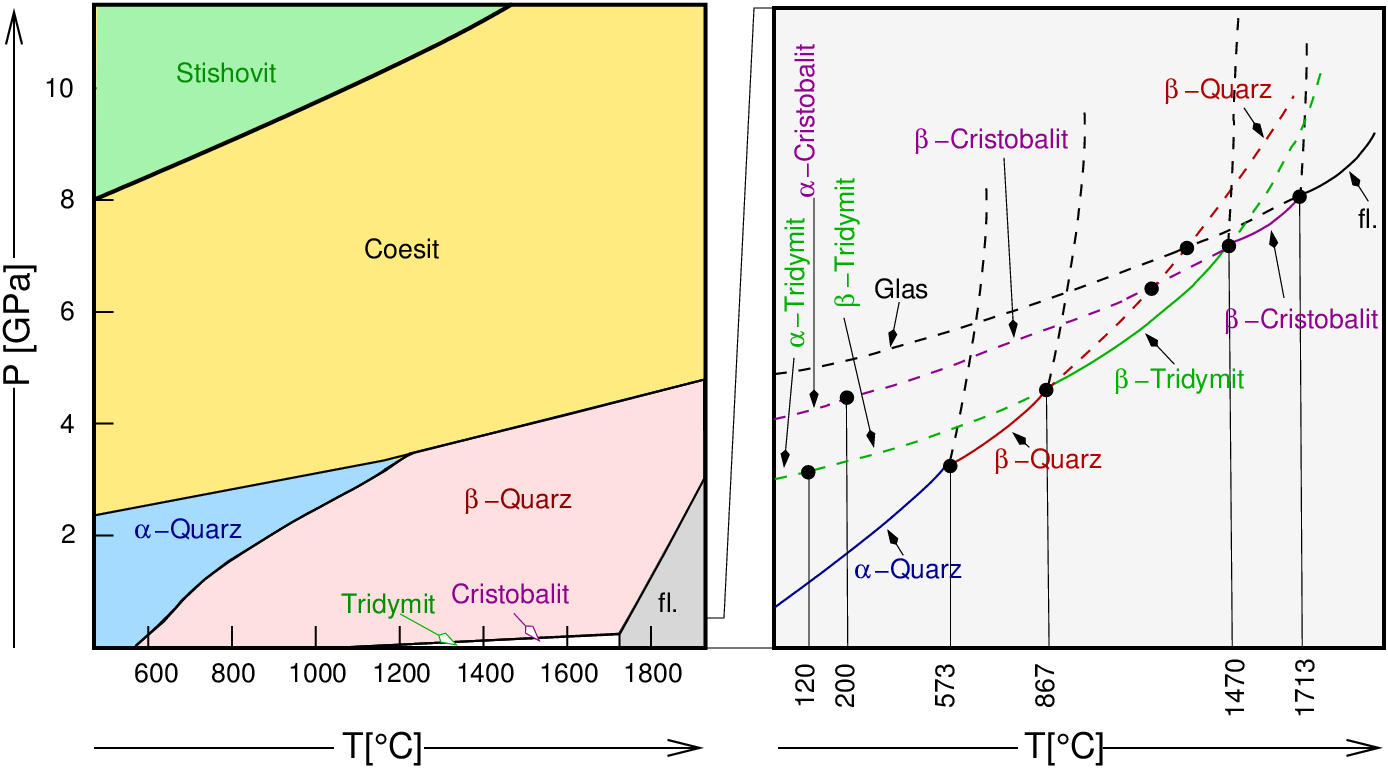 |
2.5.4. p-T-Phasendiagramm von SiO2 |
Die gestrichelt eingezeichneten Phasengrenzen bezeichnen metastabil
erhältliche Phasen.
Die Strukturen der kristallinen Modifikationen sind in der folgenden Übersicht
zusammengestellt. α- und ß-Form unterscheiden sich jeweils nur wenig
voneinander (s.u.).
| Name+VRML | GIF | Si-O [pm] | Winkel Si-O-Si | Dichte [g/cm3] | gestopfte Varianten |
| α-Quarz | 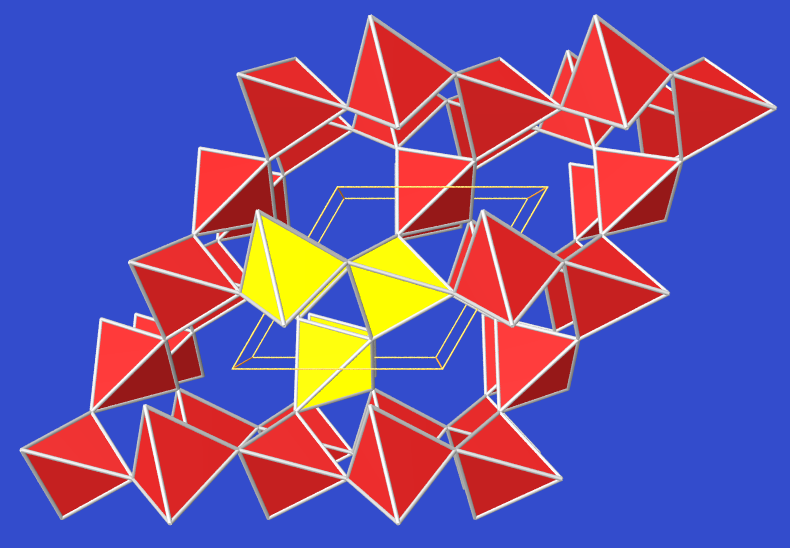 |
161 | 144 | 2.65 | LiAlSiO4 (ß-Eucryptit) |
| ß-Tridymit |  |
156 | (180) | 2.26 | KNa3(AlSiO4)4 (Nephelin) |
| ß-Cristobalit |  |
161 | (180),147 | 2.33 | KAlO2 |
| Coesit |  |
. | . | 2.91 | Sr3Al2N4 |
| Keatit |  |
. | . | 3.01 | . |
| Stishovit |  |
176-181 | . | 4.39 | . |
Die wichtigsten Modifikationen im Einzelnen
Quarz
ist die bei Normaldruck und Normaltemperatur stabile
Modifikation von SiO2. Seine Dichte beträgt 2.65
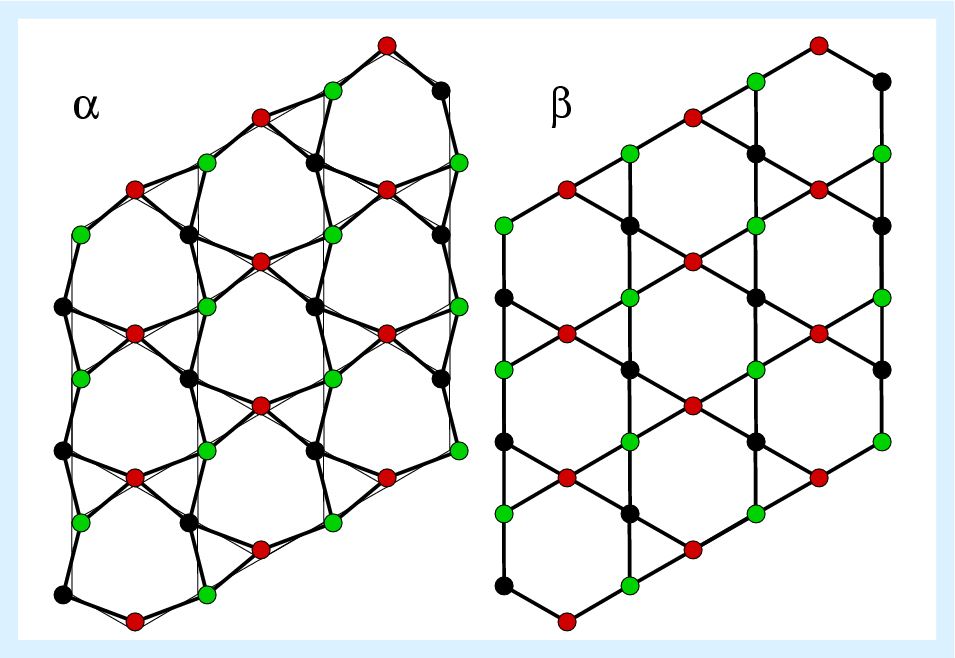
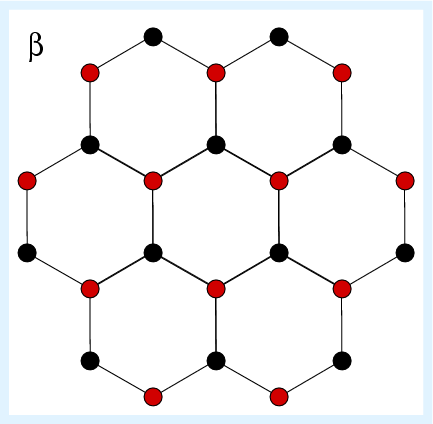
g/cm3. Die Struktur der α- und der ß-Phase unterscheiden sich nur
wenig voneinander (s. Abb. 2.5.5. links, wo nur die Positionen der Si-Atome dargestellt sind).
 |
 |
2.5.5. Struktur von α- und ß-Quarz |
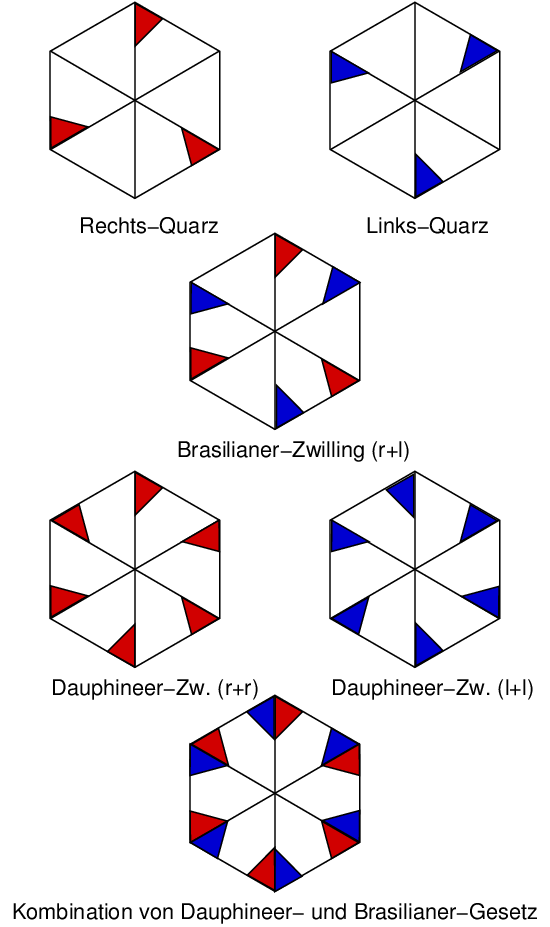
Eckverknüpfte SiO4-Tetraeder bilden 31-Schraubenachsen um die trigonale c-Achse. Jedes dieser Tetraeder weist zusätzlich eine Verknüpfung zu zwei benachbarten Schrauben auf. Wegen der Abwesenheit von Symmetrieelementen 2. Art bildet Quarz enantiomorphe Einkristalle (rechts- und links-Quarz). Die Händigkeit bleibt beim Übergang zwischen α- und ß-Form erhalten (displazive Phasenumwandlung!). Quarz neigt zu unterschiedlichen Arten der Zwillingsbildung (s. Abb. 2.5.6.).
 |
 |
2.5.6. Zwillingsbildung bei Quarzen | 2.5.7. Kristalltracht bei Quarzen |
 |
 |
 |
 |
| 2.5.8. Quarz | 2.5.9. Amethyste | 2.5.10. Achat | |
 d.h. Ausüben eines Drucks auf den Kristall führt zu Dipolbildung
und zur Aufladung entgegengesetzter Flächen des Kristalls.
Oder in Umkehrung erfolgt bei Anlegen eines elektrischen Feldes
eine mechanische Deformation des Kristalls.
Verwendung finden Quarze daher an der Stelle, wo mechanische Signale in
elektrische Signale umgesetzt werden sollen
(elektrische Uhren, Rechner, Mikrophone, Erzeugung von Ultraschall).
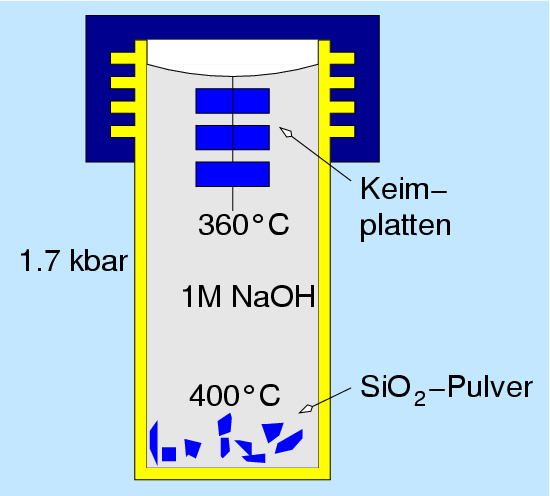
Die Herstellung von Quarz erfolgt durch Hydrothermalsynthese bei einem
Gradienten von 400o aber 360o bei einem Druck von ca.
1.7 kbar. Die Lücken in der Quarzstruktur sind relativ klein,
gestopfte Varianten sind daher nur mit dem kleinen Lithium bekannt.
Im ß-Eucryptit LiAlSiO4, der wegen seines kleinen und
negativen Ausdehnungskoeffizient z.B. für Herdplatten verwendet wird,
ersetzt Al3+ einen Teil des Si4+ und die dabei
auftretende Ladungsdifferenz wird durch Li-Kationen ausgeglichen.
d.h. Ausüben eines Drucks auf den Kristall führt zu Dipolbildung
und zur Aufladung entgegengesetzter Flächen des Kristalls.
Oder in Umkehrung erfolgt bei Anlegen eines elektrischen Feldes
eine mechanische Deformation des Kristalls.
Verwendung finden Quarze daher an der Stelle, wo mechanische Signale in
elektrische Signale umgesetzt werden sollen
(elektrische Uhren, Rechner, Mikrophone, Erzeugung von Ultraschall).
Die Herstellung von Quarz erfolgt durch Hydrothermalsynthese bei einem
Gradienten von 400o aber 360o bei einem Druck von ca.
1.7 kbar. Die Lücken in der Quarzstruktur sind relativ klein,
gestopfte Varianten sind daher nur mit dem kleinen Lithium bekannt.
Im ß-Eucryptit LiAlSiO4, der wegen seines kleinen und
negativen Ausdehnungskoeffizient z.B. für Herdplatten verwendet wird,
ersetzt Al3+ einen Teil des Si4+ und die dabei
auftretende Ladungsdifferenz wird durch Li-Kationen ausgeglichen.
 |
 |
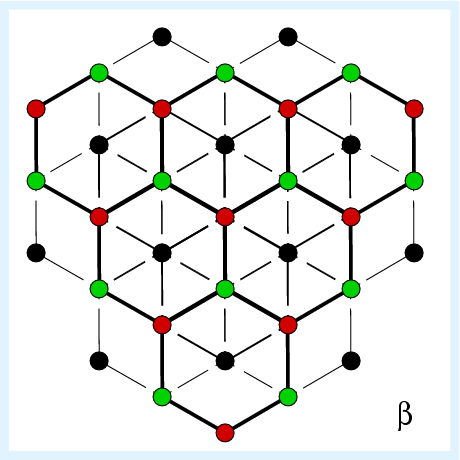
| 2.5.11. Struktur von Tridymit | |
Tridymit
ist oberhalb von ca. 870 oC stabil. Seine
Dichte beträgt 2.36 g/cm3.
Die Bezeichnung kommt aus dem griechischen (Tridymos)
und weist auf die bevorzugte Bildung von Drillingen hin.
In der Natur ist Tridymit nicht sehr häufig und nur mit Verunreinigungen
durch Alkali- bzw. Erdalkalimetallkationen stabil.
Die Si-Teilstruktur (s. Abb. 2.5.11.) entspricht der von Tridymit-Eis, d.h.
es liegt die hexagonale Wurtzitstruktur vor;
die 6-Ringe aus Tetraedern zeigen Wannen- und Sesselkonformation.
Wie beim Quarz unterscheiden sich α- und ß-Form nur
durch leichte Atomverschiebungen.
Die Lücken im Tridymit (1 Lücke/2 Si-Atome; vgl. CaGa2)
sind relativ große 3-fach überkappte hexagonale Prismen.
Eine gestopfte Variante ist z.B. der Nephelin
KNa3(AlSiO4)4.
 |
 |
| 2.5.12. Struktur von Cristobalit | |
Cristobalit ist die oberhalb von ca. 1470oC stabile Form
von SiO2 mit einer Dichte von 2.27 g/cm3.
Wie Tridymit kommt auch Cristobalit natürlich nur mit Verunreinigungen
vor. Die Si-Teilstruktur entspricht der des Diamanten;
die Sechsringe liegen alle in Sesselkonformation vor.
Die Lücken sind gekappte Tetraeder (Frank-Kasper-Polyeder CN 16,
1 Lücke/Si-Atom, vgl. NaTl).
Besetzung dieser Lücken führt z.B. zu KAlO2 oder - bei
Halbbesetzung der Lücken -
zu Opal (H2O _ Si2O4).
Neben diesen bei Normaldruck stabilen Formen von SiO2
sind auch kristalline metastabile Formen
bekannt:
Im faserförmigen SiO2 (auch W-SiO2)
liegen Ketten aus über Kanten verknüpften
SiO4-Tetraedern vor.
Eine gestopfte Variante hierzu ist z.B. Sr3Al2N4.
Die Darstellung dieser Form soll bei Temperaturen von 1300oC und
Drücken von 10-4 bar gelingen.
Weitere metastabile SiO2-Formen sind eine Reihe von Al-freien
Zeolithen (z.B. Al-freier ZSM-5 = Silicalite).
Man kennt insgesamt 3 Hochdruckmodifikationen von SiO2.
 |
 |
 |
| 2.5.13. Struktur von Coesit | 2.5.14. Struktur von Keatit | 2.5.15. Struktur von Stishovit |
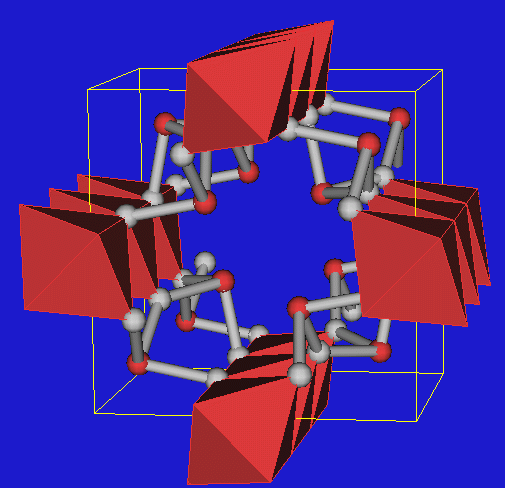
Coesit
(Abb. 2.5.13.)
kommt in Meteorkratern vor und hat eine Dichte von 2.91
g/cm3.
Er ist chemisch inerter als Quarz und z.B. gegen konzentrierte
Flußsäure beständig.
Die künstliche Darstellung dieser Modifikation von SiO2 gelang Coes
1953, indem er das Na-Metasilicat Na2SiO3 mit
(NH4)2HPO4 bei 700 oC
und 40 kbar umgesetzt hat.
Die monokline Struktur besteht aus Vierringen von
SiO4-Tetraedern, die zu Ketten verknüpft sind.
Diese Ketten (unterschiedliche farbig dargestellt!) sind weiter zu Schichten verknüpft, so daß weitere
4-Ringe entstehen. Insgesamt treten 4- und 6-Ringe auf, was dem beim Eis
beobachteten Trend entspricht, daß bei Druckerhöhung kleinere Ringe
entstehen.
Bei noch höheren Drücken ist
Keatit (Dichte: 3.01 g/cm3)
(Abb. 2.5.14.)
stabil. Diese Modifikation
kann hydrothermal bei 100 kbar und 500 oC hergestellt werden. Sie wurde
erst 2015 in der Natur erstmals gefunden.
Die Si-Teilstruktur entspricht der von Keatit-Eis.
41 Schraubenachsen (die in den Abbildungen unterschiedlich farbig dargestellt sind)
verlaufen bei 1/2,0,z in der tetragonalen
Elementarzelle. Die Tetraeder einer weiteren kristallographischen Lage
verknüpfen diese Ketten untereinander, so daß insgesamt 5- ,6- ,7- und 8-Ringe
in der Struktur zu finden sind.
Die SiO2-Modifikation mit der größten Dichte (4.39
g/cm3) ist der Stishovit (Abb. 2.5.15.),
der in Meteorkratern gefunden wurde. Die Herstellung ist künstlich bei 180 kbar möglich.
Die Struktur entspricht dem Rutil-Typ, d.h Si befindet sich in
oktaedrischer Umgebung von O (CNSi=6, CNO=3)
Die SiO6-Oktaeder sind über gemeinsame Kanten zu Strängen
verknüpft, die entlang der c-Achse in der tetragonalen Struktur verlaufen.
Diese Ketten sind über gemeinsame Sauerstoff-Ecken mit benachbarten Ketten
verknüpft, so daß jedes Sauerstoffatom von insgesamt
drei Siliciumatomen koordiniert ist. Es liegt damit kein offener
SiO4-Tetraederverband vor, sondern die Struktur läßt sich
als eine hexagonal dichte Packung von O2- beschreiben, in der die
Hälfte der Oktaederlücken gefüllt sind.
Das Vorliegen der Stishovit-Modifikation wird für den Dichtesprung zwischen
dem inneren und äußeren Erdmantel verantwortlich gemacht.
Beim Abschrecken von gasförmigem SiO entsteht ein schwarzbraunes Polymer
der Zusammensetzung SiO, das entweder als pyrophore Fasern
oder glasig (durch SiO2-Schutzschicht vor weiterer Oxidation geschützt)
anfällt.
GeO ist im Vergleich zu SiO recht beständig (Ge2+ - Si2+).
Die Darstellung erfolgt durch Oxidation von Ge z.B. mit
CO2 oder durch Symproportionierung von Ge und GeO2.
Die Struktur ist bisher nicht bekannt.
 |
| 2.5.16. Struktur von Pb3O4 (Mennige) |
Die Oxide von Zinn und Blei werden bei den Metalloxiden (Kap. 3.3.) behandelt, obwohl wegen des Lone-Pair bei den Oxiden mit 2-wertigem Metall stets Besonderheiten in der Struktur auftreten. Siehe z.B. für Pb3O4 (Abb. 2.5.16.).
| << SEITE ZURÜCK | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | SEITE WEITER >> |