Vorlesung Intermetallische Phasen
2. Elementare Metalle, metallischer Zustand
2.6 Strukturchemie IV: Elemente mit kovalenten Bindungsanteilen
Die B2-Elemente lassen sich strukturell mit Hilfe der 8-N-Regel
erklären: Elemente der 4. Hauptgruppe sind vierbindig (C, Si, Ge und
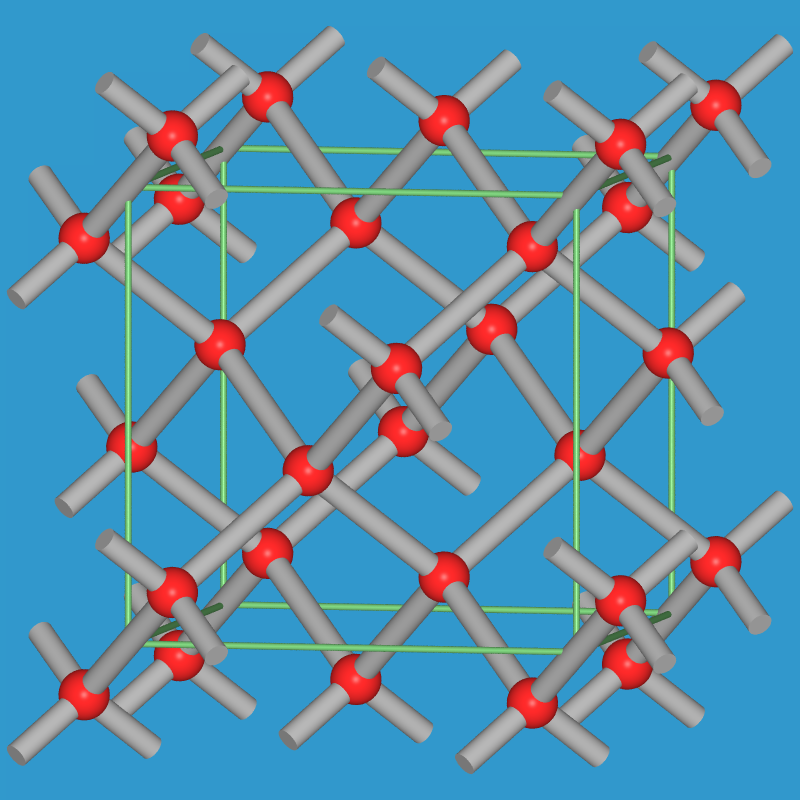
graues Sn: Diamantstruktur),
Elemente der 5. Hauptgruppe sind dreibindig (P,
As, Sb, Bi)
und die Elemente der 6. Hauptgruppe sind zweibindig (Se, Te).
Dabei ist interessant, dass sich die Strukturtypen der schweren Elemente der 5.
(CN 3+3) und 6. (CN 2+4) Hauptgruppe aus der
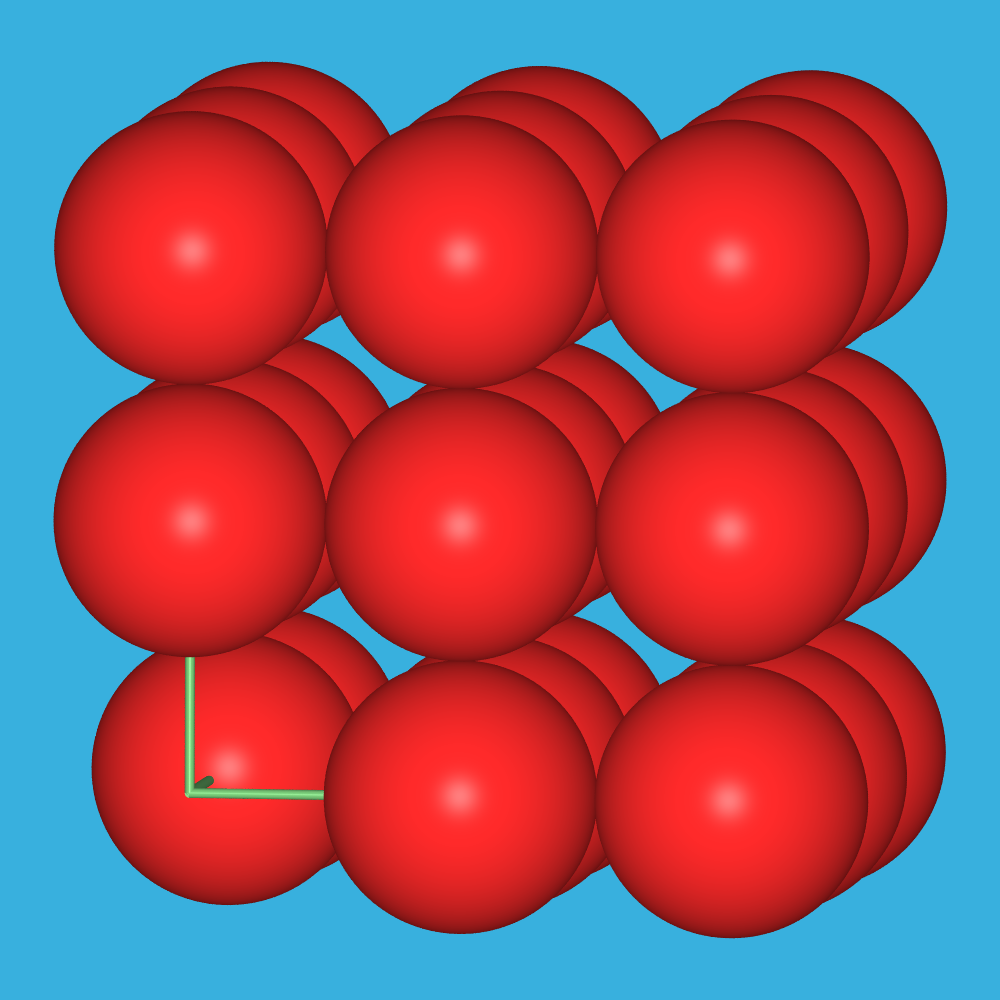
α-Po-Struktur
(einfach kubisch, CN 6) ableiten lassen (Übergang kovalente -> metallische Elemente).
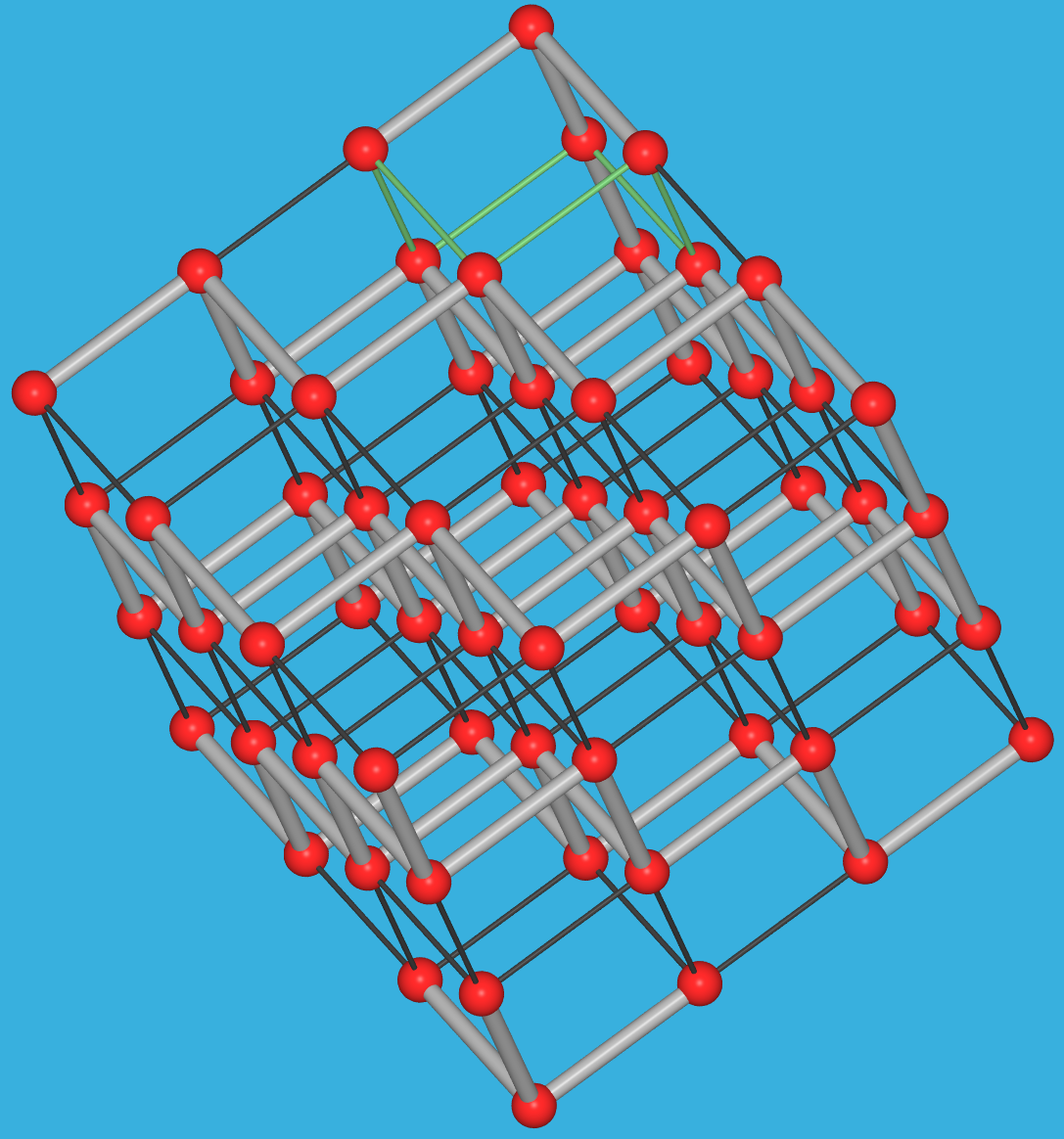
- As, Sb, Bi: Gewellte Sechsecknetze, aus Po durch 3+3 Koordination
ableitbar.
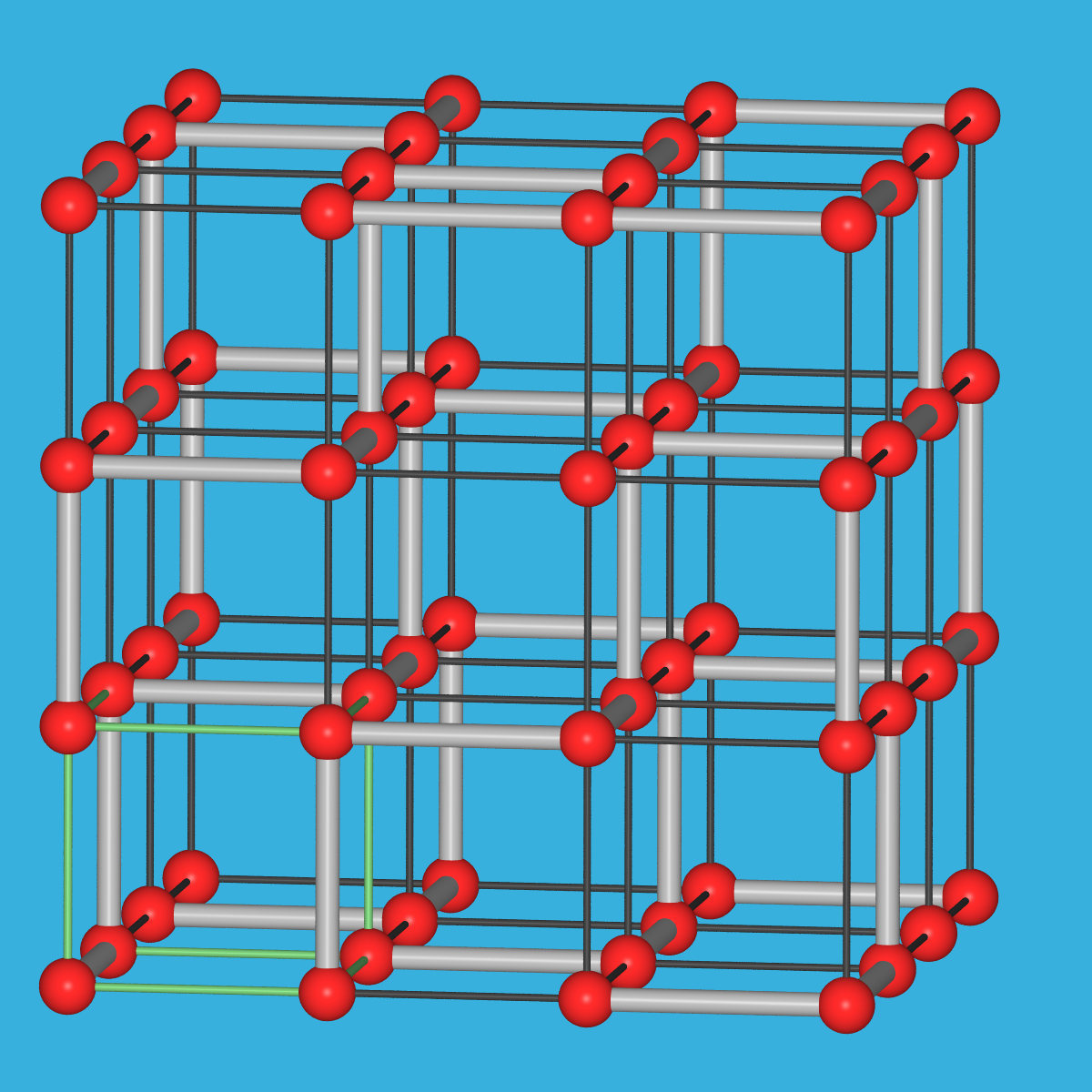
- Se, Te : 31-Schraubenachsen, aus Po durch 2+4 Koordination ableitbar.
| - |
Si, Ge, Sn (grau) |
Po |
As, Sb, Bi |
Se, Te |
| VRMLs |
VRML |
VRML |
VRML |
VRML |
| statische Bilder |
|
|
 |
 |
Die elektronischen Strukturen dieser Elemente
zeigen kleine Bandlücken, s. z.B. die Zustandsdichte und die Bandstruktur der Diamant-Struktur
von Silicium in den Abbildungen 2.5.1. und 2.5.2.

| Abb. 2.6.1. Zustandsdichte von Silicium (GGA-DFT-Rechnung, die
Bandlücke ist unterschätzt). |
Die folgende Tabelle gibt einen Überblick über die Größe und Art
(d: direkte Bandlücke, i: indireke Bandlücke)
der Bandlücken bei B2-Elementen:
| Substanz |
Bandlücke |
Eg [eV] bei 0 K |
| C (Diamant) |
indirekt |
5.4 |
| Si |
indirekt |
1.17 |
|
| Ge |
indirekt |
0.744 |
| Sn (alpha) |
direkt |
0 |
| As |
|
klein |
| Sb |
direkt |
0 |
| Bi |
direkt |
0 |
| Se |
|
2.2 |
| Te |
direkt |
0.33 |
Tab. 2.6.1. Bandlücken einiger Elemente.
Die untenstehende Abbildung 2.6.2. zeigt den typischen Verlauf der Bandstrukturen
der Elementhalbleiter mit Diamantstruktur.
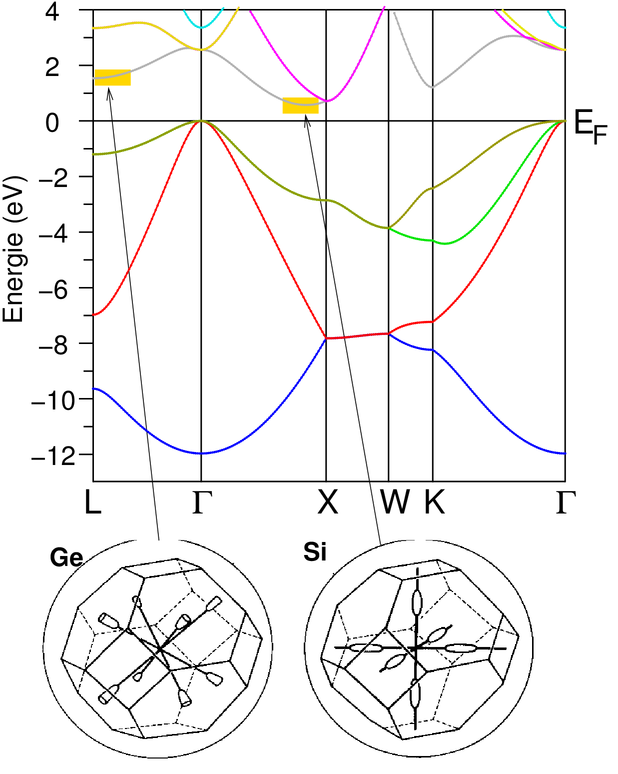
| Abb. 2.6.2. Bandstruktur von Silicium (inkl.
Fermiflächen der Leitungsbänder von Ge und Si). |
Die Unterschiede liegen für die jeweiligen Elemente in Details:
Si hat eine indirekte Bandlücke von 1.17 eV, bei Ge beträgt die
Bandlücke 0.744 eV.









