Vorlesung Intermetallische Phasen
4. Hume-Rothery-Phasen (A2-B1)
4.1 Vorkommen, Phasenbeziehungen
William Hume-Rothery (1899-1968, Oxford) beobachtete bereits 1929, dass in den Phasendiagrammen
bestimmter binärer chemischer Systeme
eine immer gleiche Phasenfolge vorliegt und zwar (nach steigender Elektronenzahl, von links
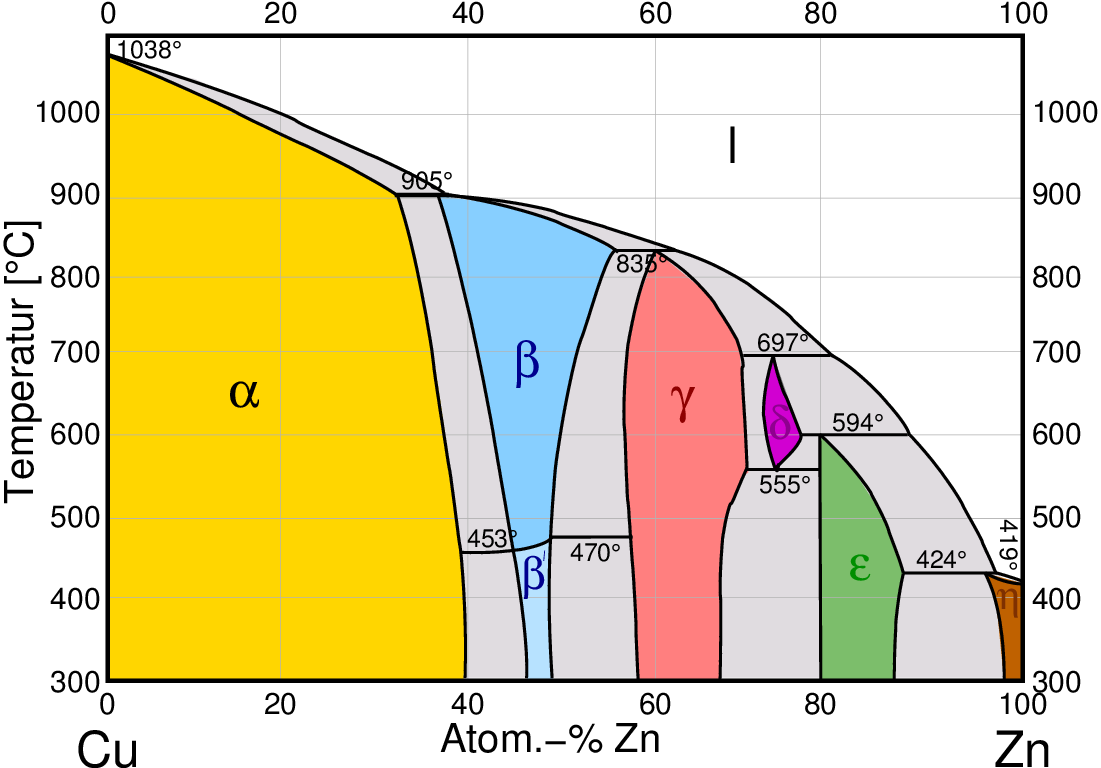
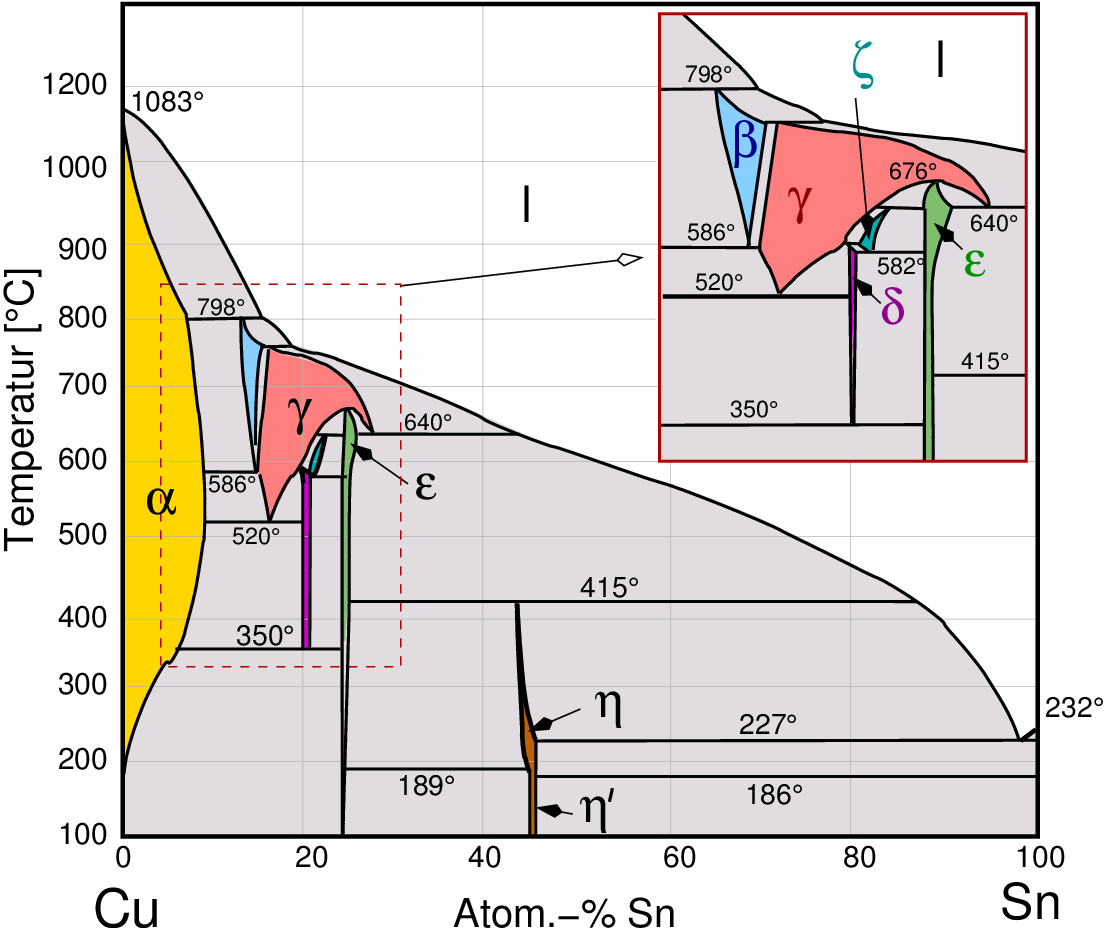
nach rechts in den Phasendiagrammen z.B. von Messing (Abb. 4.1.1 links) und Bronze (Abb. 4.1.1. rechts)):
|
|
| Cu - Zn
‣SVG |
Cu - Sn
‣SVG |
|
Abb. 4.1.1. Phasendiagramme von Hume-Rothery-Phasen
|
- Die sog. α-Phase kristallisiert in einer kubisch dichtesten
Kugelpackung, dem Cu-Typ.
Den A2-Randelementen (z.B. Cu, Ag, Au) lassen sich - mit unterschiedlicher Phasenbreite - die Elemente
B1 (z.B. Zn) zulegieren, wobei immer rein statistische Elementverteilung
erhalten bleibt und keine Überstrukturen ausgebildet werden.
- ---> nach einem 2-Phasenbereich --->
- Die folgende β-Phase, die im b.c.c.-Gitter
(W-Typ)
kristallisiert,
weist zwar unterschiedliche Phasenbreiten auf, liegt aber immer im Bereich
von 3/2 = 1.5 Elektronen/Atom.
Beispiele für angenäherte Zusammensetzungen in den verschiedenen Systemen sind:
- CuZn: VEC = (1*1 + 1*2)/2 = 1.5
- Cu5Sn: (5*1 + 1*4)/6 = 9/6 = 1.5
- Cu3In: (3*1 + 1*3)/4 = 6/4 = 1.5
Beim Abkühlen gehen die β-Phasen meist in eine geordnete sog. β'-Phase mit
CsCl-Struktur über.
- ---> nach einem 2-Phasenbereich --->
- Die γ-Phasen kristallisieren in einer großen kubischen Zelle mit 52 Atomen,
die im Kap. 4.2. näher diskutiert wird.
Auch hier kommen z.T. erhebliche Phasenbreiten vor, die Zusammensetzung liegen aber
in den verschiedenen chemischen Systemen wieder in einem vergleichbaren
Bereich der Valenzelektronenkonzentration:
- Cu5Zn8: (5*1 + 8*2)/13 = 21/13 = 1.615
- Cu31Sn8: (31*1 + 4*8)/39 = 63/39 = 21/13
- Cu9Al4: (9*1 + 4*3)/13 = 21/13
- ---> nach einem 2-Phasenbereich --->
- Die δ-Phase bildet ebenfalls eine große kubische Struktur. Sie tritt
meist nur bei hohen Temperaturen auf.
- ---> nach einem 2-Phasenbereich --->
- Die ζ-Phase kristallisiert in einer hexagonal-dichtesten Kugelpackung
(Mg-Typ)
und kommt nur in wenigen Systemen und bei hoher Temperatur vor.
- ---> nach einem 2-Phasenbereich --->
- Die ε-Phase bildet ebenfalls eine h.c.p.-Packung, die
beiden Elemente sind statistisch auf die Mg-Positionen des Muttertyps
verteilt. Sie tritt z.B. auf bei den folgenden chemischen Zusammensetzungen:
- CuZn3: (1*1 + 3*2)/4 = 7/4 = 21/12 = 1.75
- Cu3Sn: (3*1 + 1*4)/4 = 7/4 = 21/12 = 1.75
- ---> nach einem 2-Phasenbereich --->
- Die η-Phasen sind statistische Varianten des β-Mn-Typs.
- ---> nach einem 2-Phasenbereich --->
- Bei einer VEC von 2 (z.B. Zn) tritt z.T. Randlöslichkeit (hier von Cu in Zn) auf.
Einige weitere Beispiele für die drei wichtigsten Phasen in unterscheidlichen
Legierungssystemen:
| VEC=3:2 |
VEC=3:2 |
VEC=21:13 |
VEC=21:14 |
| β-bcc-Struktur |
β-Mn-Struktur |
γ-Messing |
ε-hcp-Struktur |
| CuBe |
Ag3Al |
Cu5Zn8 |
CuZn3 |
| CuZn |
Au3Al |
Cu9Al4 |
Cu3Sn |
| Cu3Al |
Cu5Si |
Fe5Zn21 |
AgZn3 |
| Cu5Sn |
|
|
|
Tab. 4.1.1. Chemische Systeme mit Hume-Rothery-Phasen
Im folgenden Kapitel 4.2.
werden zunächst noch einige strukturelle Aspekte,
hier besonders der γ-Messing Typ, behandelt. Im Abschnitt
4.3 sind
die elektronischen Gründe für diese Phasenfolge kurz erläutert.



