Vorlesung Chemie der Nichtmetalle
2. Wasserstoff
2.1. Element
|
Allgemeines
Der Wasserstoff ist das erste und einfachste Element des Periodensystems. Seine
Elektronenkonfiguration zeichnet sich damit durch nur ein Elektron aus,
das sich im energetisch niedrigsten Zustand, im 1s Orbital, befindet. Die
Elektronenkonfiguartion ist also 1s1.
Über die Frage, an welcher Position im Periodensystem
der Wasserstoff eingeordnet werden sollte, wurde und kann diskutiert werden. Aufgrund der
auftretenden Oxidationsstufen sind nämlich zwei Positionen denkbar:
- 1. HG, da Wasserstoff ein Kation, H+ (Proton) bildet. Es
ist aber kein Metall, seine Ionisierungsenergie ist mit IE = 13.5 eV
deutlich gröszlig;er als z.B. die von Natrium (5.4 eV).
- 7. HG, da Wasserstoff ein Anion, H- (Hydrid) bildet. aber kein Halogenid
(EN: H: 2.2, F: 4.1, ... I: 2.2 vergleichbar)
(Nichtmetall-Charakter weniger ausgeprägt)
Die chemische Bindung von Wasserstoff mit anderen Nichtmetallen
ist stets kovalent
und kann aber mehr oder weniger polar sein.
Wasserstoff ist in kovalenten Verbindungen fast ausschließlich 1-bindig
(d.h. die 8-N-Regel gilt nur für die langen Perioden).
In der organischen Chemie werden die H-Atome sogar meist weggelassen, da sie immer
eine einfache Absättigung durch terminale Bindungen C-H bewirken.
Neben den kovalenten Verbindungen des Wasserstoffs gibt es jedoch auch Verbindungen mit
Wasserstoff-Ionen (H+, H-) und metallische 'Hydride' (s. Kap. 2.2.).
Vorkommen, Isotope
Obwohl in der Erdrinde jedes 6. Atom ein Wasserstoffatom ist, macht er nur 1.02 Gewichtsprozent
der Erdrinde aus. Fast ausschließlich kommt Wasserstoff gebunden (meist als Dihydrogenoxid H2O,
auch bekannt als Wasser) vor. Im Weltall ist Wasserstoff das häufigstes Element.
Unsere Sonne besteht zu 80 Atom-Prozent aus Wasserstoff.
Vom Wasserstoff gibt es drei verschiedene Isotope:
- 11H (Protium) ist mit einem prozentualen
Anteil von 99.9855 das häufigstes Isotop.
- 21H (Deuterium) hat eine relative Häufigkeit von 0.0145 %.
- Das Tritium 31H hat nur eine Häufigkeit
von 10-15%. Tritium ist ein ß--Strahler mit einer
Halbwertszeit t1/2 von 12.4 Jahren und zerfällt dabei zu 32He.
Bedingt durch die großen Massenunterschiede zwischen H und D unterscheiden sich sowohl die
Elemente selber als auch deren Verbindungen in ihren chemischen und physikalischen Eigenschaften
sehr deutlich. Durch Substitution von H durch D können Reaktionsmechanismen mit Protonen/Hydrid-Verschiebungen
untersucht werden, da dann ein sehr großer Isotopeneffekt auftritt.
Das Molekül H2
Das Element Wasserstoff besteht aus Molekülen H2 und enthält damit
die einfachste denkbare kovalente Bindung. Der Gleichgewichtabstand beträgt 74 pm, die
Dissoziationsenergie liegt bei 436.2 kJ/mol.
Anhand dieses einfachen Moleküls sollen kurz die verschiedenen Modelle für die
Beschreibung kovalenter Bindungen wiederholt/eingeführt werden:
- In der Lewis- Strichformel ist das Molekül als H-H zu formulieren, d.h.
beide H-Atome erreichen die Edelgasschale von He (1s2).
Anschaulich sind zwei Elektronen über zwei Kerne verteilt.
- Bei der VB (Valence Bond)-Beschreibung (Lewis und Pauling, ca. 1930)
werden bei der Annäherung zweier H-Atome
aneinander die auftretenden Kräfte zwischen beiden Bindungspartner
betrachtet. Dies sind:
- Die Coulomb-Wechselwirkungen zwischen den Elektronen und Kernen sowie
zwischen den beiden Kernen und den beiden Elektronen.
- Die kinetische Energie (der Elektronen).
- Die Spinpaarungsenergie.
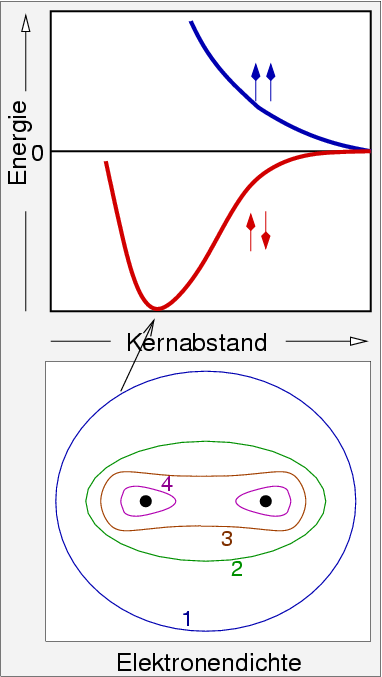
Als Ergebnis dieser Betrachtungen erhält man, wenn beide Elektronen den
gleichen Spin haben bei der Annäherung eine etwas höhere Energie, bei
antiparallelem Spin eine etwas niedrigere Energie (s. Abb. 2.1.1.). Das Minimum dieser
Energiebetrachtungen führt auf den korrekten Kernabstand von 74 pm.
Generell sind die beiden Elektronen ununterscheidbar und sie
halten sich im gesamten Überlappungsraum der Atomorbitale auf, d.h. es kommt
zur Überlappung der beiden 1s-Atomorbitale. Der Überlappungsbereich
(das Molekül-Orbital) ist der Bereich, in dem die beiden Elektronen
antiparallele Spins haben. Entscheidend ist in der VB-Beschreibung,
daß die Elektronendichte auf der Kernverbindungsachse erhöht ist.
Es liegt ein Sattelpunkt in der Elektronendichte vor, ein sogenannte bindungskritischer Punkt
(BCP = Bond Critical Point). Kompliziertere Moleküle lassen sich mit
der VB-Theorie nur beschreiben, wenn zusätzlich das Konzept der Hybridisierung eingeführt
wird (z.B. bereits beim H2O-Molekül).
 |
 |
| Abb. 2.1.1. VB-Beschreibung der
chemischen Bindung in H2
‣SVG |
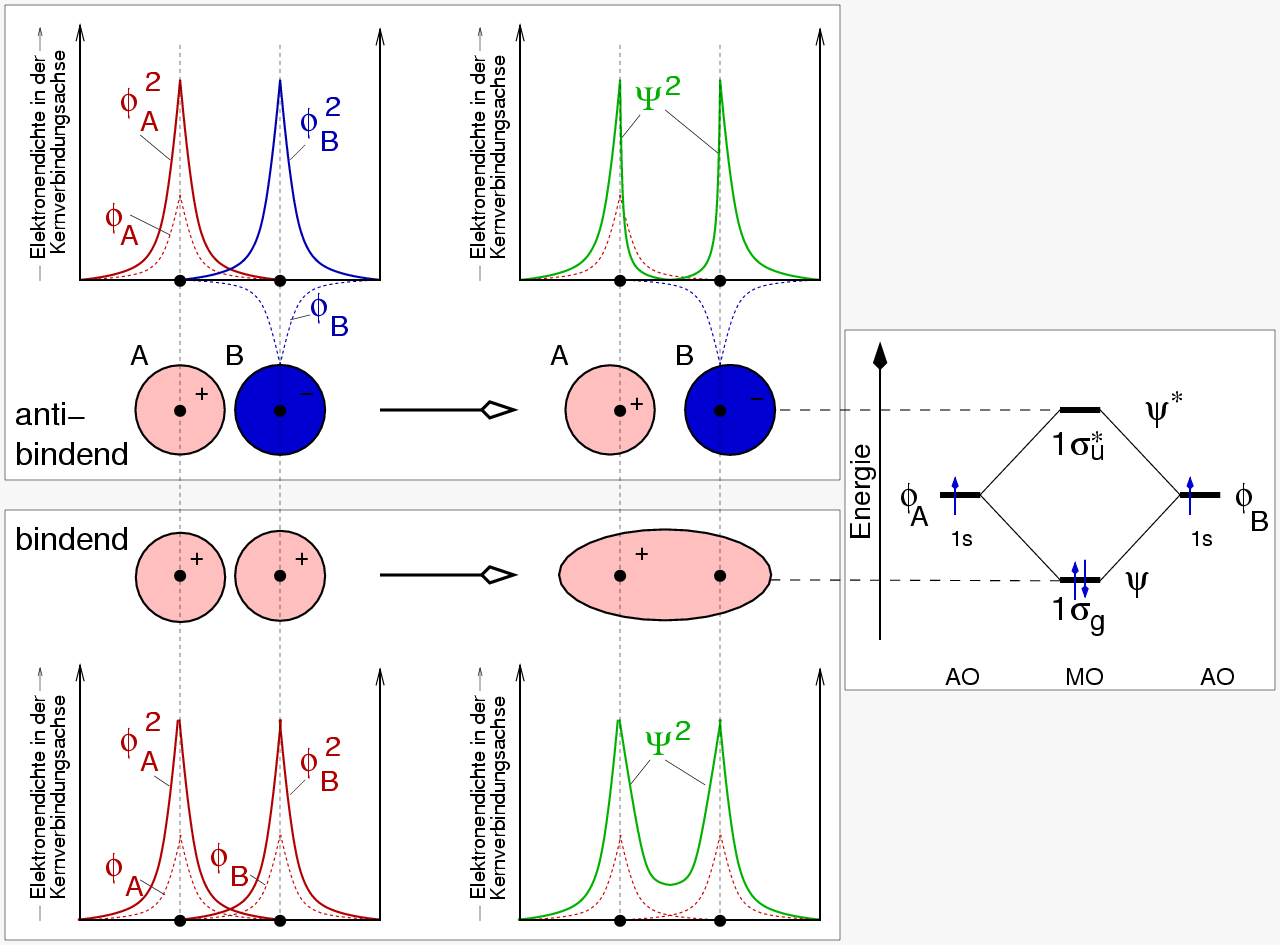
Abb. 2.1.2. MO-Beschreibung
der chemischen Bindung in H2
‣SVG
|
- Im MO (Molekül-Orbital) Modell
werden (meist durch Linearkombination von Atomorbitalen (AO), sogenannte LCAO-Näherung)
Molekülorbitale konstruiert, die wie die Atomorbitale eine bestimmte
energetische Abfolge aufweisen. In diese Zustände (MOs) werden dann die Elektronen
nach dem Pauli-Prinzip eingefüllt (s. Abb. 2.1.2.).
Das MO-Modell ist für H2 sehr einfach:
Die beiden Atomorbitale (d.h. die atomaren Wellenfunktion Φ der 1s Atomorbitale)
kombinieren zu zwei Molekülorbitalen ψ (σ und σ*).
Die Bezeichnungen s und σ kodieren für die Symmetrie, in diesem Fall die
Rotationssymmetrie mit der Drehachse als Kernverbindungsachse.
Die Symmetriebezeichnungen g und u stehen für gerade und ungerade MOs,
d.h. solche mit Inversions- und solche ohne Inversionssymmetrie (Punktspiegelung).
Hinweis: Bei komplizierteren Verbindungen (hier bei H ist das sowieso erfüllt)
werden nur die Valenzelektronen betrachtet.
n Atomorbitale ergeben stets auch n Molekülorbitale, die wiederum
die gleiche Symmetrie bzgl. der Kernverbindungsachse aufweisen.
Energetisch ergibt sich für jede Kombination ein gegenüber den Atomorbitalen
höher, und ein niedriger liegendes Molekülorbital.
In der LCAO-Näherung läßt sich aus der einfachen Symmetrierestriktion
ableiten, daß die Molekülorbitale beim Wasserstoff durch die einfachen Linearkombinationen:
ψbindend = ΦA + ΦB (bindend, AO mit gleichem Vorzeichen/Farbe)
ψantibindend = ΦA - ΦB (antibindend, AO mit verschiedenem Vorzeichen/Farbe)
gebildet werden.
Das Resultat ist letztliche identisch mit dem Ergebnis der VB-Näherung:
Bindende Zustände haben zwischen den Kernen erhöhte Elektronendichten,
antibindende weisen keine Elektronendichten zwischen den Kernen auf,
ψ hat dort einen Knoten (Vorzeichenwechsel).
Die MO-Beschreibung wird später auch auf kompliziertere Moleküle erweitert.
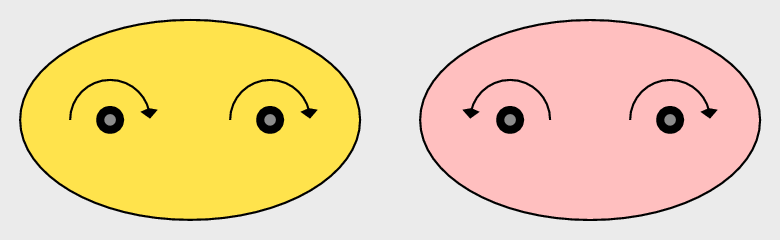
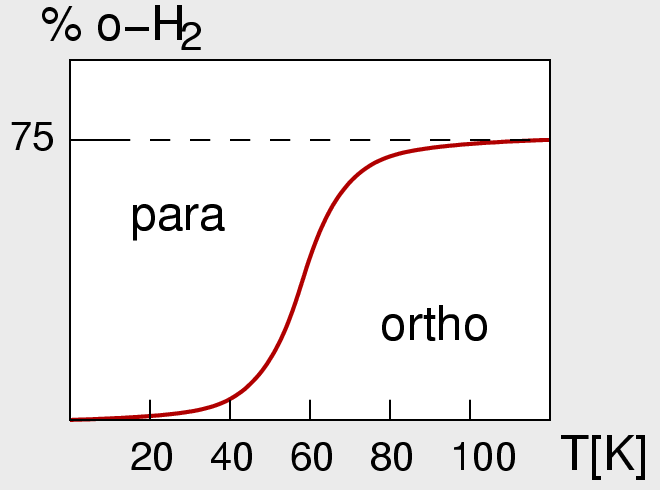
Einfluß der Kernspins: Ortho- und Para-H2
Das Proton, d.h. der Kern des Wasserstoffatoms hat einen Kernspin von 1/2. Dementsprechend
ergeben sich für das Molekül H2 zwei verschiedene Möglichkeiten für die Ausrichtung der
magnetischen Momente der beiden beteiligten Kerne, die allerdings nur zu sehr geringen Unterschieden
in den physikalischen Eigenschaften führen:
 |
 |
| Abb. 2.1.3. Ortho- und Para-Wasserstoff: Kernspins
‣SVG |
Abb. 2.1.4. Ortho- und Para-Wasserstoff: Gleichgewicht
‣SVG
|
| ortho-H2 |
para-H2 |
| gleichsinniger Kernspin |
gegenläufiger Kernspin |
| S = 1 |
S = 0 |
| energiereicher |
energieärmer |
| Tab. 2.1.1. Ortho- und Para-Wasserstoff
|
Es besteht ein Gleichgewicht zwischen beiden Formen:
ortho-H2 <---> para-H2; +0.08 kJ/mol
Bei tiefen Temperaturen und nur bei Anwesenheit einer paramagnetischen Substanz (Spin-verbotener
Übergang!) kann demnach der energiereichere und wegen der Entartung (2S+1) bei
höherer Temperatur drei-mal häufigere ortho-Wasserstoff in para-H2 umgesetzt werden.
Nachweis von H2
Zum Nachweis von elementarem Wasserstoff können dienen:
- das bläuliche Spektrum.
- die Knallgasprobe bzw. die Brennbarkeit.
- die Reduktion von PdCl2 zu Pd (bereits bei Raumtemperatur).
Darstellung
Die Darstellung von elementarem Wasserstoff im Labor kann nach den folgenden
Reaktionen erfolgen:
- H2 kommt in roten Flaschen mit Linksgewinde im Labor vor.
- Wasserstoff kann durch Elektrolyse von verdünnter H2SO4 erhalten werden.
Dabei laufen die folgenden Teilreaktionen ab:
- An der Kathode wird H+ reduziert:
2 H+ + 2 e- ---> H2
- An der Anode wird OH- oxidiert:
2 OH- ---> 2 e- + H2O + 1/2 O2
- Bei der Umsetzung von Metallen mit H2O wird abhängig vom Redoxpotential
Wasser reduziert, und das Metall oxidiert. Das erforderliche Normalpotential
des Metalles ist vom pH-Wert abhängig:
- < 0 V (bei pH 0, im Sauren)
- < -0.414 V (bei pH 7, im Neutralen) (Nernst: 0.059 log 10-7
- < -0.829 V (bei pH 14, im Alkalischen)
D.h. die Reaktion läuft mit vielen (unedlen) Metallen z.T. mit großer
Heftigkeit ab. Je nach Metall, d.h. der Frage, inwieweit eine Oxid/Hydroxid-Schicht
gebildet wird, muß die Reaktion bei unterschiedlichen Bedingungen
durchgeführt werden:
- Metall + Wasser
Na + H2O ---> NaOH + 1/2 H2
- Metall + Lauge (nur amphotere Metalle)
Al + OH- + 3 H2O ---> [Al(OH)4]- + 3/2 H2
- Metall + Säure (z.B. im Kipp'schen Apparat)
Zn + 2 H+ ---> Zn2+ + H2
- Hydrid + H2O (Komproportionierung) (vgl. die Verwendung von CaH2 als Trockenmittel)
CaH2 + 2 H2O ---> Ca(OH)2 + 2 H2
Technisch gibt es ebenfalls eine Reihe unterschiedlicher Möglichkeiten für die Darstellung
von elementarem Wasserstoff.
- Die elektrolytische Gewinnung. Bei vielen technischen Elektrolysen entsteht Wasserstoff
als Nebenprodukt, z.B. bei der Chloralkalielektrolyse
2 NaCl + 2 H2O ---> H2 + Cl2 + 2 NaOH
Die Elektrolyse von reinem Wasser wird für die Herstellung von
reinst-H2 z.B. für die Lebensmittelindustrie (Fetthärtung, Margarine-Herstellung)
durchgeführt.
Generell ist die elektrolytische Herstellung von Wasserstoff
nur dort rentabel, wo billiger elektrischer Strom verfügbar ist.
- Ein wichtiger Prozess ist die Herstellung von H2 aus Kohle (C) und Wasser, die sogenannte
Kohlevergasung, die in der Wirbelschicht oder in einem Winklergenerator durchgeführt wird.
C + H2O ---> (drucklos,1000oC) ---> H2 + CO; +131 kJ/mol
Die entstehende Mischung aus H2 und CO wird Wassergas genannt.
Das Verfahren ist zwar alt, je nach Verfügbarkeit von Erdöl aber durchaus immer
wieder interessant.
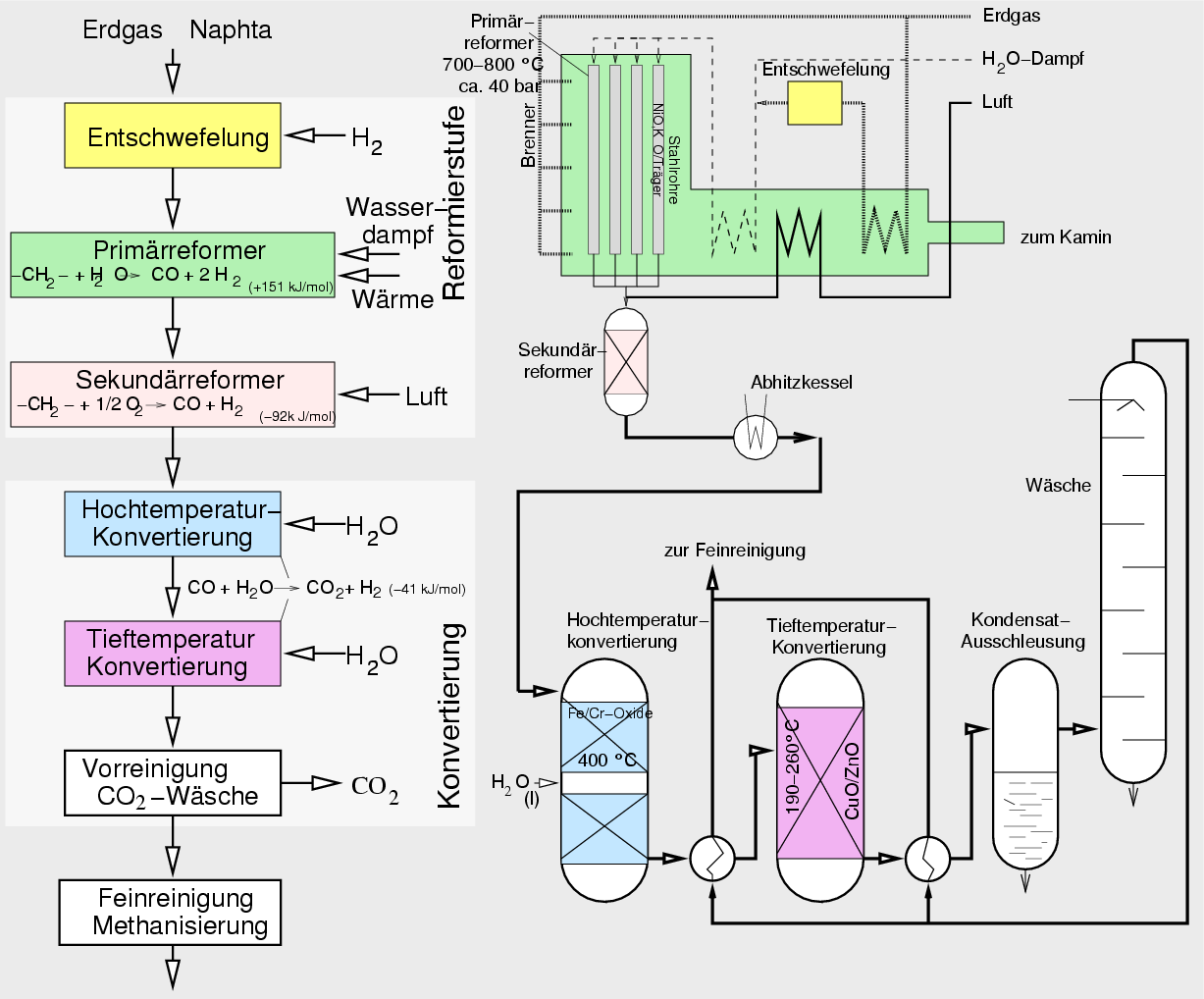
- Die Gewinnung von Wasserstoff aus Erdgas oder Erdöl kann nach verschiedenen Prozessen erfolgen:
- Zur technische Gewinnung von Deuterium 21H kann die
Elektrolyse genutzt werden, da Deuterium eine leicht andere Zersetzungsspannung als 11H hat.
Auch die fraktionierte Destillation von Wasserstoff kann genutzt werden.
Deuterium ist für höhere Lebewesen giftig.
Eigenschaften
Physikalische Eigenschaften:
Wasserstoff ist ein farbloses, geruchloses, brennbares (d.h. die Verbrennung unterhaltendes)
Gas. Seine besondere Eigenschaft ist die geringe Dichte: 1 l H2 wiegen
lediglich 0.09 g. Auf dieser geringen Dichte basierte die Verwendung als Füllgas für
Luftschiffe (Hindenburg). 1 l Luft wiegt dagegen 1.2928 g.
Elementarer Wasserstoff schmilzt schon bei 14 K (-260 oC) und siedet bei 20 K (-253 oC).
Die Gründe hierfür sind die geringe Molekülmasse und die wenigen, stark zwischen den Kernen lokalisierten Elektronen,
so daß nur schwache Dipol-Dipol-Wechselwirkungen auftreten.
Fester Wasserstoff ist polymorph: Unterhalb von 14 K liegt eine hexagonal dichteste Kugelpackung
vor. Bei Drücken oberhalb von 2.5 Mbar und Temperaturen von 3000 K wird
Wasserstoff metallisch (Science 273, 939-938 (1996)).
Wasserstoff hat die größte Wärmeleitfähigkeit aller Gase und das größte Diffusionsvermögen,
was zu einer Reihe von technischen Problemen beim Umgang mit H2 führt.
u1 : u2 = √M2 : √ M1
mit: u=Diffusionsgeschwindigkeit; M=Molekulargewicht
Chemische Eigenschaften
Die Löslichkeit von H2 in Wasser ist sehr gering.
In Fe/Ti-Legierungen ist Wasserstoff dagegen mit hohem Volumen speicherbar. Dieses
Speichervermögen kann z.B. beobachtet werden, wenn man bei Elektrolyse, bei denen
Wasserstoff an Metallelektroden entsteht, die verspätete Entwicklung verfolgt.
Wasserstoff kann bei sehr hohen Temperaturen homolytisch gespalten werden:
H2 ---> 2 H. ; +436 kJ/mol (endo)
Das Gleichgewicht liegt so, daß bei 3000 K ca. 8 % gespalten sind. Auf der
Sonnenoberfläche, wo eine Temperatur von ca. 6000 K herrscht, liegt daher ausschließlich
atomarer Wasserstoff vor. Im Sonnenmantel, d.h. bei Temperaturen von ca. 100 000 K kommt es schließlich
zur thermischen Ionisation:
H. ---> H+ + e-
Im Sonnenkern, wo die Temperatur bei ca. 10 Millionen K liegt, erfolgt schließlich zur Fusion der
Protonen zu He-Kernen.
Die Spaltung von Wasserstoff kann alternativ aber auch durch Mikrowellen oder im Lichtbogen (s.u., Arcaton-Verfahren)
erreicht werden.
Energetisch noch aufwendiger als die homolytische ist die heterolytische Spaltung von Wasserstoff:
H2 ---> H+ + H-
Mit einer Enthalpie von +1675 kJ/mol liegt die Gleichgewichtskonstante bei KS
bei 10-39, d.h. das Gleichgewicht liegt extrem weit auf der linken Seite.
Verwendung von Wasserstoff
- Die Hauptmenge von Wasserstoff (ca. 60 Prozent) wird mit Stickstoff weiter zu Ammoniak umgesetzt.
- Ein weiterer Anteil (ca. 25 %) wird für die Hydrierung von Erdöl oder Kohle verwendet um
insgesamt niedrigere C-Schnitte zu erhalten.
- Wasserstoff wird darüberhinaus zur Fetthärtung, zur Synthese von HCl
und als Raketentreibstoff eingesetzt.
- Auch die Verwendung für Verbrennungsmotoren
ist wegen des unkritischen Verbrennungsproduktes sehr attraktiv.
- Als Energiespeicher (Stichwort: Wasserstoffwirtschaft, Wasserstofftechnologie)
kann elementarer Wasserstoff zur Energiegewinnung über die Knallgas-Reaktion
(H2 + O2 ---> H2O), die kontrolliert in Brennstoffzellen abläuft,
genutzt werden.
- Wasserstoff dient darüberhinaus zur Gewinnung einiger Sondermetalle:
Durch Reduktion der Oxide mit H2 werden Molybdän, Wolfram, Cobalt und z.T. Germanium gewonnen.
- Wasserstoff wird zum Schweißen eingesetzt. Man unterscheidet:
- Der sogenannte Daniell'scher Hahn (auch Knallgasgebläse) dient allgemein zur
Erzeugung hoher Temperaturen und wird in verschiedenen Ausführungen
(Schweißbrenner oder -pistolen) zum
Schweissen und Schneiden verwendet:
- Beim autogenen Schweißen mit dem Knallgasgebläse
nutzt man einen H2-Überschuß (von ca. 4:1) um die Oxidation
der Werkstücke zu verhindern. Auf diese Weise sind Temperaturen bis ca. 2700 oC
möglich.
- Beim autogenen Schneiden wird das metallische Werkstück (z.B. Fe, Stahl)
zunächst geschmolzen. Anschliessend kann nur noch mit O2 weitergeschweißen werden.
Die exotherme Entstehung von Fe2O3 unterhält dann das Schmelzen.
Die Oxide werden weggeblasen und es entstehen sauber Löcher oder Schneidekanten.
- Schweißen bei relativ niedrigen Temperaturen ist mit Platin als Katalysator möglich:
H2 ---> 2 H
2 H + 1/2 O2 ---> H2O
- Beim Schweißen nach dem sogenannten Arcatom-Verfahren
nutzt man die Rekombination von H zu H2 aus.
Hiermit sind Temperaturen bis 4000oC möglich,
d.h. W oder Al2O3 (Rubinherstellung) können geschmolzen werden.
Durch die H2-Reduktionsschutzgaszone wird auch das Schmelzen
von unedlen Metallen ermöglicht.
(Alternativen für die Verarbeitung extrem hochschmelzender Werkstoffe sind
das Elektrodenstrahlschweißen im Vakuum und für kleinere Teile auch das Laserschweißen).
Verwendung von Verbindungen mit schweren Isotopen
Deuterium:
Schweres Wasser, D2O, wird als Moderator in Kernreaktoren verwendet.
Die Fusion von Deuterium-Kernen ist Basis der Funktion von Wasserstoffbomben:
21H + 21H ---> 42He
Praktisch wird dabei die nukleare Zersetzung von Litiumdeuterid LiD verwendet.
63Li + 21H ---> 2 42He + 22.4 MeV
Im Berich der Chemie sind deuterierte Verbindungen für Markierungsexperimente interessant.
Sie können als Indikator für Protonenwanderungen benutzt werden, da hier
ein ausgeprägter Isotopen-Effekt auftritt:
NH3 + D2O <---> NH3D+ + OD- ---> NH2D + HDO
Aus solchen Experimenten wird erkennbar, daß im NH4+ alle H-Atome gleichberechtigt
d.h. symmetrieäquivalent sind.
Dagegen läßt sich durch H-D-Austausch in der phosphorigen Säure:
H3PO3 <---> 2 H+ + HPO32-
zeigen, daß das letzte Proton nicht austauschbar ist, als kovalent an den Phophor gebunden ist.
Für diese Art von Experimenten sind Deuterium-Verbindungen erforderlich, die sich aus D2O z.B. nach
den folgenden Reaktionsgleichungen gewinnen lassen:
- SO3 + D2O ---> D2SO4
- Mg3N2 + D2O ---> ND3 + 3 MgO
- Al2S3 + 3 D2O ---> 2 Al(OD)3 + 3 D2S
- Al2Cl6 + 3 D2O ---> 6 DCl + Al2O3
Tritium ist in der Natur extrem selten.
Es ist ein ß-Strahler mit einer Halbwertszeit t1/2 von 12.35 Jahren:
31H ---> 32He + 1 e-
Tritium wird in der Medizin und der Analytik als Marker eingesetzt und
entsteht bei Höhenstrahlung:
147N + 10n ---> 31H + 126C
Die geändere Masse H - D - T wirkt sich bei den physikalischen und chemischen
Eigenschaften der Wasserstoffverbindungen (wie z.B. bei H2O) auch sichtbar aus:
| |
H2O |
D2O |
T2O |
| Dichte bei 25 [oC] [gcm-3] |
0.99701 |
1.1044 |
1.2138 |
| Temp. des Dichtemaximums [oC] |
4.0 |
11.2 |
13.4 |
| Schmelzpunkt [oC] |
0 |
3.81 |
4.48 |
| Siedepunkt [oC] |
100 |
101.421 |
101.51 |
| molare Schmelzwärme [kcal/mol] |
1.435 |
1.522 |
|
| pk-Wert bei 25 [oC] |
14.0 |
14.869 |
15.215 |
| Tab. 2.1.2. Vergleich der physikalischen Eigenschaften von
leichtem, schweren und superschwerem Wasser
|
Reaktionen
Die wichtigsten Reaktionstypen von Wasserstoff sind:
- Gegenüber den meisten Elementen und Verbindungen wirkt elementarer Wasserstoff
als Reduktionsmittel, z.B. Reduktion von Oxiden
CuO + H2 ---> Cu + H2O
Hierbei ist besonders zu beachten, daß H2 und H
sehr unterschiedliche Reaktivitäten zeigen können:
KMnO4 + H2 ---> keine Reaktion
KMnO4 + 2 H ---> Entfärbung
- Als Oxidationsmittel wirkt elementarer Wasserstoff nur gegenüber sehr
elektropositiven Elementen wie z.B. den Alkalimetallen:
2 Na + H2 ---> 2 NaH