Vorlesung Chemie der Nichtmetalle
2. Wasserstoff
2.2. Verbindungen: Übersicht/Einteilung
|
Genaueres zu den einzelnen Wasserstoff-Verbindungen wird jeweils
bei den einzelnen Elementen, die in der Vorlesung
Chemie der Metalle und Chemie der Nichtmetalle
behandelt werden, gesagt. An dieser Stelle geht es nur um eine Übersicht
und die prinzipielle Gruppierung der Wasserstoffverbindungen. Je nachdem, welcher Bindungspartner vorliegt,
unterscheidet man drei verschiedene Arten von Hydriden, die salzartige, die metallischen und die
kovalenten Hydride.
Die folgende Abbildung zeigt die Wasserstoffverbindungen der einzelnen Elemente im Periodensystem:
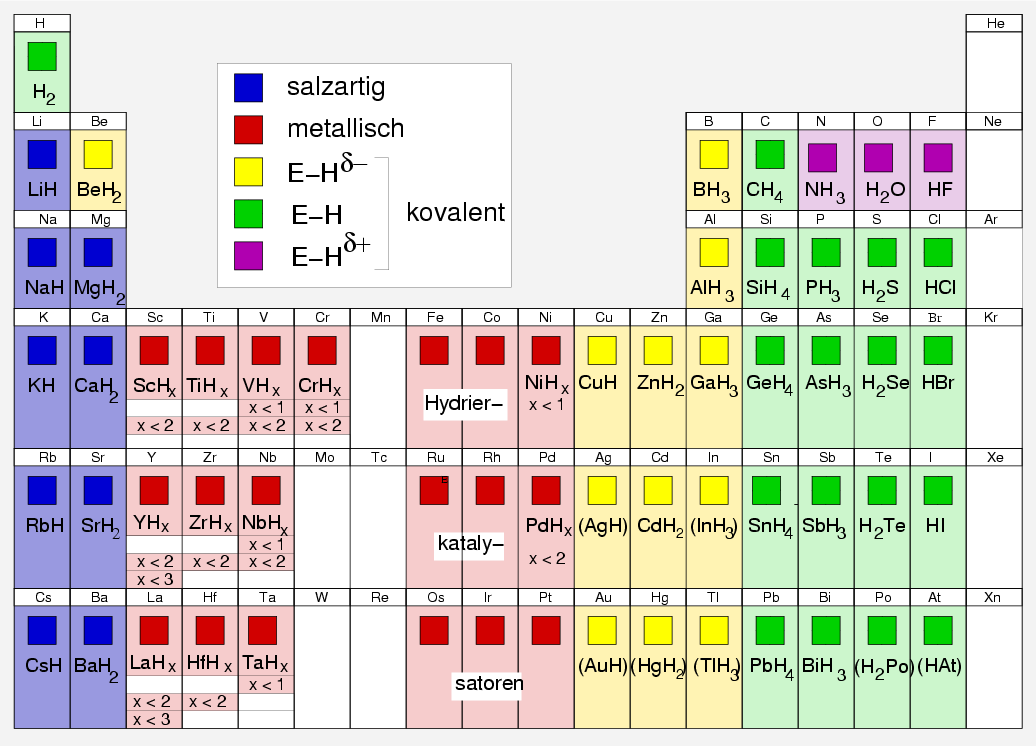 |
| Abb. 2.2.1. Wasserstoffverbindungen der Elemente im Periodensystem
‣SVG |
Zu den einzelnen Gruppen:
- Salzartige Hydride werden mit den elektropositiven Alkali- und
Erdalkalimetallen gebildet. Es handelt sich um typisch ionische Verbindungen
(Muster: CaH2, LiH) mit einfachen Strukturen der Ionenkristalle.
Da das Hydridion H- etwa den Ionenradius von Iodid I- hat (dabei
aber deutlich variabler ist als dieses), beobachtet man die entsprechenden einfachen Strukturen mit den
entsprechenden Zusammensetzungen:
- Die Alkalimetallhydrid AIH kristallisieren in der
NaCl-Struktur.
- Die Erdalkalimetallhydride AIIH2 von Calcium, Strontium und Barium
bilden bei höheren
Temperaturen den einfachen
Fluorit-Typ CaF2, bei Raumtemperatur
kristallisieren sie in komplizierten Strukturen.
MgH2 kristallisiert dagegen im Rutil-Typ.
(s. auch Kap. 3.6. der Vorlesung Chemie der Metalle).
 |
 |
 |
| Abb. 2.2.1. LiH |
Abb. 2.2.2. CaH2 |
Abb. 2.2.3. Ti mit TiH |
Die ionischen Hydride reagieren mit Wasser unter Bildung von elementarem Wasserstoff.
Sie finden kaum praktische Verwendung, weil sie in praktisch allen Lösungsmitteln
unlöslich sind.
- Metallische Hydride:
Viele Übergangsmetalle (außer den Elementen in der sogenannten Hydridlücke
und den Elementen der Zn- und Cu-Gruppe, die eher kovalente Wasserstoffverbindungen ausbilden)
bilden 'Hydride' mit z.T. erheblichen Phasenbreiten (nichtstöchiometrische Verbindungen)
Die Strukturen bestehen aus einfachen Metallpackungen (meist mit dichteste Kugelpackung)
in denen alle Oktaeder- und Tetraederlücken besetzt werden können, so daß eine
maximale Zusammensetzung von MH3 möglich ist.
Eine Reihe ternärer Legierungen wird als Wasserstoff-Speicher verwendet, da sie
reversibel mit Wasserstoff beladbar sind (s. Abb. 2.2.3. TiH).
Meist bleiben bei der Einlagerung von Wasserstoff die metallischen Eigenschaften erhalten,
häufig ist jedoch die Sprödigkeit deutlich erhöht (genaueres: ebenfalls bei den Metallen)
- Kovalente Hydride entstehen mit den typischen Nichtmetallen,
d.h. mit den Hauptgruppen-Elementen ab III. Gruppe im schrägen Verlauf durchs Periodensystem.
Die weitere Einteilung kovalenter Hydride erfolgt nach der Polarität E-H-Bindung in:
- Typische Verbindungen mit positiver Partialladung am Wasserstoff sind
z.B. HF, HCl H2O usw..
- Diese Verbindungen sind Säuren:
HCl + H2O ---> H3O+ + Cl-
(H+ werden übertragen, Säurewirkung)
- Sie sind weiterhin Oxidationsmittel
2 HCl + Zn ---> Zn2+ + 2 Cl- + H2
(Zink wird oxidiert, H+ zu elementarem Wasserstoff reduziert).
- Verbindungen ohne ausgeprägte Polarität der E-H-Bindung
(z.B. CH4, H2) sind neutral und i.A. nicht redoxaktiv.
- Eine Verbindungen mit negativ polarisiertem Wasserstoffatom ist z.B.
BH3.
- Diese Verbindungen sind Brönsted-Basen, wenn freie Elektronenpaare vorhanden sind:
PH3 + H+ ---> 2 PH4+
(PH3 nimmt Protonen auf, wirkt also als Base)
- Sie sind außerdem Reduktionsmittel:
SiH4 + O2 ---> SiO2 + 2 H2O
(O2 wird reduziert)
Zusätzlich zu den einfachen Hydriden existieren viele interessante kompliziertere Verbindungen
mit E-E-Bindungen z.B. in den Systemen P-H, B-H, aber auch bereits bei O-H.
Diese Verbindungen werden im folgenden bei den jeweiligen Elementen besprochen.
Eine weitere Besonderheit von Wasserstoff ist die Ausbildung sogenannter Wasserstoffbrücken-Bindungen.
Diese werden beim Fluor und Sauerstoff betrachtet.
Bilder-Reste:
- Salzartige Hydride:
- Metallische Hydride:




