Vorlesung Chemie der Nichtmetalle
4. Halogene: F, Cl, Br, I, At
4.1. Elemente
|
Allgemeines, Übersicht
Zu den Halo-gene, d.h. also übersetzt zu den sogenannten Salz-Bildnern, gehören
die Elemente
- Fluor (F)
- Chlor (Cl)
- Brom (Br)
- Iod (I)
- Astat (At)
Die folgende Tabelle gibt eine Übersicht über die wichtigsten physikalischen Daten
der Elemente:
| |
Fluor |
Chlor |
Brom |
Iod |
| EA [eV] |
-3.4 |
-3.6 |
-3.4 |
-3.1 |
| EN |
4.1 |
2.8 |
2.7 |
2.2 |
| IE [eV] |
17.5 |
13.0 |
11.8 |
10.4 |
| E0 [V] |
+ 2.87 |
+ 1.36 |
+ 1.07 |
+ 0.54 |
| EX2->2X [kJ/mol] |
158 |
244 |
193 |
151 |
| Mp [oC] |
-220 |
-101 |
-7 |
114 |
| dX-X [pm] |
142 |
199 |
228 |
267 |
| rX- [pm] |
136 |
181 |
195 |
216 |
| sonstige Tendenzen |
---> Affinität zu elektronegativen Elementen ---> |
| ---> metallischer Charakter ---> |
| <--- Affinität zu elektropositiven Elementen <--- |
| <--- Reaktionsfähigkeit und Oxidationsvermögen <--- |
Tab. 4.4.1. Eigenschaften der Halogene
Die elementaren Halogene wurden als reine Stoffe erst sehr spät entdeckt,
was natürlich direkt mit ihrer hohen Reaktivität zusammenhängt.
Es handelt sich um typische Nichtmetalle, und zwar Gase (F2, Cl2), eine
Flüssigkeit (Br2) und um Molekülkristalle im Fall von I2.
 |
 |
| 4.1.1. Elementares Brom |
4.1.2. Elementares Iod |
Die Elektronenkonfiguration der Halogene ist s2p5, d.h.
sie erreichen durch Aufnahme eines Elektrons die Edelgasschale und liegen damit dann
in der Oxidationsstufe -1 vor. Gegenüber sehr elektronegativen Partnern wie Fluor oder
Sauerstoff treten die schwereren Halogene jedoch auch in positiven Oxidationsstufen, und zwar
mit den Ladungen +1, +3, +5 oder +7 auf. Man beachte -- typisch für die Hauptgruppenelemente -- den
Wechsel in den Oxidationsstufen von jeweils zwei (ΔOS=2).
Diese Verbindungen der schweren Halogene zeigen wie die Edelgasverbindungen Hypervalenz.
Charakteristisches Merkmal der Halogenen ist ihre hohe Elektronegativität, die im Periodensystem
(wie immer, aber hier extrem) nach unten abnimmt (EN(F)=4.1 bis EN(I)=2.2).
Wegen dieser hohen Elektronegativität bilden die Halogene mit anderen elektronegativen Partnern
stets kovalente Verbindungen mit der Bindigkeit 1, mit elektropositiven Partnern
Salze (die in der Vorlesung Chemie der Metalle bei den jeweiligen Metallen mit behandelt werden).
In diesen Verbindungen liegen damit Ionen mit der Ladung -1 vor.
Die Halogene haben sehr positive Normalpotentiale, d.h. sie wirken stark oxidierend.
Ihre Ionisierungsenergien sind positiv, die Elektronenabgabe ist endotherm.
Die Halogene sind allgemein sehr reaktionsfreudig, wobei die
Affinität zu elektronegativen Elementen im Periodensystem nach unten zunimmt
und umgekehrt die Affinität zu elektropositiven Elementen nach unten abnimmt.
Z.B. kommt es zur Bildung höherer Fluoride des Iods, während höhere Fluoride des Chlors
unbekannt sind. Dagegen ist die Reaktion mit elementarem Natrium
bei Cl2 sehr heftig, mit I2 dagegen nur schwach exotherm.
Die Elektronenaffinität der Halogene ist dagegen negativ, d.h. die Aufnahme von
Elektronen (also die Reduktion) ist stark exotherm.
In den elementaren Halogenen sind je zwei Atome üeber eine σ-Bindung zu
Hanteln verknüpft (s.u.). Die Atomabstände dX-X
in diesen Hanteln haben den erwarteten Verlauf,
auch die Ionenradien der Anionen X- nehmen wie zu erwarten im
Periodensystem nach unten hin zu. Die Dissoziationsenergie der Moleküle X-X hat ein Maximum bei Cl2
wofür die bei F2 merkliche Abstoßung der nichtbindenden Elektronenpaare
verantwortlich gemacht wird.
Vorkommen
Die Halogene kommen sämtlich nicht elementar, sondern nur in gebundener Form in der Natur vor.
- Fluor
- Als wichtige Minerale sind die Fluoride CaF2 (Flußspat),
Na3AlF6 (Kyrolith, in Grönland),
Ca5(PO4)3(OH/F) (Apatit)
(vgl. Ersatz der OH- durch F- Zahnschmelzhärtung, Knochenhärtung)
zu nennen.
 |
 |
| 4.1.3. Flussspat |
4.1.4. Kryolith |
- Im Meerwasser kommt Fluorid mit ca. 1 mg F/l ebenfalls in recht großen Mengen vor.
- Chlor
- Die mineralogischen Bezeichnungen für die wichtigsten Chloride sind
NaCl (Steinsalz, Abb. 4.1.5), KCl (Sylvin, Abb. 4.1.6.) und KMgCl3.6 H2O (Carnallit).
 |
 |
 |
| 4.1.5. Steinsalz |
4.1.6. Sylvin |
- Der Magensaft (ohne Abb.) besteht aus einer 0.1 m HCl.
- Im Meer sind ca. 2 % Cl- enthalten
- Brom
- Das Bromid KMgBr3 . 6 H2O (Bromcarnallit) ist das wichtigste Mineral
mit Brom-Gehalt.
- Im Meerwasser sind ebenfalls größere Mengen gelöst, so daß sich die Gewinnung
von Brom aus dem toten Meer rentiert.
- Iod
- Im Seetang und in Algen wird Iod in Form organischer Verbindungen angereichert.
Früher wurde daraus Iod gewonnen.
- Die im Chilesalpeter (NaNO3) enthaltenen Mengen an Calciumiodat
Ca(IO3)2
sind heute die wichtigste Quelle für die Gewinnung von Iod.
- Astat
- Vom Astat sind nur radioaktive Isotope bekannt. Das stabilste Isotop,
210At, hat eine Halbwertszeit
t1/2 von nur 8.3 h.
Darstellung
Zur Darstellung der elmentaren Halogene ist für F, Cl und Br die
Oxidation von Halogenidionen nach
2 X- ---> X2 + 2 e-
erforderlich. Im Einzelnen werden dafür die folgenden Prozesse verwendet:
- Fluor
- Die Oxidation von Fluroid (2 F- --> F2 + 2 e-)
wird elektrolytisch durchgeführt.
Meist wird dabei in Schmelzen z.B. mit der Zusammensetzung
KF.HF (mit einem Schmelzpunkt von 217 oC) gearbeitet.
Die anderen Adukte wie z.B. KF.2 HF bzw.
KF.3 HF weisen mit 72 oC bzw. 66 oC
ebenfalls niedrige Schmelzpunkte auf.
Als Gefäßmaterialien werden Cu-Legierungen oder Monellmetall verwendet.
Die erforderliche Flußsäure HF wird dabei aus CaF2 und konzentrierter
H2SO4 gewonnen.
- Chlor
- Die elektrolytische Gewinnung z.B. aus HCl verläuft nach den folgenden
Teilgleichhungen:
Kathode: 2 H+ + 2e- ---> H2
Anode: 2 Cl- ---> Cl2 + 2 e-
Cl2 entsteht als Beiprodukt bei der NaOH-Herstellung durch
Chloralkali-Elektrolyse, d.h. der Elektrolyse einer wässriger NaCl-Lösung:
NaCl + H2O ---> NaOH + 1/2 H2 + 1/2 Cl2
Damit sind die Natronlauge- und die Chlor-Chemie eng miteinander gekoppelt.
Entscheidend für die Chloralkalielektrolyse ist die Trennung von Anionen- und Kationenraum,
die zur Vermeidung der beiden folgenden Nebenreaktionen erforderlich ist:
- H2 + Cl2 (Chlorknallgas-Reaktion)
- 1/2 Cl2 + 2 OH- ---> 2 OCl- + 2 H2O + Cl- (Disproportionierung)
Für die Elektrolyse gibt es drei verschiedene technische Verfahren: das noch benutzte
Amalgam-, das (inzwischen nicht mehr verwendete) Diaphragma- und das aktuelle Membranverfahren:
- Das Amalgamverfahren, das in Europa noch relativ weit verbreitet ist, nutzt
die hohe Überspannung von H2 an elementarem Quecksilber aus, die
das Potenial der Natrium und der Wasserstoff-Abscheidung vertauscht.
Die Elektrolyse einer 25 %-ige NaCl-Lösung
wirde bei 80 oC, 4-5 V, 300 kA und 8 bis 15 kA/m2 an
10 cm dicken, gelochte Graphitplatten als Anoden und eine Quecksilberkathode
von mehreren Quadratmetern Fläche durchgeführt
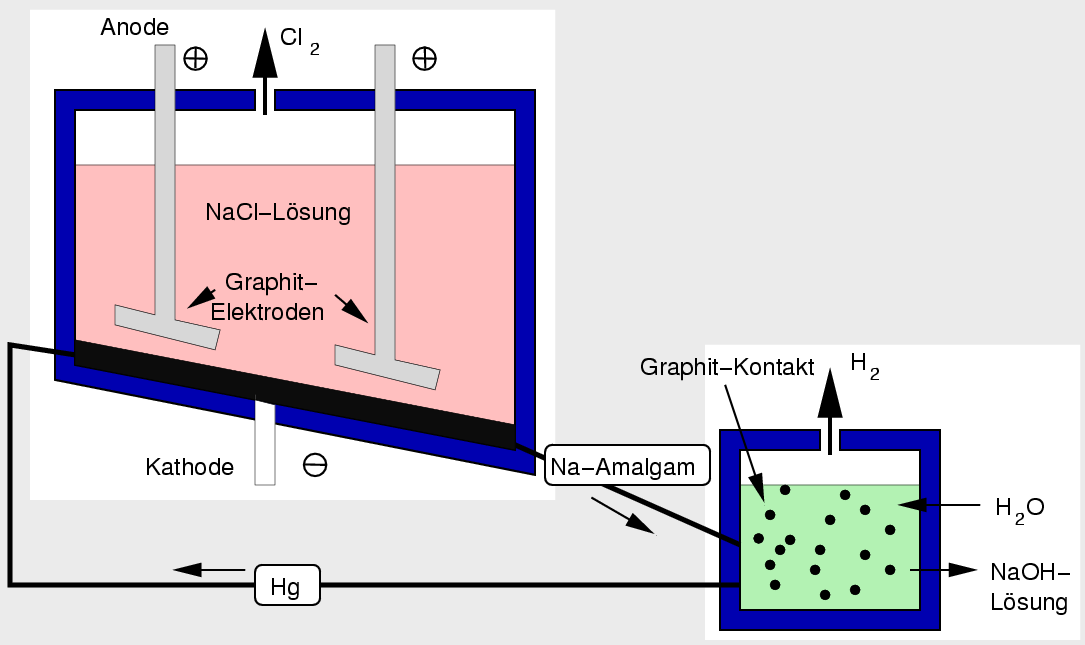 |
| Abb. 4.1.7. Amalgam-Verfahren
‣SVG |
Die ablaufenden Reaktionen sind:
- In der eigentlichen Elektrolysezelle:
2 NaCl ---> 2 Na + Cl2
- im sogenannten Amalgamabscheider:
2 Na + 2 H2O ---> 2 NaOH + H2
- Damit ergibt sich als Gesamtreaktion:
2 NaCl + 2 H2O ---> Cl2 + 2 NaOH + H2
Der Vorteil des Amalgamverfahrens liegt in der Möglichkeit, absolut Chlorid-freie Natronlauge
darstellen zu können. Der offensichtliche Nachteil des Verfahrens ist die
nur schwer vermeidbare Emission elementaren Quecksilbers. Beispielsweise
wurden im Jahre 1992 allein in Europa ca. 26 t Hg freigesetzt.
- Bei dem inzwischen kaum mehr durchgeführten Diaphragmaverfahren erfolgt eine
einfache Elektrolyse mit einer Trennung der beiden Elektrodenräume durch
ein Asbest-Diaphragma. Die Verwendung von Asbest ist ab 2009 auch für diese
Zwecke verboten. Nachteile des Verfahrens war der hohe Sauerstoffgehalt des
erhaltenen Chlors und die Tatsache, daß lediglich verdünnte NaOH dargestellt
werden konnte.
- Das Membran-Verfahren wird in Zukunft die Methode der Wahl
zur Herstellung von Chlor sein. Zur Zeit beträgt der Anteil am Weltmarkt ca. 40 %,
alle Neuanlagen arbeiten nach diesem Verfahren.
Es handelt sich um eine Variante des alten Diaphragmaverfahrens,
bei der Anoden- und Kathodenraum durch eine Membran aus Nafion
(modifiziertes Polytetrafluorethylen) getrennt sind, die
Na-Ionen leitend und gleichzeitig hydraulisch undurchlässig ist.
Das Membranverfahren wird seit Jahren in den USA und in Japan bevorzugt,
braucht aber relativ sauberes NaCl als Ausgangsstoff.
Sein Vorteil ist der geringere Energieverbrauch und die bis 35-prozentige Natronlauge, die
praktisch Cl--frei ist. Umweltschädliche Stoffe wie Asbest oder
Quecksilber werden nicht benötigt. (Materialien zur
Anlage von www.uhde.eu).
Daneben gibt es eine Reihe sehr alter Methoden zur Herstellung von Chlor, die heute
nur noch aus historischen Gründen erwähnenswert sind. In beiden
Fällen wird praktisch indirekt mit Sauerstoff oxidiert:
- Der Weldon-Prozeß ist die chemische Oxidation mit MnIV nach:
4 HCl + MnIVO2 ---> MnIICl2 + Cl2 + 2 H2O
die als Kreisprozess geführt werden kann:
MnCl2 + CO2/O2 ---> MnO2 + Cl2
- Die direkte katalytische Oxidation, das sogenannte Deacon-Verfahren,
arbeitet bei 450oC mit einem CuCl2-Katalysator.
4 HCl + O2 ---> 2 Cl2 + 2 H2O
- Zur Herstellung kleinerer Mengen z.B. im Labor eignet sich die
Gewinnung aus Chlorkalk, der als 3 Ca(OCl)Cl.Ca(OH)2.5 H2O
käuflich ist:
Ca(OH)2 + Cl02 ---> Ca[OCl+]Cl- + H2O
Ca(OCl)Cl + CO2 ---> Cl2 + CaCO3
- Brom
- Brom wird aus Meerwasser, das bis 65 ppm Bromid enthält (bevorzugt: totes Meer) durch
Einleiten von Cl2 gewonnen:
2 Br- + Cl2 ---> Br2 + 2 Cl-
- Chemisch kann es durch Oxidation mit Chromat erhalten werden:
6 KBr + K2CrVI2O7 +
7 H2SO4 --->
CrIII2(SO4)3 + 3 Br02 +
4 K2SO4 + 7 H2O
- Iod
- Die Herstellung von Iod kann durch Reduktion von Iodat, das z.B. in Chilesalpeter
enthalten ist, mit SO2 gewonnen werden:
HI+VO3 + 3 H2S+IVO3
---> HI + 3 H2S+VIO4
HIO3 + 5 HI ---> 3 I2 + 3 H2O
Diese Reaktion ist ürbigens die Basis für die Landolt-Reaktion (chemische Uhr),
bei der je nach Menge des zugesetzten Reduktionsmittels
unterschiedliche Zeiten bis zum Farbumschlag des I2-Stärke-Farbstoffs
vergehen.
- Iod kann auch aus I--haltiger Sole durch Einleiten von Cl2
hergestellt werden.
Verwendung
Die verschiedenen elementaren Halogene werden wie folgt praktisch verwendet:
- Fluor wird zur Herstellung einer Reihe wichtiger anorganischer und organischer Fluroverbindungen
verwendet:
- Herstellung organische Fluorverbindungen (Teflon usw.)
- Herstellung von SF6 (Isoliergas: Wärme- und Schalldämpfung,Kühlmittel, Dielektrikum
geringes Diffusionsvermögen (Autoreifenfüllung))
- Herstellung von UF6 (früher sehr große Mengen, Isotopentrennung von U)
- Chlor
- Bleich- und Oxidationsmitteln (Desinfektion von Trinkwasser)
- Synthese organischer Verbindungen
- Weltproduktion: 40 Mill t/Jahr
- 60 % aller Chemikalien sind an Cl2 gekoppelt!
- Brom
- Desinfektion
- in Flammschutzmitteln
- organische Synthese
- Fotographie (früher, als Br-)
- Iod
- kann zur Entkeimung (I2-Tinktur)
- in der organischen Chemie (I-Grignard)
- als I- als Speisesalzzusatz und in Schilddrüsenhormone verwendet werden.
Struktur und physikalische Eigenschaften
Die elementaren Halogene bestehen aus X2-Hanteln (X = F, Cl, Br, I).
F2 und Cl2 sind stechend riechende, giftige Gase
(Lungenverätzungen, MAK-Wert v. F2: 0.1 ppm).
Br2 ist eine braune Flüssigkeit und außer Quecksilber das einzigste
unter Normalbedingungen flüssige Element. Unterhalb von -7oC wird es fest.
I2 bildet violette, leicht sublimierbare plattige Kristalle;
die Kristallstruktur (s. Abb. 4.1.8) zeigt, dass Schichten vorliegen.
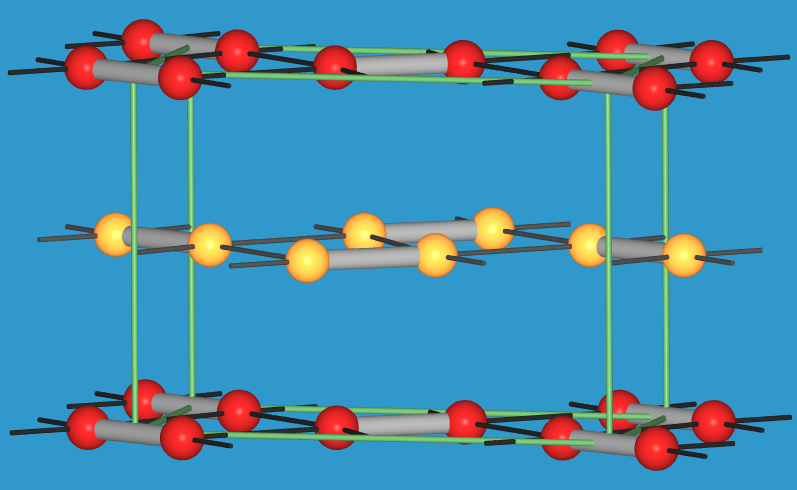
|
| Abb. 4.1.8. Kristallstruktur von Iod
‣VRML
|
Der I-I-Abstand in den Hanteln beträgt 271 pm, die Distanzen innerhalb der Schicht,
die in Abb. 4.1.8 als dünne Bindungen eingezeichnet sind, betragen zwischen 350-390 pm,
während der Abstand zwischen den Schichten bei 450 pm liegt.
Ab 60oC liegt I2-Gas vor, dadurch ist elementares Iod
das Musterbeispiel für einen sublimierbaren Festkörper.
Auch alle anderen Halogene nehmen bei entsprechend tiefer Temperatur diese Kristallstruktur an.
Weitere Details zur Strukturchemie der Halogene finden sich
im Kap. 2.2.2. der Vorlesung
Anorganische Strukturchemie.
Bindung
Die chemische Bindungen in den X2-Molekülen kann wieder nach den unterschiedlichen
Modellen beschrieben werden:
- Durch die Lewis-Valenzstrichformel X-X wird deutlich, dass sich beide Atome X
ein Elektronenpaar teilen.
- In der VB-Beschreibung überlappen die pz-Zustände.
- In der MO-Beschreibung ergibt sich,wie Abb. 4.1.9 zeigt, ein
Energiegewinn durch die Besetzung eines σ-bindenden Molekülorbitals (Einfachbindung),
das nach dem LCAO-Ansatz aus den beiden pz-Zuständen der X-Atome besteht.
- VRMLs aller Orbitale
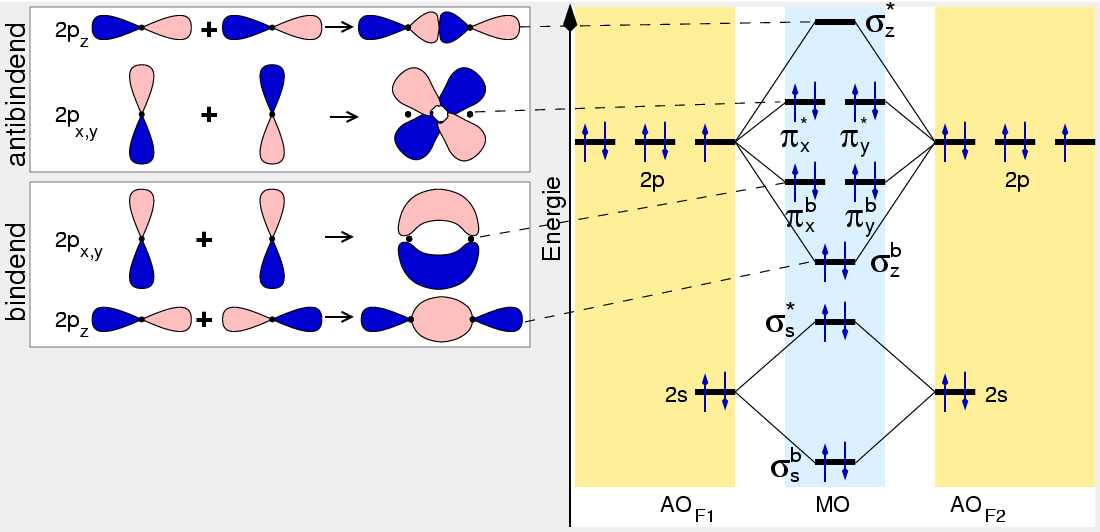 |
| Abb. 4.1.9. MO-Schema von F2
‣SVG
|
Löslichkeit
Die elementaren Halogenen lösen sich in unterscheidlichen Lösungsmitteln mit charakteristischen Farben.
- In Wasser ist Cl2 besser löslich als Br2 und I2.
Die Lösungen nennt man Chlorwasser, Bromwasser usw.
Beim Abkühlen unterhalb von 8 oC kristallisiert
aus Chlorwasser das Clathrathydrat 8 Cl2.46 H2O
(s. Kap. 3.2.).
Elementares I2 bildet mit KI eine blaue KI3-Lösung,
deren Farbe oberhalb von 60 oC verschwindet.
Diese Lösung gemeinsam mit Ethanol dient als Iod-Tinktur als Desinfektionsmittel und
beim Wundverband.
- Bei organischen Lösungsmitteln muß unterschieden werden:
- In halogenhaltigen Kohlenwasserstoffen liegen I2-Moleküle vor, die
Lösungen sind violett.
- Mit vielen anderen Lösungsmitteln kommt es zur Bildung sogenannter
Charge-Transfer-(CT)-Komplexe, wenn Wechselwirkungen mit einem Donor-Elektronenpaar
des Lösungsmittels oder mit den π--Elektronen auftreten.
Sauerstoff- oder Stickstoff-haltige Lösungsmittel ergeben braune Farben, die
CT-Komplexe sind in den Festkörpern isolierbar (s. z.B. den Komplex mit Dioxan
in Abb. 4.1.10).
Mit aromatischen Lösungsmitteln entstehen entsprechende
CT-Komplexe, die ebenfalls isolierbar sind.
Z.B. bildet sich in Benzol der rote Komplex C6H6.X2
(s. Abb. 4.1.10. rechts).
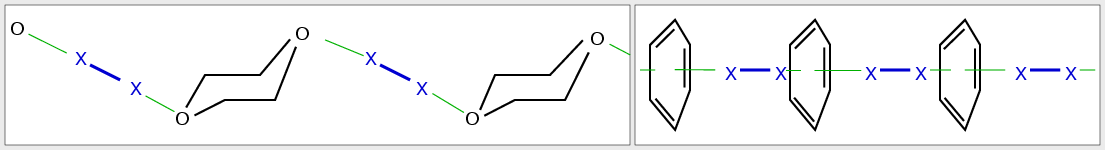 |
| Abb. 4.1.10. CT-Komplexe der
Halogene mit Dioxan (links) und Benzol (rechts)
‣SVG
|
Grund für die Farbigkeiten sind breite Charge-Transfer-Banden im VIS-Spektrum.
Reaktionen
Im folgenden sind einige typische Reaktionen der einzelnen Halogene in Stichworten aufgezählt:
- F2
- ist stark oxidierend.
- reagiert mit fast allen Elementen, z.T. sogar explosionsartig.
- bildet mit Elementen Verbindungen in den höchsten Oxidationsstufen
wie z.B. OsF8, IF7, Sb+VF5 usw.
- reagiert mit Al, Cu, Fe nur langsam, da es zur Bildung dichter Fluoridschichten kommt.
- Cl2
- wirkt elementar oxidierend und bei Anwesenheit von Feuchtigkeit auch bleichend
und wird daher als Desinfektionsmittel eingesetzt.
- typische Reaktionen (vgl. Grundvorlesung) sind:
- mit P(weiß) und Sb(metallisch) Oxidation bereits in der Kälte.
- mit Eisen Reaktion beim Erwärmen.
- mit NO Bildung von NOCl2 nach
NO + Cl2 ---> 2 NOCl2
- Eine Flamme brennt in elementarem Chlor weiter, d.h. Cl2 unterhält die Verbrennung.
- Mit Wasserstoff erfolgt in der Kälte keine Reaktion.
Erst bei Bildung von Radikalen (z.B. mit Mg-Licht) kommt es zur
bekannten Kettenreaktion (z.B. für die Chlorknallgasreaktion):
| Start: | Cl2 ---> Cl. + Cl. |
| Kettenreaktion: | Cl. + H2 ---> HCl + H. |
| H. + Cl2 ---> HCl + Cl. |
| Abbruch: | 2 H. ---> H2 |
| 2 Cl. ---> Cl2 |
| H. + Cl. ---> HCl |
- Br2 zeigt ebenfalls oxidierende Wirkung.
Die folgenden Reaktionen sind aus der Grundvorlesung bekannt:
- Bromwasser wird mit Schwefelwasserstoff entfärbt:
Br2 + H2S ---> S + 2 HBr
- Mit elementarem Aluminium erfolgt heftige Reaktion unter Oxidation
des Aluminium zu Al-Tribromid:
3 Br2 + 2 Al ---> 2 AlBr3
- Zink wird von Bromwasser oxidiert:
Br2 + Zn ---> ZnBr2
- Auch I2 zeigt oxidierende Wirkung, die z.B. in den folgenden Reaktionengleichungen
sichtbar wird:
- Iodwasser + H2S ---> S (Entfärbung)
- 3 I2 + 2 Al ---> 2 AlI3 (heftige Reaktion)
- I2 + Hg ---> HgI2 (rot)
Analytischer Nachweis
Charakteristisch ist die Bildung typischer schwerlöslicher Niederschläge
der Halogenid-Ionen mit Ag+, die sich leicht in der Farbe
unterscheiden und die auch anhand ihrer Löslichkeit in Ammoniak
unterschieden werden können: AgCl ist ein weißer, käsiger Niederschlag, AgBr ist schwach gelblich
und AgI ist gelb. Dagegen ist AgF verhältnismäßig leicht löslich. Andere
schwerlösliche Fluoride sind CaF2, SrF2 und BaF2.









