| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle4. Halogene: F, Cl, Br, I, At4.2. Wasserstoffverbindungen |
Die Halogenwasserstoffe HX bilden mit Wasser Halogenwasserstoffsäuren wie z.B. Flußsäure, Salzsäure, Bromwasserstoffsäure. Die folgende Tabelle gibt eine Übersicht über die wichtigsten Eigenschaften der Halogenwasserstoffsäuren und ihrer Lösungen.
| HF | HCl | HBr | HI | |
| Siedepunkt [oC] | +19.5 | -85.1 | -66.7 | - 35.4 |
| Schmelzpunkt [oC] | -83.1 | -114.2 | -86.8 | -50.8 |
| Bildungsenthalpie [kJ/mol] | -271 | -92 | -36 | 27 |
| Tendenzen | -----> Säurestärke -----> | |||
| <----- thermische Stabilität <----- | ||||
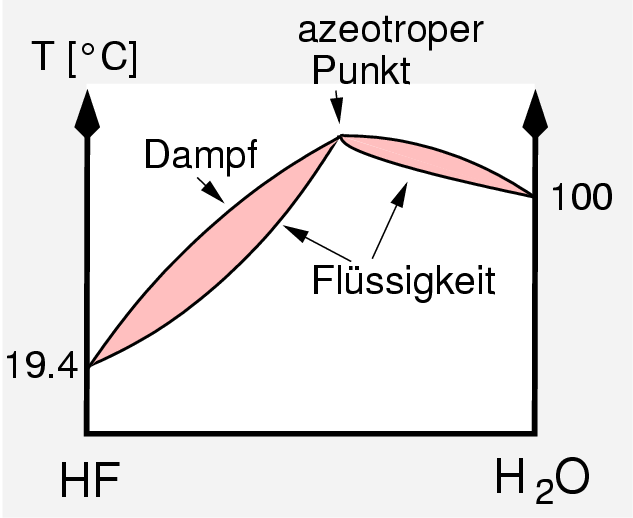
| Azeotrope (Gew.% HX) | 35 | 20.2 | 47 | 57 |
| Azeotrop-Siedepunkt [oC] | 112 | 110 | 126 | 127 |
| dH-X [pm] | 92 | 127 | 142 | 162 |
 |
| Abb. 4.2.1. Positiv-Azeotrop von HF-H2O ‣SVG |
| Ion | F- | Cl- | Br- | I- |
| dH-X [pm] | 92 | 127 | 142 | 162 |
| Ionenradius von X- [pm] | 136 | 181 | 195 | 216 |
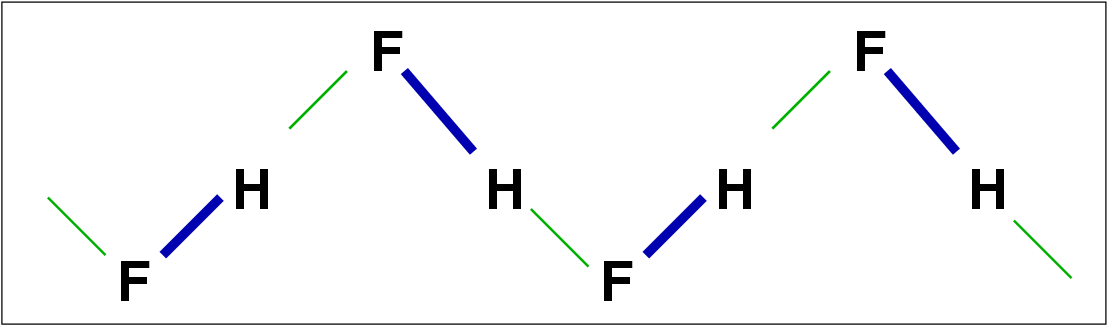 |
| Abb. 4.2.2. H-Brücken in flüssigem HF ‣SVG |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |