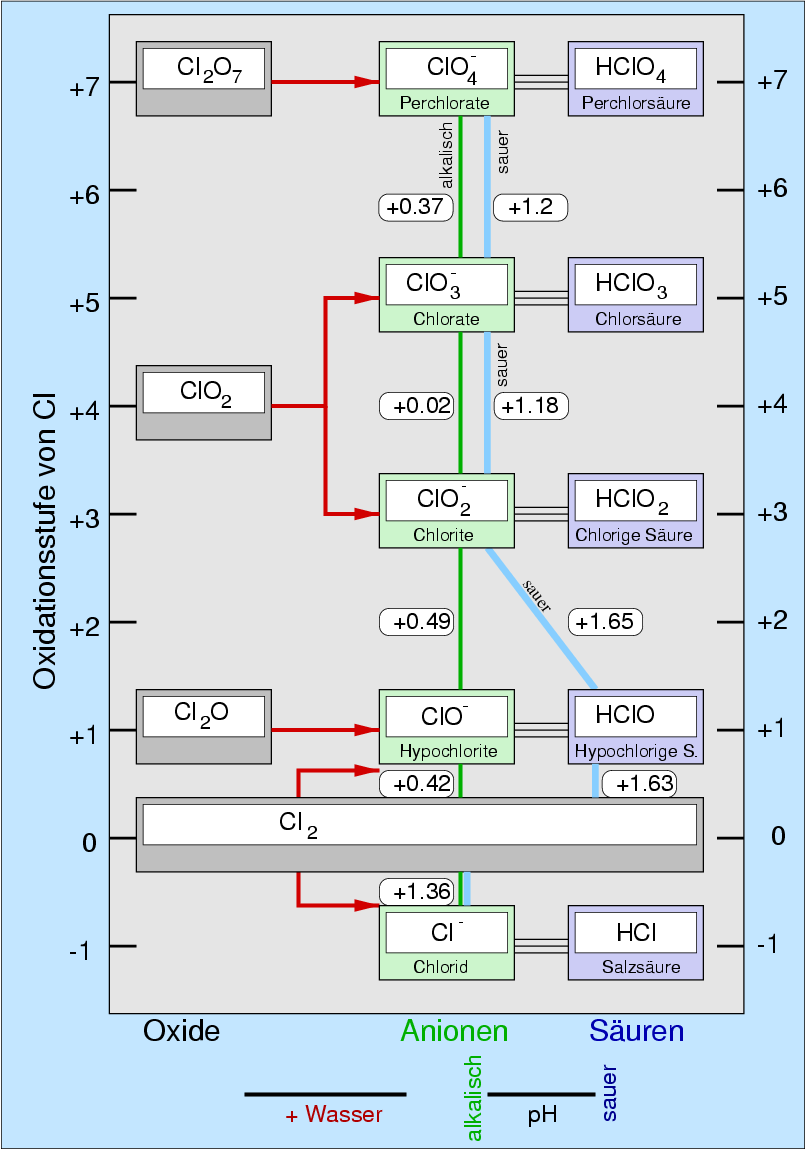
In der folgenden Tabelle 4.5.1. sind die wichtigsten Sauerstoffsäuren der Halogene zusammengestellt:
| n |
Formel |
Bezeichnung |
X in HXOn |
Darstellung |
| Säuren |
Salze |
F |
Cl |
Br |
I |
| 1 |
HXO |
Unterhalogenige S., Halogen(I)-S. |
Hypohalogenite |
+ |
+ |
+ |
+ |
X2 + 2 H2O <---> H3O+ + X- + HOX |
| 2 |
HXO2 |
Halogenige S., Halogen(III)-S. |
Halogenite |
- |
+ |
(+) |
(+) |
2 ClO2 + 2 OH- + H2O2 ---> 2 ClO2- + 2 H2O + O2;
BrO- + ClO- ---> BrO2- + Cl- |
| 3 |
HXO3 |
Halogen-S., Halogen(V)-S. |
Halogenate |
+ |
+ |
+ |
3 OX- <---> X- + XO3- bzw.
für X=I: I2 + 5 Cl2 + 6 H2O ---> 2 HIO3 + 10 HCl
|
| 4 |
HXO4 |
Perhalogen-S., Halogen(VII)-S. |
Perhalogenate |
+ |
+ |
+ |
anodische_Oxidation_von_Chloraten:
ClO3- + H2O <---> ClO4- + 2 H+ + 2 e-
|
| 4 |
H5IO6 |
Orthoperiodsäure |
|
- |
- |
+ |
| 4 |
H7I4O14 |
Triperiodsäure |
|
+ |
|
| 4 |
(HIO4)x |
Polyperiodsäure |
|
+ |
|
Für die einzelnen Säuren werden im folgenden allgemeine Tendenzen bzw. Angaben
bezüglich
| Verbindung |
Darstellung |
Verwendung |
| ClIVO2 |
NaCl+VO3 + 2 HCl-I ---> ClIVO2 + 1/2 Cl02 + NaCl + H2O |
Bleichmittel (z.B. Papierherstellung), Desinfektionsmittel, Einkeimung |
| 2 NaCl+VO3 + S+IVO2 + H2SO4 ---> 2 ClIVO2 + 2 NaHSO4 |
| Cl+IO- |
2 NaOH + Cl02 ---> NaOCl+I + NaCl-I + H2O4 |
Desinfektionsmittel, Bleichlauge |
| Ca(OH)2 + Cl02 ---> Ca(OCl+I)Cl-I + H2O |
| ClIIIO2- |
2 ClIVO2 + 2 NaOH + H2O-I2 ---> 2 NaCl+IIIO2 + 2 H2O + O02 |
|
| Cl+VO3- |
(1) Cl02 + H2O ---> HOCl+I + HCl-I |
U-Verarbeitung; K-Salz: Feuerwerkskörper, Zündhölzer |
| (2) OH- + Cl02 ---> [OCl+I]- + HCl-I |
| (3) 2 HOCl + OCl- ---> ClO3- + 2 HCl |
| Cl+VIIO4- |
NaClO3 + H2O ---> NaClO4 + H2 |
Raketentreibstoff, Feuerwerkskörper |
| Cl2 + 8 H2O ---> 2 HClO4 + 7 H2 |