| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle4. Halogene: F, Cl, Br, I, At4.4. Sauerstoffhalogenide -- Halogenoxide |
| Formel | Sauerstoff- fluoride | Chloroxide | Bromoxide | Iodoxide | |
| X2O | OF2 (200 oC), farbl. Gas | Cl2O (60 oC), gelbbraunes Gas | Br2O (-40 oC), brauner Feststoff | - | |
| X2O2 | O2F2 (-95 oC), orangerot (s) | - | |||
| X2O3 | - | Cl2O3 (-45 oC), dunkelbrauner Feststoff | Br2O3 (-40 oC) | - | |
| X2O4 | O4F2 (-185 oC),rotbraun (s) | Cl2O4 (0 oC), gelbe Flüssigkeit | ClO2 (45 oC), gelbrotes Gas | Br2O4 | I2O4, gelber Festkörper |
| X2O4.5 | - | - | - | I4O9 | |
| X2O5 | - | - | Br2O5 (-20 oC), farbloser Feststoff | I2O5 (300 oC), farbloser Feststoff | |
| X2O6 | - | Cl2O6, rote Flüssigkeit | - | I2O6, gelber Feststoff | |
| X2O7 | - | Cl2O7, farblose Flüssigkeit | - | - | |
 |
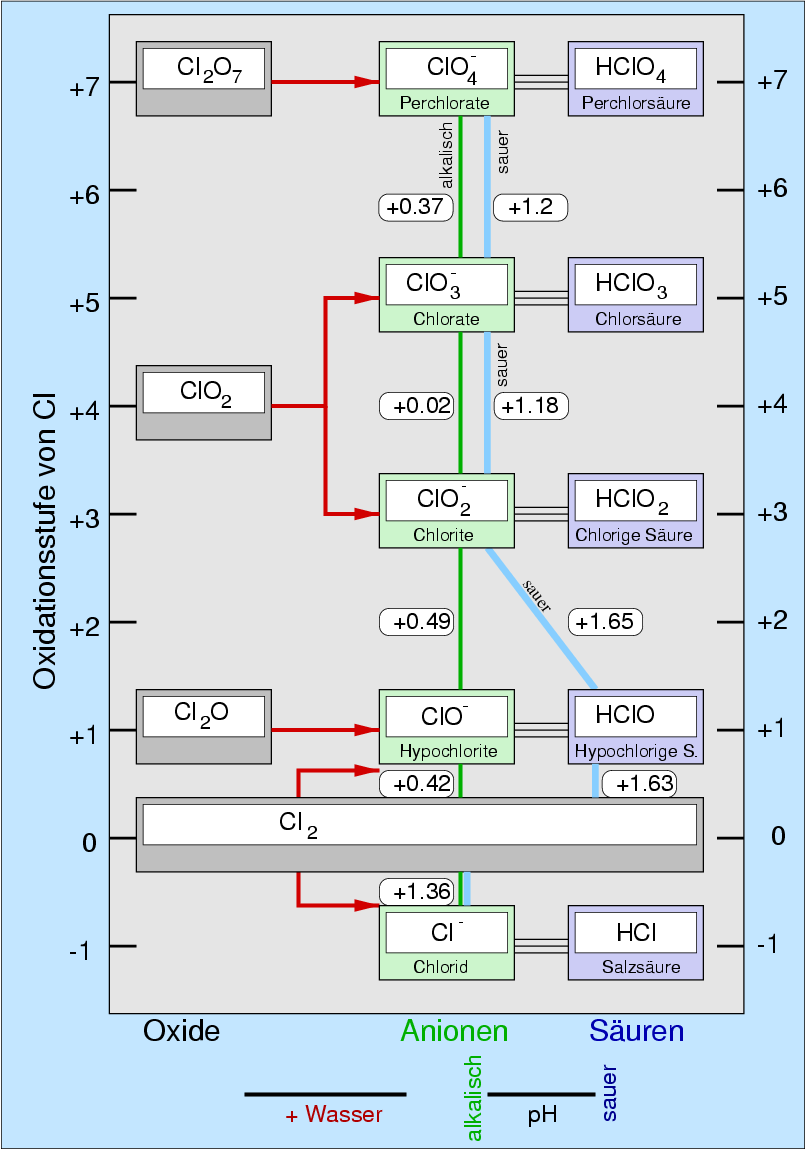
| Abb. 4.4.1. Übersicht über Oxide und Sauerstoffsäuren des Chlors ‣SVG |
 |
| Abb. 4.4.2. Valenzstrichformeln von Cl-Sauerstoffverbindungen ‣SVG |
| Formel | ClO2+ | ClO20 | ClO2- |
| Abstand Cl-O [pm] | 141 (Doppel-Bdg.) | 148 | 157 (Einfach-Bdg.) |
| Winkel O-Cl-O [o] | 119 | 117 | 110 |
 |
 |
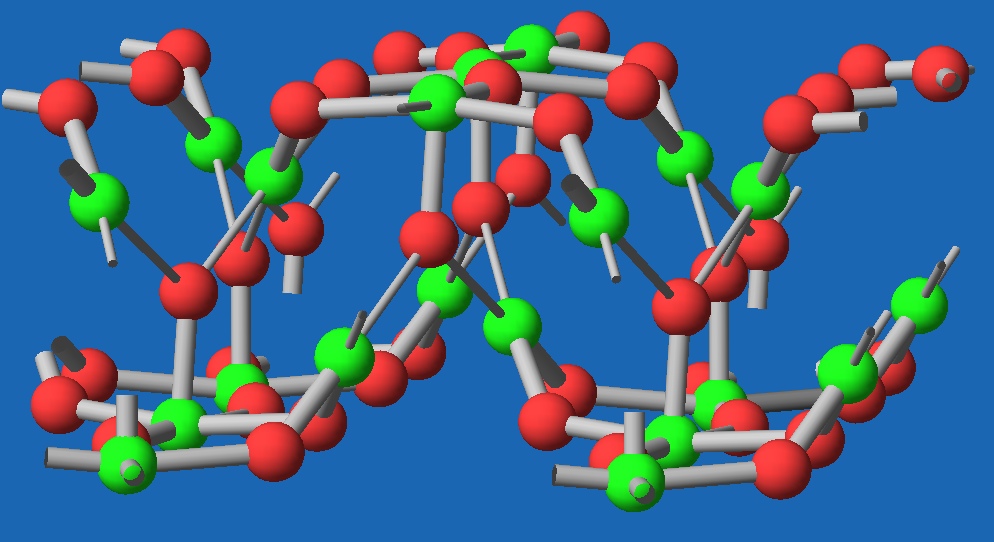 |
| Abb. 4.4.3. Struktur von I2O5 ‣VRML | Abb. 4.4.4. I2O5 | Abb. 4.4.5. Struktur von I2O4 ‣VRML |
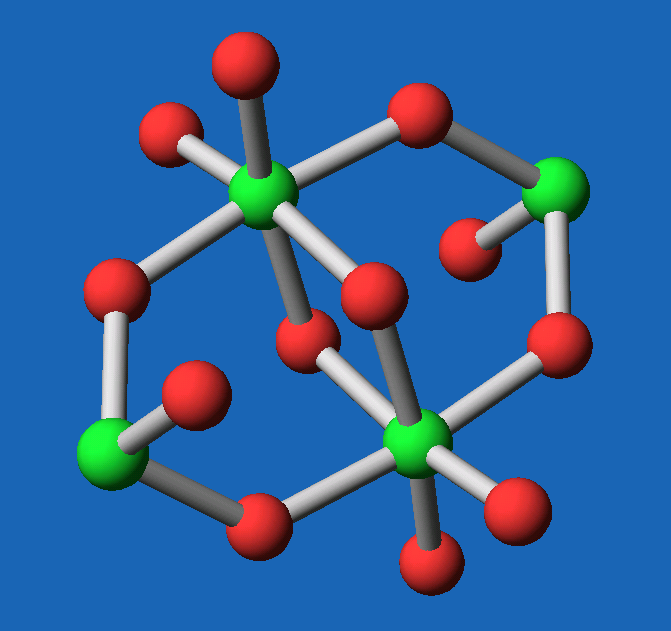 |
| Abb. 4.4.6. Struktur von I4O12 ‣VRML |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |