

| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle6. Pnicogene (Pentele): N, P, As6.1. Elemente |
| Stickstoff | Phosphor | Arsen | Antimon | Bismut | |
| EN | 3.0 | 2.1 | 2.2 | 1.8 | 1.7 |
| IE [eV] | 14.5 | 11.0 | 9.8 | 8.6 | 7.3 |
| EX2->2X [kJ/mol] | 946 | . | . | . | . |
| Mp [oC] | -210 | 44 | 817 | 630 | 271 |
| Kp [oC] | -196 | 280 | 616 (Subl.) | 1635 | 1580 |
| dX-X [pm] | 109.8 | 189.3 | . | . | . |
| sonstige Tendenzen | ⟹ Affinität zu elektronegativen Elementen ⟹ | ||||
| ⟹ metallischer Charakter ⟹ | |||||
| ⟹ basischer Charakter der Oxide und Hydroxide ⟹ | |||||
| ⟹ ionischer Charakter der Halogenide ⟹ | |||||
| ⟸ Affinität zu elektroposiviten Elementen ⟸ | |||||
| ⟸ Reaktionsfähigkeit und Oxidationsvermögen ⟸ | |||||
Die Elemente der V. Hauptgruppe oder 15. Gruppe sind:
 |
 |
| Abb. 6.1.1. Roter Phosphor | Abb. 6.1.2. Schwarzer Phosphor |
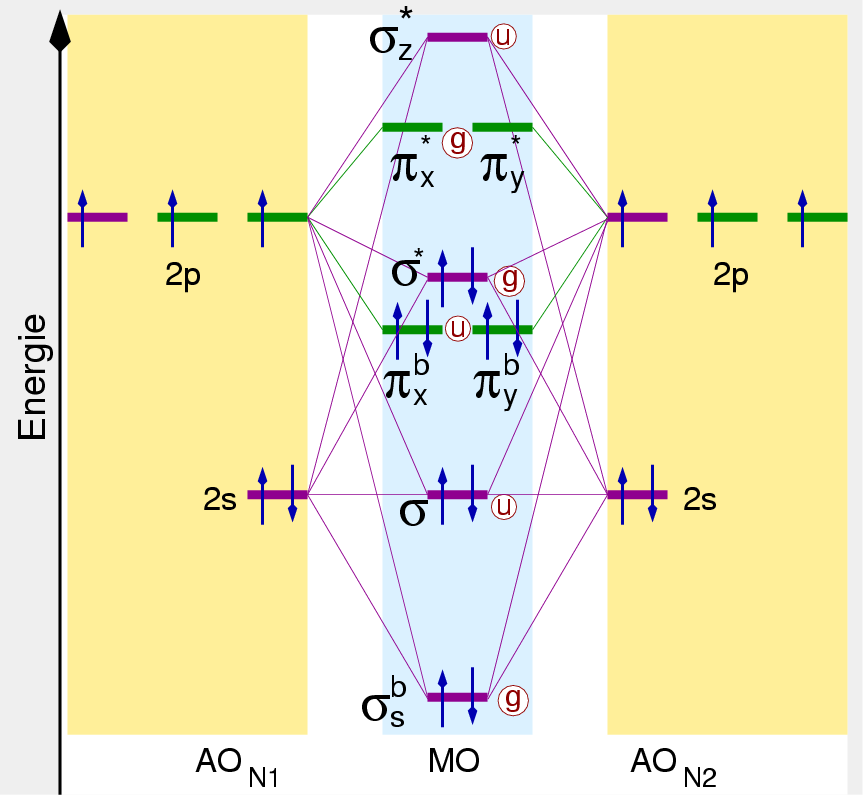 |
| Abb. 6.1.3. MO-Schema von Distickstoff ‣SVG |
 |
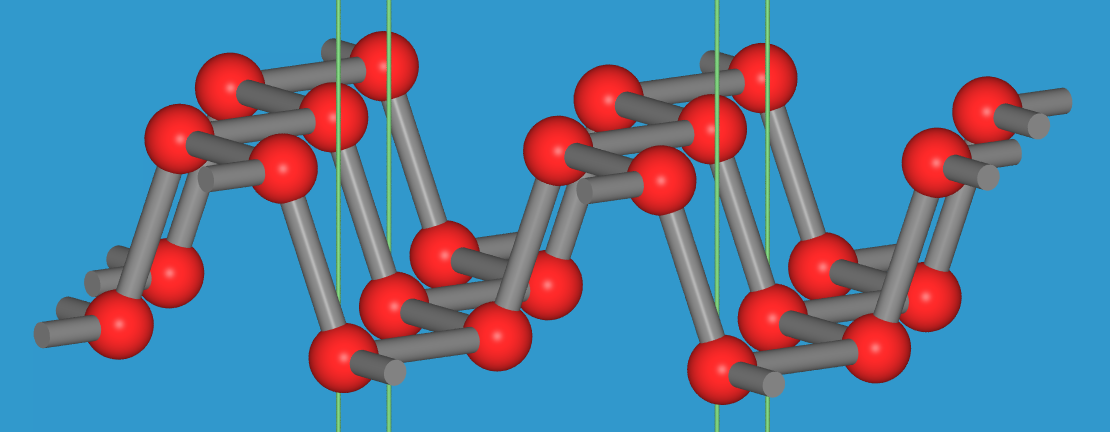
| Abb. 6.1.4. Polymorphie von Phosphor ‣SVG |
| P4 (weiß) | P (Hittorf) | P (schwarz) | ||
 |
 |
 |
 |
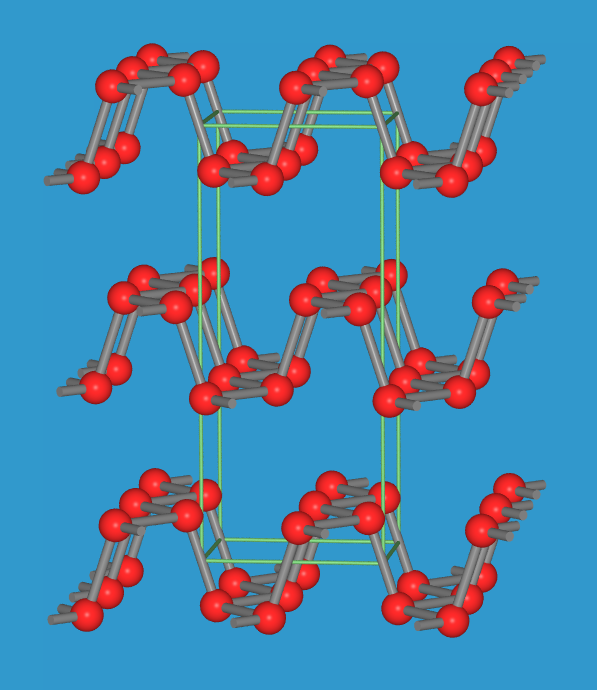 |
| Tetraeder, Elementarzelle, (s.a. ST-DB) | Fünfeckige Röhren, schematischer Ansicht der Röhrenverschachtelung | Schichtstruktur: eine Schicht und die Gesamtstruktur | ||
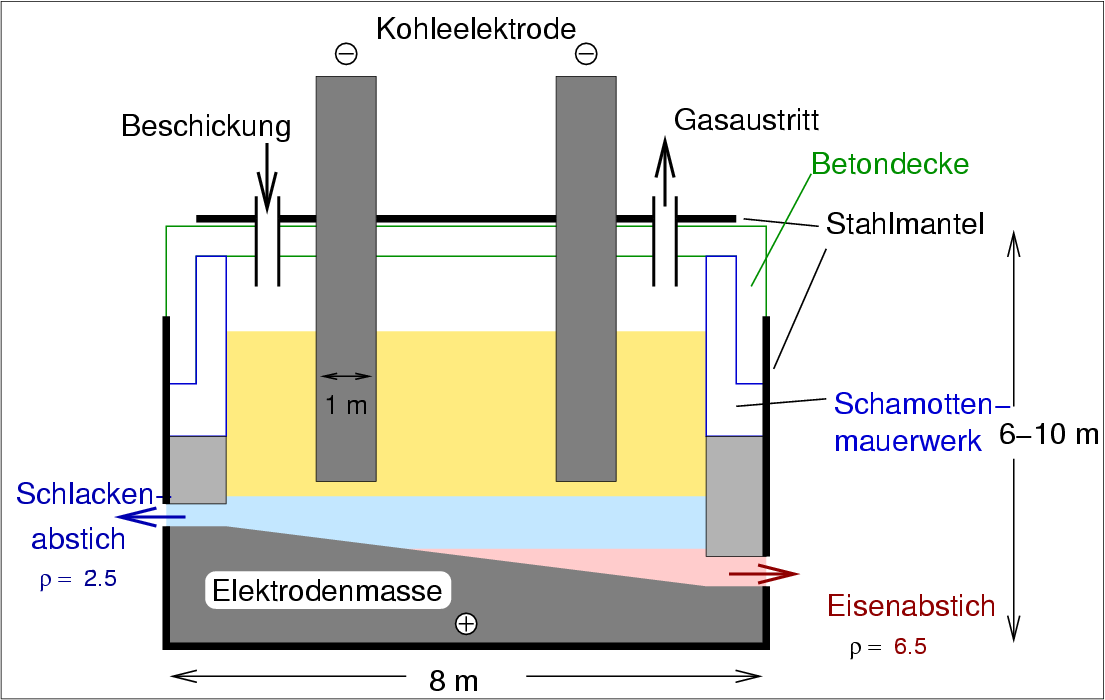 |
| Abb. 6.1.5. Lichtbogen-Elektrolyse zur Herstellung von Phosphor ‣SVG |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |