| Produkt |
Verfahren/Reaktion |
| Herstellung von Düngemitteln |
| Harnstoff |
2 NH3 + CO2 ⟶ H2NCOONH4 |
| H2NCOONH4 ⟶ NH2CONH2 + H2O |
| Ammoniumsulfat |
2 NH3 + H2SO4 ⟶ (NH4)2SO4 |
| 2 NH3 + CO2 +H2O + CaSO4 ⟶ (NH4)2SO4 + CaCO3 |
| Ammoniumnitrat | NH3 + HNO3 ⟶ NH4NO3 |
| Kalkammonsalpeter | Eintragen von CaCO3 in eine NH4NO3-Schmelze |
| Ammoniumphosphate | Neutralisation von H3PO4 mit NH3 |
| Ammoniumchlorid | Neutralisation von HCl mit NH3, doppelte Umsetzung von Ammoniumsalzen |
| Herstellung von Zwischen- und Endprodukten |
|
Salpetersäure | 4 NH3 + 5 O2 ⟶ 4 NO + 6 H2O |
2 NO + O2 ⟶ 2 NO2 |
3 NO2 + H2O ⟶ 2 HNO3 + NO |
| Blausäure | CH4 + NH3 ⟶ HCN + 3 H2 |
|
Hydrazin | NH3 + Cl2 ⟶ NH2Cl + HCl |
| NH3 + NH2Cl ⟶ N2H4 + HCl |
| Ammoniumnitrit | 2 NH3 + H2O + NO + NO2 ⟶ 2 NH4NO2 |
|
Hydroxylamin | NO2- + 2 HSO3- ⟶ HON(SO3-)2 + OH- |
| HON(SO3-)2 + H2O ⟶ HONHSO3- + HSO4- |
| HONHSO3- + H2O ⟶ NH2OH + HSO4- |
| Alkylamine | Umsetzung von Fettsäuren mit NH3 zu Nitrilen, anschließende Hydrierung (Verw. als Flotationsmittel) |
| Methylamine | Umsetzung von Methanol bzw. Dimethylether mit NH3 |
|
Amidoschwefelsäure | 2 SO3 + 3 NH3 ⟶ NH(SO3NH4)2
|
| NH(SO3NH4)2 + H2O ⟶ NH2SO3H +(NH4)SO4
|
| Acrylnitril | Ammonoxidation von Propen |
| Verwendung als Betriebsmittel |
| NH3
| Herstellung von Soda nach dem Ammoniak-Soda-Verfahren; Kältemittel |
| Desorption von n-Paraffinen aus Molsieben (Parex-Verfahren) |
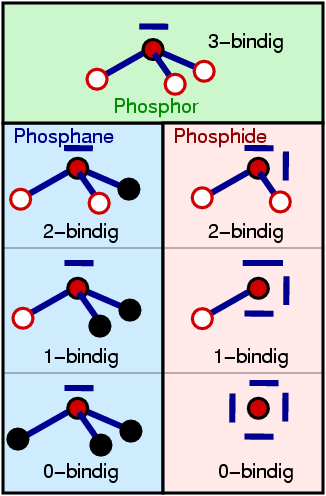
Die Bindigkeiten ergeben sich bei den Phosphiden aus der Ladung des jeweiligen
P-Atoms, bei den Phosphanen aus der Zahl der H-/R-Reste am jeweiligen P-Atom.
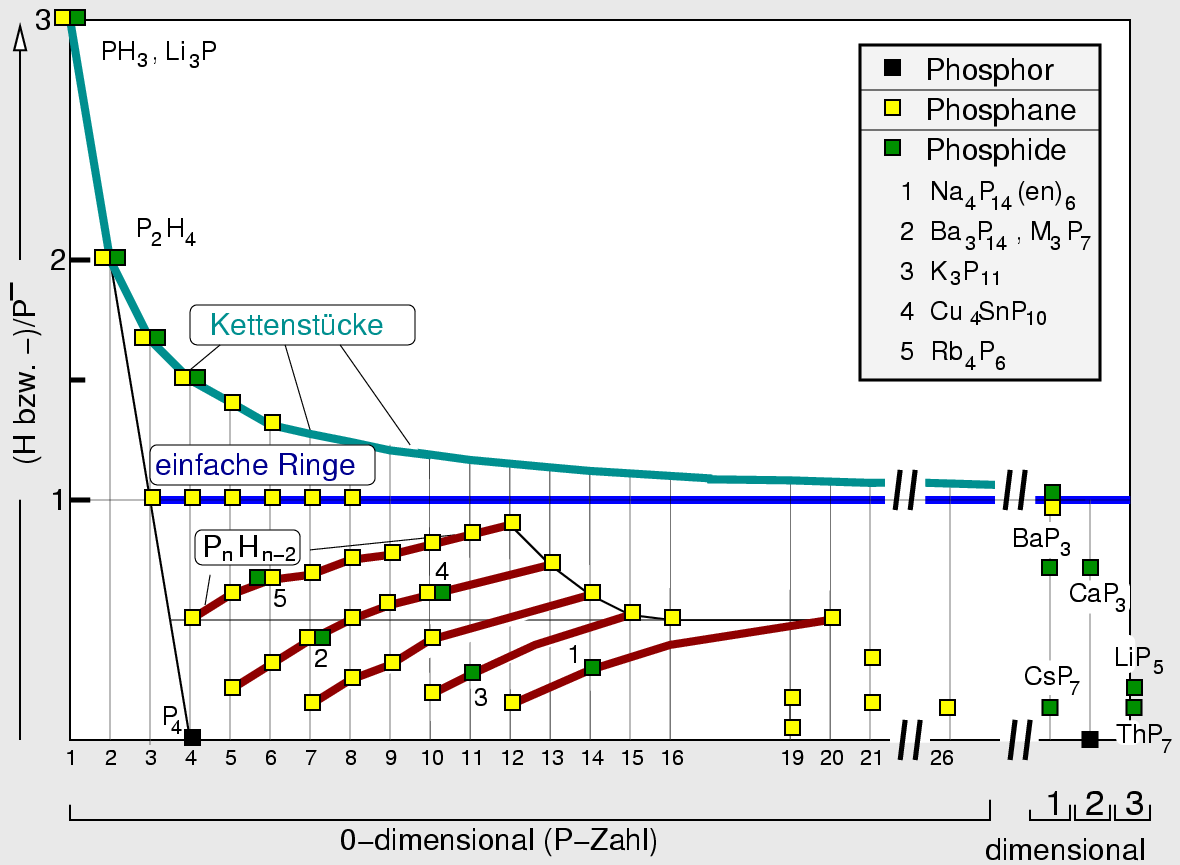
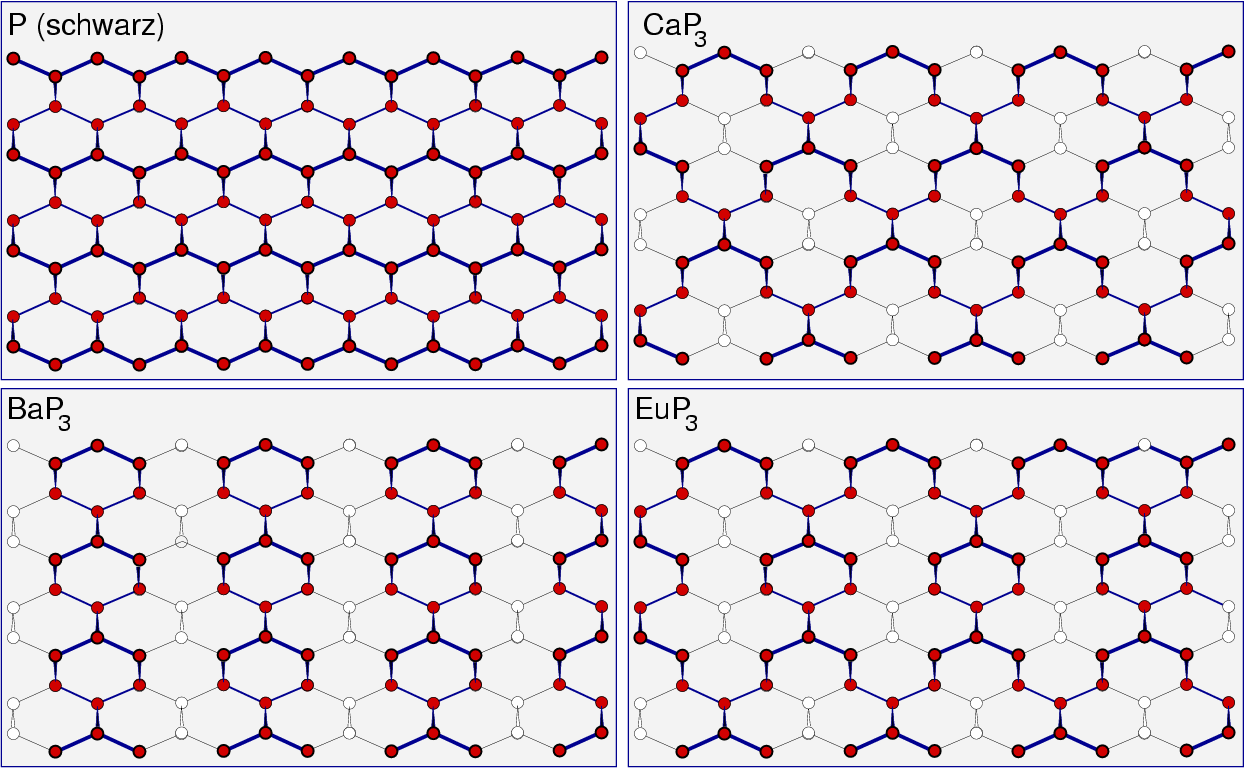
Die Dimensionalität der Phosphor-Verbände
reicht von 0-dimensional (molekular) (z.B. PH3,
H3P11 usw. bzw. isolierten Anionen in NaP3
oder Na3P11)
über 1-dimensional ausgedehnte Anionen (z.B. den Abkömmlinge des
Hittorf'schen Phosphors) bis hin zu 2-dimensional ausgedehnten Anionen, die sich meist
vom schwarzen Phosphors ableiten (z.B. BaP3).
Auch einige dreidimensionale P-Gerüststrukturen sind bekannt.
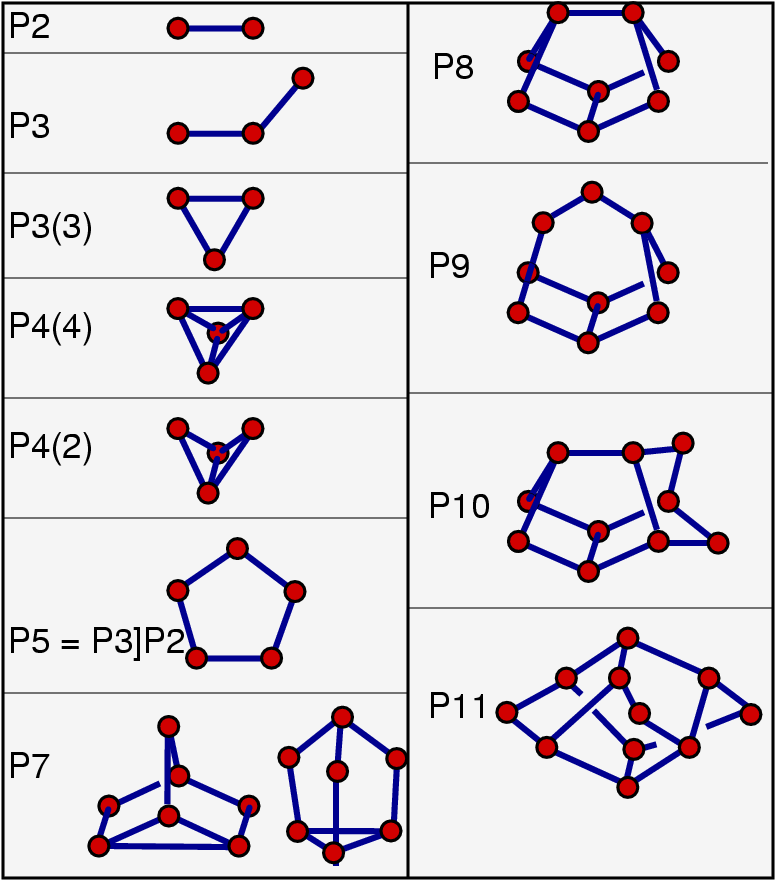
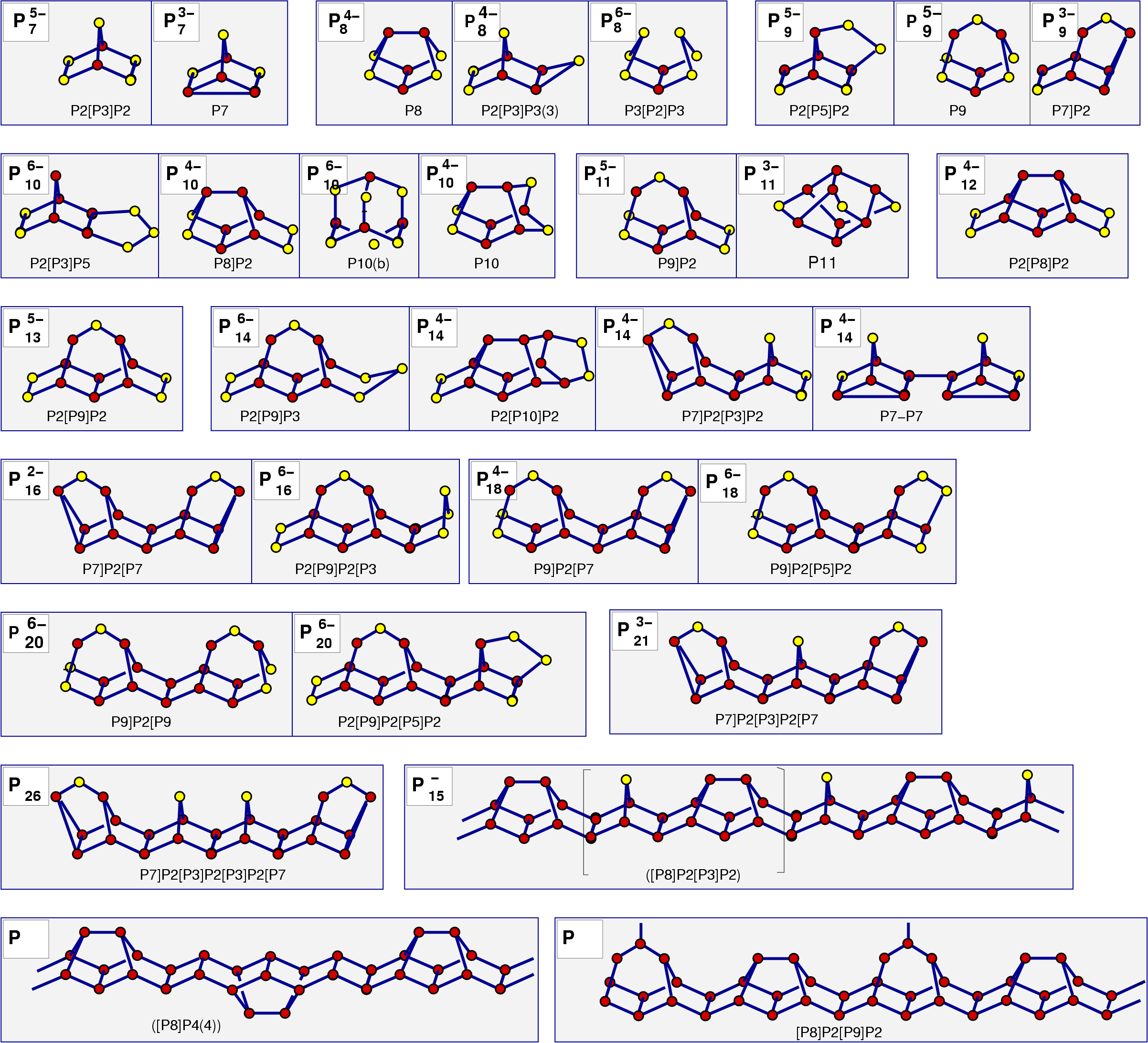
In der folgenden Übersicht sind die wichtigsten P-reichen Verbindungen
zusammengestellt. Von oben nach unten nimmt das Verhältnis
P-/P bzw. das (H oder R)/P-Verhältnis ab. Nach rechts steigt die
Dimensionalität der
Bauverbände bzw. die Zahl der jeweils beteiligten P-Atome in den
molekularen Einheiten.
Eine weitere Einteilung der Verbindungen kann wie folgt vorgenommen werden (vgl. Abb. 6.2.10.):