Vorlesung Chemie der Nichtmetalle
8. Nichtmetall der 3. Hauptgruppe: Bor
8.5. Bor-Oxide und Oxidoborate (Chalkogenide)
|
Wdh. B-O-Bindung und Vergleich mit den Nachbarelementen (nur Oberseminar)
Bor hat die Elektronen-Konfiguration s2p1 und bildet
mit den anderen Nichtmetallen vor allem Verbindungen mit Bor in der
formalen Oxidationsstufe +3. Aufgrund seines ausgeprägten Nichtmetallcharakters
treten aber (im Unterschied zu Aluminium) keine Ionenkristalle mit
echten B3+-Kationen auf. Da die Elektronegativität 2.0 ist werden
i.A. kovalente Verbindungen gebildet, wobei
wegen der kleinen Elektronenzahl Probleme bei der Oktettbildung
auftreten (s. Kapitel 8.1. dieser Vorlesung).
Vergleich der Sauerstoffverbindungen mit den Oxiden und Oxido-?-aten der Nachbarelemente:
Gemeinsamkeit mit Elementen wie Cl, P, Si oder C ist, dass sie wie Bor in der Natur meist als Oxid, d.h.
an elektronegative Nichtmetalle gebunden vorkommen und die
maximale Oxidationsstufe der Gruppennummer entspricht.
BO45-, PO43- und ClO4-
sind ebenso isoelektronisch und isostrukturell wie CO32- und BO33-.
Wie z.B. auch beim Phosphor und Silicium erfolgt
z.B. bei den Orthoanionen der maximalen Oxidationsstufe
Kondensation von der Säure zum Oxid (Anhydrid) über viele Zwischenstufen
(pH-abhängige Gleichgewichte von Protonierung und Kondensation).
Bzgl. der allgemeinen Schrägbeziehung zum Silicium s. Kapitel 8.1.
dieser Vorlesung.
Für die Sauerstoffverbindungen:
- Die Oxide neigen zur Glasbildung.
- B(OH)3 kann wie Si(OH)4 zu höhermolekularen Säuren kondensieren.
- Die Borate sind sogar noch interessanter als die Silicate,
da neben BO4-Tetraedern auch trigonal planare BO3-Baugruppen
auftreten.
Obwohl Bor und viele Bor-Verbindungen in vieler Hinsicht interessant sind (Elektronenmangel, Borane usw.)
sind Oxido-Borate die einzigen in der Natur vorkommenden Borverbindungen
und auch die praktisch und technisch einzig wichtigen Verbindungen dieses Elementes.
8.5.1. Bor-Oxide
Die Strukturchemie von Bor-Sauerstoff-Verbindungen ist sehr vielfältig, es ist eine
Vielzahl von Boraten bekannt. Wie das bekannteste Borat, der
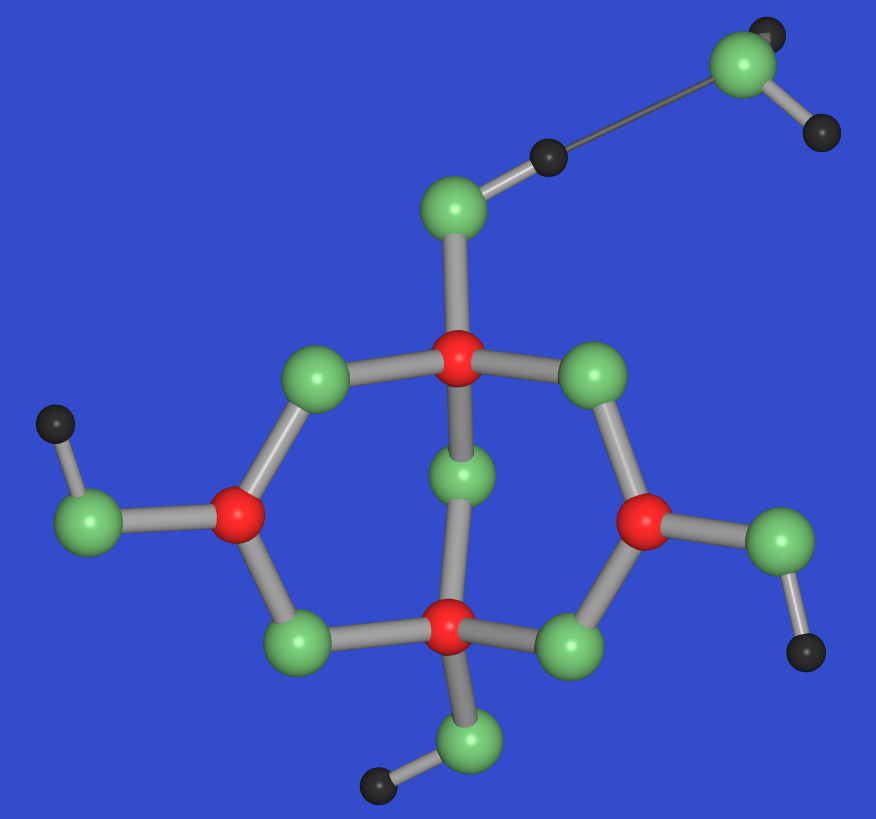
Borax Na2[B4O5(OH)4] . 8 H2O,
enthalten die Strukturen der Borate BO4-Tetraeder bzw. trigonal planare
BO3-Einheiten, häufig sogar beides nebeneinander. Die Verknüpfung dieser
Bauelemente erfolgt stets über gemeinsame Ecken.
-
Das technisch wichtigste binäre Boroxid ist die Glasmodifikation von
B2O3. Die Dichte dieser Form beträgt 1.83 g/cm3, die
Struktur besteht überwiegend aus zu sechsgliedrigen
(BO3)6-Ringen verknüpften BO4-Tetraedern.
Bor-haltige Gläser, die 30-35 % der B-Verwendung ausmachen,
sind leichter zu bearbeiten als Quarzglas und weisen einen
vergleichsweise kleinen thermischen Ausdehnungkoeffizienten auf.
Die Zusammensetzung z.B. von
Duran- oder Pyrex-Glas ist: 75 % SiO2, 8 % Al2O3,
5 % B2O3, 8 % Na2O.
Supremax-Gläser enthalten 9 % B2O3.
Die Darstellung der kristallinen Phasen von B2O3
ist nicht ganz einfach und kann durch Dehydratisierung von Metaborsäure
oder durch Abkühlen der geschmolzene Oxide bei 10-15 kbar erfolgen.
Abhängig von Druck und Temperatur kennt man zwei Modifikationen:
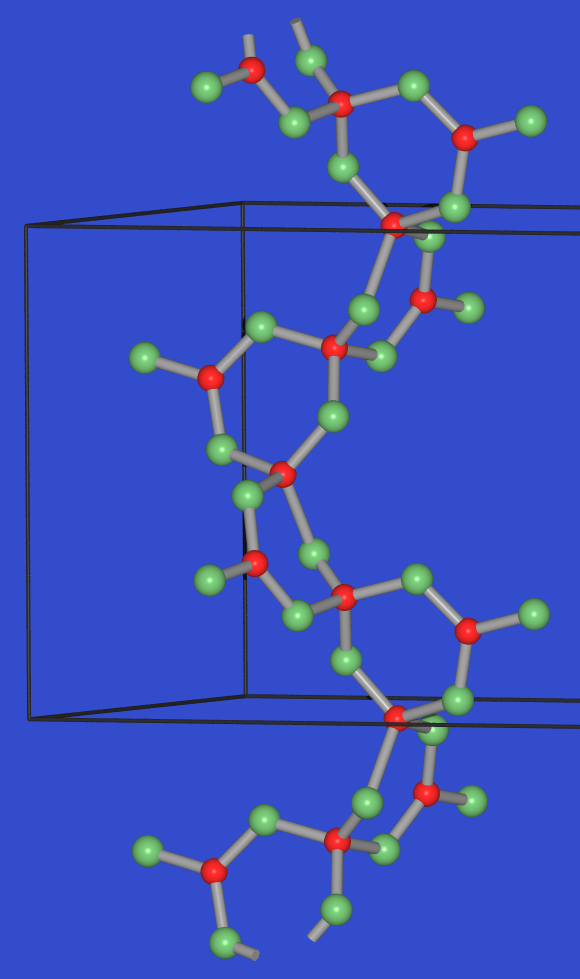
- Die Struktur der Normaldruckphase
α-B2O3 (Abb. 8.5.1.)
besteht aus einem dreidimensionalen Netzwerk von trigonal planaren
BO3-Einheiten mit B-O-Abständen von 138 pm.
Jedes Sauerstoffatom ist dabei von zwei B-Atomen, jedes B-Atom von
drei O-Atomen umgeben (Zusammensetzung BO3/2 = B2O3).
α-B2O3 schmilzt bei 450 oC,
hat eine Dichte von 2.6 g/cm3 und ist hygroskopisch.
 |
 |
8.5.1. Struktur der
Normaldruckmodifikation von B2O3
‣VRML |
8.5.2. Struktur der
Hochdruckmodifikation von B2O3
‣VRML |
- Bei 35 kbar und 525 oC wird die
ß-Form (Abb. 8.5.2.)
gebildet, die
aus einem Netzwerk aus BO4-Tetraedern besteht
(Erhöhung der Koordinationszahl von 3 auf 4 bei Druckanwendung,
Erhöhung der Dichte auf 3.1 g/cm3).
Ein O-Ligand jedes Tetraeders gehört zu zwei BO4-Tetraedern,
die restlichen drei O-Liganden zu drei BO4-Tetraedern, so daß
als Formel BO1/2O3/3 resultiert.
Neben diesen gewöhnlichen Oxiden des dreiwertigen Bors
existieren noch einige Sub-Verbindungen:
- Amorphes BO läßt sich bei 1350 oC aus B
und B2O3 herstellen. Die Struktur ist unbekannt.
- B2O entsteht ebenfalls bei der Reduktion von B2O3
mit bei Temperaturen oberhalb von 1200 oC, wenn zusätzlich
Drücke über 50 kbar angewendet werden.
B2O ist isoster zum Graphit, die B-O-Verteilung ist nicht bekannt.
- Die Struktur von B12BOB läßt sich vom
α-rhomboedrischen Bor
ableiten: In eine kubisch dichtesten Packung von B12-Ikosaedern sind in die
Oktaederlücken B-O-B-Kettenstücke eingelagert, die entlang der
Raumdiagonalen der f.c.c.-Packung (in der hexagonalen Aufstellung des
Rhomboeders entlang c) ausgerichtet sind.
8.5.2. Übersicht: Oxidoborate und Borsäuren
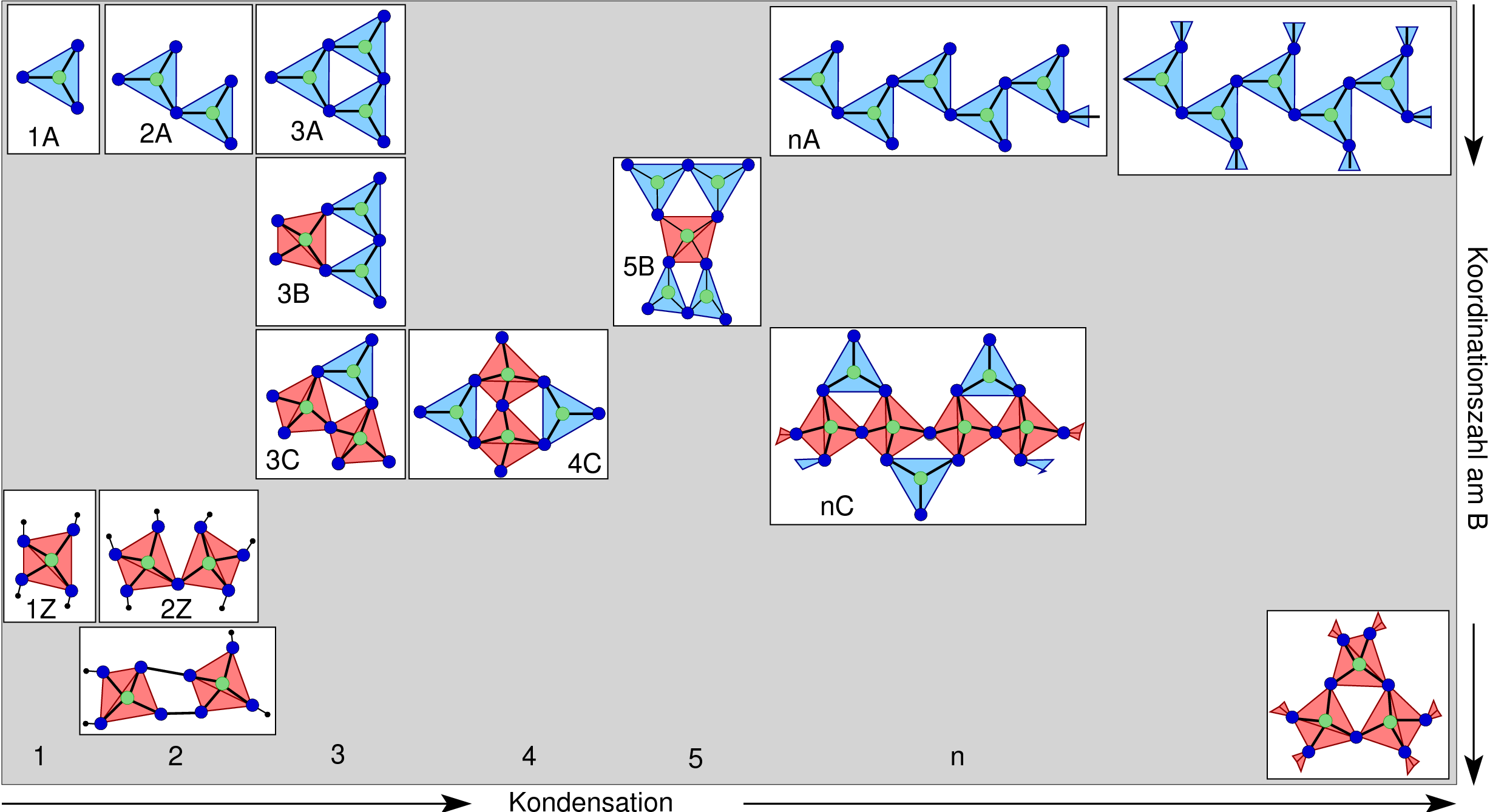 |
| 8.5.3. Borate
‣SVG |
Oxidoborate und die Borsäuren zeigen eine sehr große Strukturvielfalt.
Es gibt dabei molekulare Anionen mit ein, zwei, usw. bis fünf B-Atomen
und zusätzlich unterschiedlich stark vernetzte mehrdimensionale Verbände.
Strukturchemische Regeln für Borate sind:
- Bor ist entweder (CN 3) trigonal-planar oder/und (CN = 4) tetraedrisch von
Sauerstoff koordiniert.
- Mehrkernige Anionen entstehen - wie bei Silicaten - nur durch gemeinsame O-Ecken,
es gibt keine Kanten- oder Flächenverknüpfung.
Allerdings treten im Unterschied zu den Oxidosilicaten auch dreifach
von Bor koordinierte Sauerstoffatome auf (vgl. die Boroxide oben).
- Die wichtigsten und die natürlichen Borate sind hydratisiert.
Es gibt damit also eine ausgedehnte Chemie zwischen den freien Säuren,
den hydratisierten Salzen und den wasserfreien Boraten:
B(OH)3 ⟶ (-H2O) ⟶ hydratisierte Borate
⟶-H2O⟶ H-freie Borate
Bei dem in den Strukturen enthaltenem Wasser muss zwischen Kristall- und Strukturwasser
unterschieden werden. Als Reihenfolge der Protonierung gilt entsprechend
der Basizitäten:
- Oxid selber ist am basischsten:
O2- + H+ ⟶ OH-
Daher gibt es keine hydratisierten Borat-Oxide.
- Tetraedrisch koordinierten O-Atome werden als nächstes protoniert:
BO45- + H+ ⟶
BO3(OH)4-
- Dann folgen die trigonal-planar koordinierten O-Atome:
BO33- + H+
⟶ BO2(OH)2-
- Erst danach tritt nach:
OH- + H+ ⟶ H2O
Kristallwasser in der Struktur auf.
- Hydratisierte Gruppen können unter Wasserabspaltung kondensieren.
- Die z.T. komplexen Anionen lassen sich häufig voneinander ableiten.
8.5.3. Freie Säuren
Nach der Zusammensetzung läßt sich zunächst in die Ortho- und die Meta-Borsäure
unterschieden:
- B(OH)3, die Orthoborsäure,
kommt natürlich als Sassolin in der Toskana vor.
Sie läßt sich synthetisch durch die Hydrolyse von B-Verbindungen
erhalten und ist in Wasser gut löslich (Borwasser, Verwendung als Antiseptikum).
Es handelt sich um eine schwache, einbasige Lewis-Säure mit einem
pKS von 9.25:
B(OH)3 + H2O ⟶ H+ + B(OH)4-
Die weichen, weissen Blättchen schmelzen bei 171 oC
und bilden eine Schichtstrukur mit einem zweidimensional ausgedehnten H-Brückensystem.
In Wasser erfolgt abhängig vom pH-Wert die Bildung von verschiedenen Oligosäuren:
(bei Strukturabbildungen an allen Ecken OH!!)
- Bei pH-Werten von kleiner 4 liegen ausschließlich B(OH)3-Moleküle mit 1A-Struktur vor.
- Bei pH-Werten größer als 12 sind nur die tetraedrischen
B(OH)4--Baugruppen (1Z-Struktur) stabil.
- Bei mittleren pH-Werten zwischen 4 und 12 liegen Spezies vor, die durch partielle
Kondensation dieser beiden Spezies gebildet werden:
- [B3O3(OH)4]- (+ 1x OH, nach 3B)
- [B3O3(OH)5]2- (+ 2x OH, nach 3C)
- [B4O5(OH)4]2- (Kondensation, vgl. Borax, 4C)
- [B5O6(OH)4]- (Kondensation, vgl. Pentaborat, 5B)
- HBO2, die Metaborsäure,
entsteht durch partielle Dehydratisierung von B(OH)3 oberhalb von ca. 100 oC,
wobei abhängig von der Temperatur verschiedene Modifikationen gebildet werden:
H3BO3 ⟶130oC⟶ α-HBO2
⟶130-150oC,Tage⟶ β-HBO2
⟶150oC,Wochen⟶ γ-HBO2
⟶500oC⟶ 1/2 B2O3
8.5.4. Borate (mit/ohne H)
mit einzelnen Bauelementen
- B mit CN 3: Borate mit trigonal-planar koordiniertem Bor
sind meist nicht hydratisiert und kommen fast nur in synthetischen Verbindungen vor.
Weiter kann man unterscheiden in:
- Orthoborate mit BO33--Anionen (1A-Struktur) wie z.B. in
LnIII[BO3] oder
Mg3[BO3]2.
Auch die Turmaline, die nur ca. 10 % Bor enthalten,
gehören in diese Gruppe. Neben den Ringsilicaten liegen isolierte
BO3-Baugruppen vor:
(Na,Ca)(Li,Al)3Al6(OH)4
[BO3]3 [Si6O18].
- Pyroborate mit Dimeren B2O54--Anionen (2A-Struktur) wie
z.B. Mg2B2O5.
- Cyclische Metaborate B3O66- (3A-Struktur)
treten in NaBO2 und KBO2 auf.
- Kettenförmige Metaborate BO2- mit nA-Struktur
finden sich in der Calicumverbindung Ca(BO2)2.
- Die dreidimensionale Vernetzung (nA-Struktur)
schliesslich in B2O3 (Glas bzw. α-B2O3).
- B mit CN 4: Borate mit tetraedrisch koordiniertem Bor sind meist schon hydratisiert.
Sie kommen natürlich als Minerale vor. Auch hier kann nach weiterer Verknüpfung
unterschieden werden in:
- Isolierte BO45-- bis B(OH)4--Baugruppen
in Ta[BO4] (Zirkon-Struktur, 1Z)
und Na2[B(OH)4]Cl (1Z mit H).
- Zweikernige Anionen [(OH)3BOB(OH)3]2- (2Z)
in Mg[B2O(OH)6].
- Statt einfache O-Brücken können auch zwei O2-Brücken
vorliegen, wie z.B. im sog. Perborat-Ion
[B2(O2)2(OH)4]2-,
das z.B. in Natriumperborat: NaBO3 . 4 H2O =
Na2[B2(O2)2(OH)4] . 6 H2O
vorliegt. Na-Perborat wird als Wasch- und Bleichmittel, für die Haarbleichung
udn als Desinfektionsmittel technisch in grossen Mengen (Weltproduktion M-t) hergestellt.
- Natürlich kommen auch einige Borosilicate (Boratsilicate, Heteroborate) vor wie
z.B. CaB(OH)[SiO4]-.
- Von BPO4, das isoelektronisch zu SiO2 ist, gibt es entsprechend
alle Modifikationen von Siliciumdioxid.
- Borate mit B mit CN 3 und CN 4 nebeneinander sind am häufigsten,
was aus den pH-abhängigen Kondensationsschritten folgt.
Sie sind auch bei fast allen Borat-Mineralen anzutreffen.
Wichtige Einzelbeispiele sind:
- Borax: Na2[B4O5(OH)4].8 H2O (4C),
häufig als Na2B4O7.10 H2O geschrieben.
- Kernit: Na2[B4O6(OH)2].3 H2O (nC),
natürlich in Kalifornien, Türkei und Argentinien.
Häufig als Na2B4O7. 4 H2O geschrieben.
- Links zu den Mineralien:
Diese Anionen wiederum kommen auch kondensiert vor bzw.
kondensieren unter Wasserabspaltung, wie die beiden Formen des
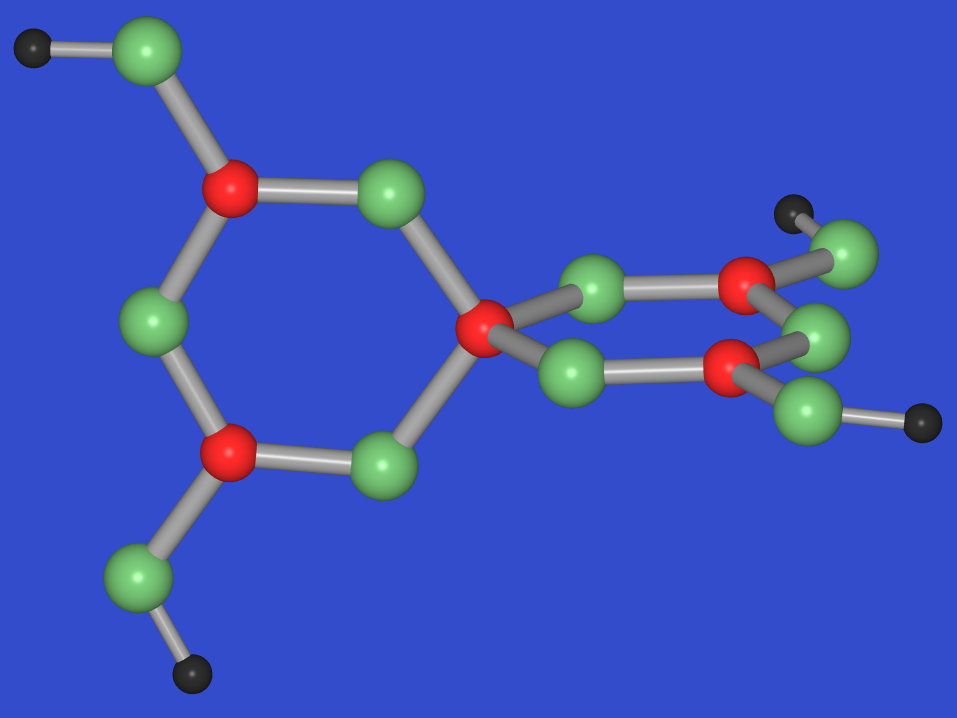
K-Pentaborats (Grundeinheit 5B) zeigen:
- KB5O8 . 4 H2O =
K[B5O6(OH)4] . 2 H2O (isolierte Anionen, s. Santit
in Abb. 8.5.5.)
- KB5O8: hochkomplexes Raumnetz, durch Kondensation
der 5B-Baugruppe entstanden (s. gelbe Bindungen).
Vorlage 8.2.