
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle8. Nichtmetall der 3. Hauptgruppe: Bor8.1. Element |
 |
| Abb. 8.1.1. Elementares Bor |
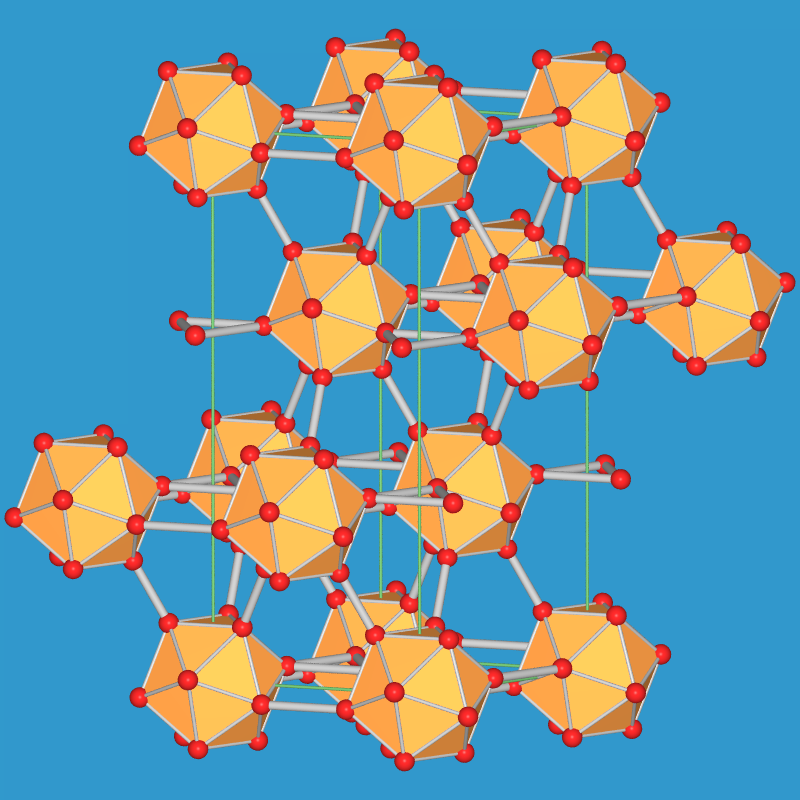 α-rhomboedrisches Bor besteht aus einer kubisch dichtesten Kugelpackung
kovalent verknüpfer Ikosaeder. Die Wadeschen Regeln lassen sich hier wie folgt
anwenden: In der Schicht (111) ist jedes Ikosaeder mit sechs weiteren
Nachbarikosaedern über Dreizentrenbindungen verknüpft. Zwischen den Schichten
bestehen nochmals sechs weitere 'normale' B-B-Bindungen zur nächsten Schicht.
Die Elektronenbilanz nach Wade ist damit:
In der primitiven Aufstellung der rhomboedrischen Elementarzelle befindet sich
genau ein Ikosaeder in der Zelle, d.h. es stehen 36 Elektronen (12 * 3) zur
Verfügung. Für dieses sind nach Wade N+1, d.h. 13 Elektonenpaare bzw.
26 Elektronen erforderlich, so daß 10 Elektronen für 'Exo' Bonds zur
Verfügung stehen. Jedes Ikosaeder ist an sechs der zwölf Ecken über
normale 2-Zentrenbindungen verknüpft. Hierfür werden damit 12/2, d.h. 6
Elektronen benötigt. Die restlichen verbleibenden vier Elektronen bilden die
Verknüpfung der Ikosaeder an sechs Ecken über die 3-Zentrenbindungen:
Jede 3-Zentrenbindung gehört zu drei Ikosaedern, d.h. je 2/3
der Elektronen pro beteiligtem B-Atom, hierfür reichen also die 2/3 * 6 = 4
Elektronen! (q.e.d.)
Entsprechende Rechnungen gelten für fast alle Boride, sie sind aber z.T. sehr kompliziert.
Ein weiteres einfaches Beispiel ist die Struktur von CaB6, das ebenfalls
elektronenpräzise nach Wade ist.
α-rhomboedrisches Bor besteht aus einer kubisch dichtesten Kugelpackung
kovalent verknüpfer Ikosaeder. Die Wadeschen Regeln lassen sich hier wie folgt
anwenden: In der Schicht (111) ist jedes Ikosaeder mit sechs weiteren
Nachbarikosaedern über Dreizentrenbindungen verknüpft. Zwischen den Schichten
bestehen nochmals sechs weitere 'normale' B-B-Bindungen zur nächsten Schicht.
Die Elektronenbilanz nach Wade ist damit:
In der primitiven Aufstellung der rhomboedrischen Elementarzelle befindet sich
genau ein Ikosaeder in der Zelle, d.h. es stehen 36 Elektronen (12 * 3) zur
Verfügung. Für dieses sind nach Wade N+1, d.h. 13 Elektonenpaare bzw.
26 Elektronen erforderlich, so daß 10 Elektronen für 'Exo' Bonds zur
Verfügung stehen. Jedes Ikosaeder ist an sechs der zwölf Ecken über
normale 2-Zentrenbindungen verknüpft. Hierfür werden damit 12/2, d.h. 6
Elektronen benötigt. Die restlichen verbleibenden vier Elektronen bilden die
Verknüpfung der Ikosaeder an sechs Ecken über die 3-Zentrenbindungen:
Jede 3-Zentrenbindung gehört zu drei Ikosaedern, d.h. je 2/3
der Elektronen pro beteiligtem B-Atom, hierfür reichen also die 2/3 * 6 = 4
Elektronen! (q.e.d.)
Entsprechende Rechnungen gelten für fast alle Boride, sie sind aber z.T. sehr kompliziert.
Ein weiteres einfaches Beispiel ist die Struktur von CaB6, das ebenfalls
elektronenpräzise nach Wade ist.
 |
 |
 |
 |
 |
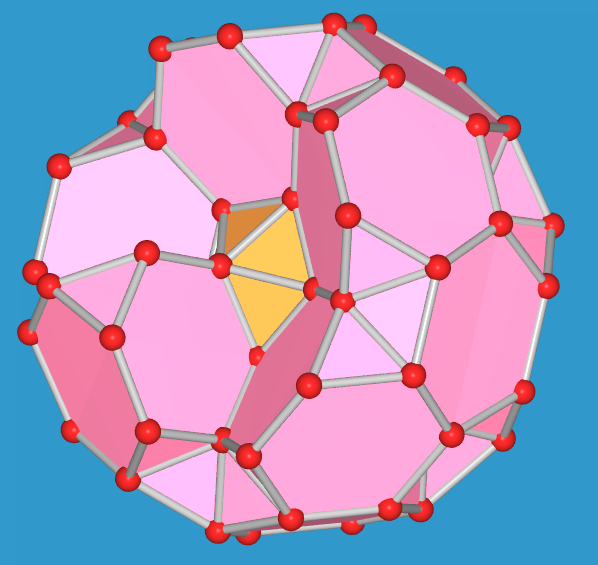 |
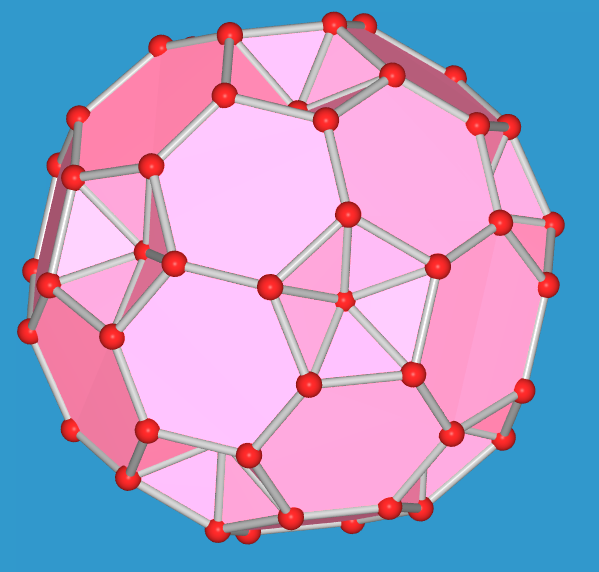
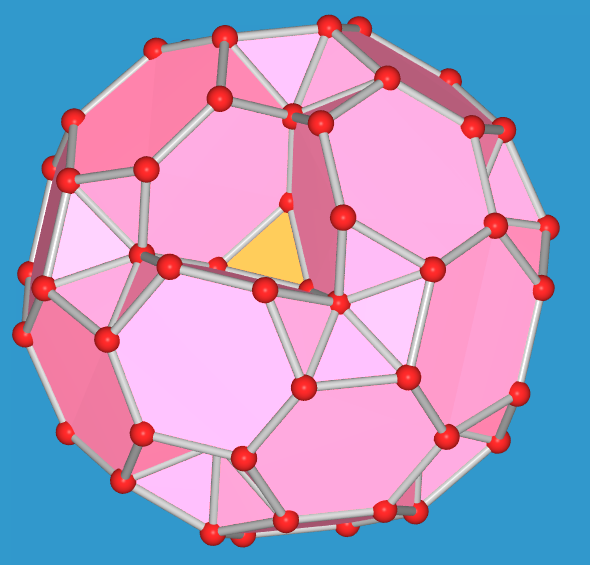
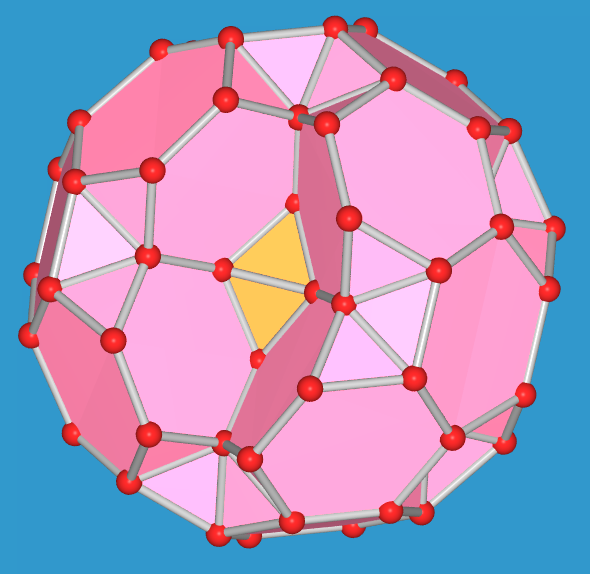
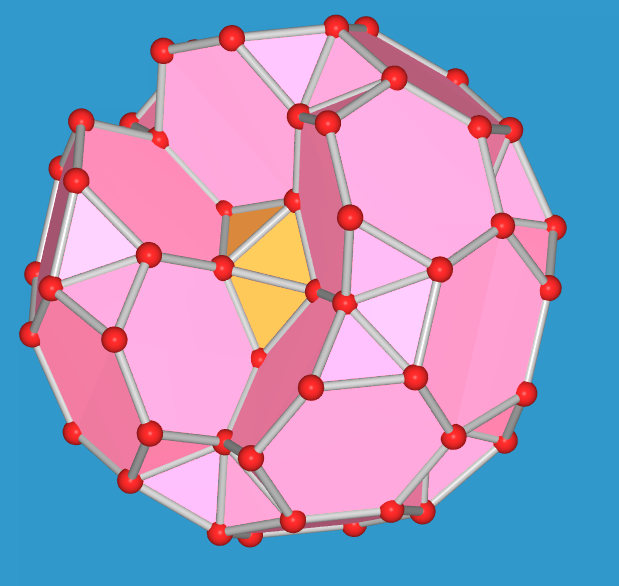
| Komplettes Polyeder | - 1 gekapptes Tetraeder | - 2 gekappte Tetraeder | - 3 gekappte Tetraeder | - 4 gekappte Tetraeder | - 5 gekappte Tetraeder |
 |
| Abb. 8.1.3. Kristallstruktur von α-tetragonalem Bor. ‣VRML |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |