| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
In der Vorlesung wird der Abschnitt bis zu den Ionenradien in dieser Präsentation wiederholt (Grundkenntnisse AAC und PC).
| Verbindung | LiF | MgO | FeO | OsO4 |
| Ionencharakter nach Pauling | 0.9 | 0.73 | 0.52 | 0.35 |
Qualitative Betrachtung: Ionische Verbindungen (Salze) werden durch elektrostatische Kräfte zusammengehalten; die Anionen sind von Kationen umgeben und umgekehrt. Eine große elektrostatische Anziehung, d.h. eine große Gitterenergie, wird dabei durch hohe Koordinationszahlen erreicht. Kontakte der Anionen bzw. Kationen untereinander sollten minimal, Kontakte zwischen Anionen und Kationen maximal sein. Gleichzeitg muß lokale elektrostatische Neutralität erreicht sein.
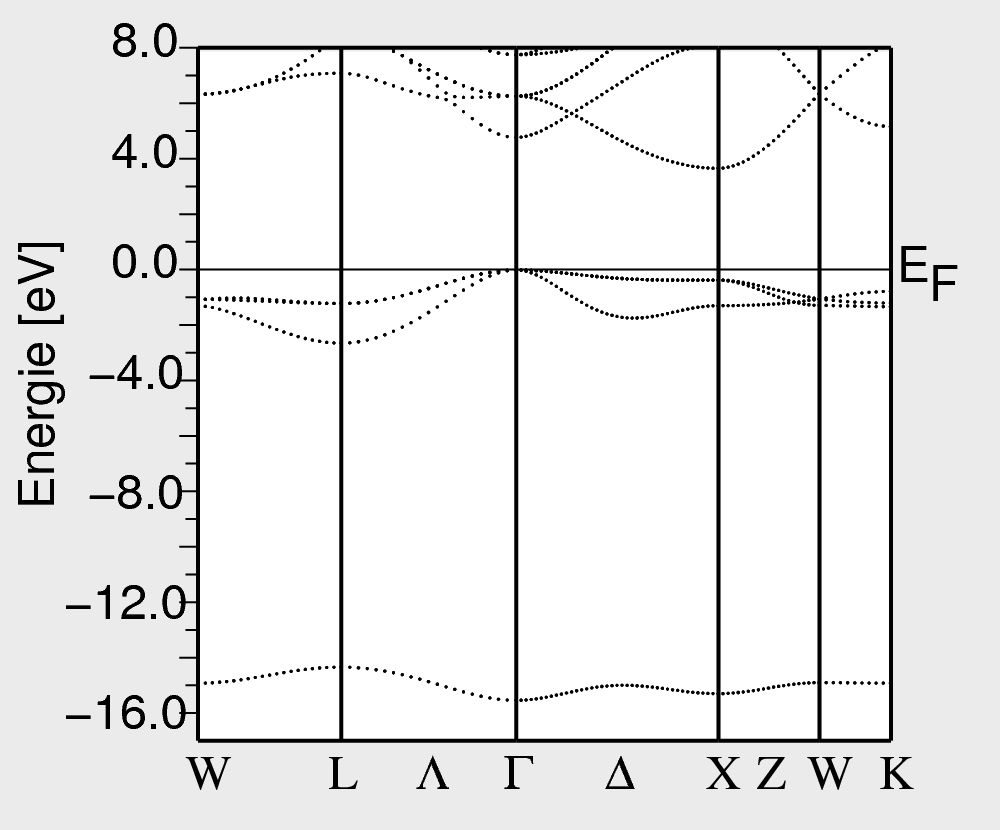
Die elektronischen Strukturen (Zustandsdichten und Bandstrukturen) sind einfach: Alle Bänder sind schmal, das Valenzband besteht aus praktisch atomaren (besetzen) Anionenzuständen, das energetisch weit entfernte Leitungsband aus ebenfalls atomaren (leeren) Kationenzuständen. In Abbildung 4.1.1. ist als Beispiel die Bandstruktur von CaO abgebildet (-15 eV: O-s; VB: O-p; +4 eV: Ca).
 |
| Abb. 4.1.1. Berechnete Bandstruktur von CaO ‣SVG |
| Strukturtyp | NaCl | Rutil | Anatas | Fluorit |
| Madelungkonstante A | 1.76 | 2.408 | 2.400 | 2.519 |
UL kann experimentell z.B.
auf der Basis des Born-Haber-Kreisprozeßes bestimmt werden.
Danach ist die treibende Kraft für die Bildung eines Ionenkristalls
(d.h. die Bildungsenthalpie) zusammengesetzt aus:
| Verbindung | NaCl | MgO | BaO |
| Gitterenergie UL [kJ/mol] | -760 | -4000 | -3200 |
| Schmelzpunkt [oC] | 800 | 2800 | 1900 |
Man sieht aus Tabelle 4.1.3, dass die Schmelzpunkte etwa parallel mit der Gitterenergie variieren.
Zur Abschätzung der Größe der Kationen und Anionen gibt es die allgemein weit genutzen Shannon-Radien. Abb. 4.1.5 zeigt die wichtigsten Kationenradien. Anionen: Referenz: Oxid: 140 pm.
 |
| Abb. 4.1.2. Kationenradien nach Shannon ‣SVG |
Die qualitative Folgerung für die Maximierung der Gitterenergie ist also, dass die Kationen von möglichst vielen Anionen umgeben sein sollten (und umgekehrt) und Kationen und Anionen 'zueinander passen' sollen. Entscheidend für alle weiteren Überlegungen ist, dass die Anionenradien fast immer erheblich größer sind als die Kationenradien.
In der Strukturchemie von Ionenkristallen gibt es hierzu einige empirische Regeln, die sogenannten Pauling-Regeln. Solange wirklich reine Ionenkristalle vorliegen, gelten diese Regeln erstaunlich gut. Sie versagen jedoch, sobald die Ionen von der Kugelform abweichen oder Anteile anderer Bindungstypen (kovalent, metallisch) hinzukommen.
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |