 |
| Abb. 4.2.1. Radienverhätnisregel am Beispiel der Oxide ‣ SVG |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
Die qualitative Folgerung für die Maximierung der Gitterenergie ist, dass die Kationen von möglichst vielen Anionen umgeben sein sollten (und umgekehrt) und Kationen und Anionen 'zueinander passen' sollen. In der Strukturchemie von Ionenkristallen gelten hierzu die empirischen Pauling-Regeln, die vereinfacht die Minimierung der potentiellen Energie wiedergeben:
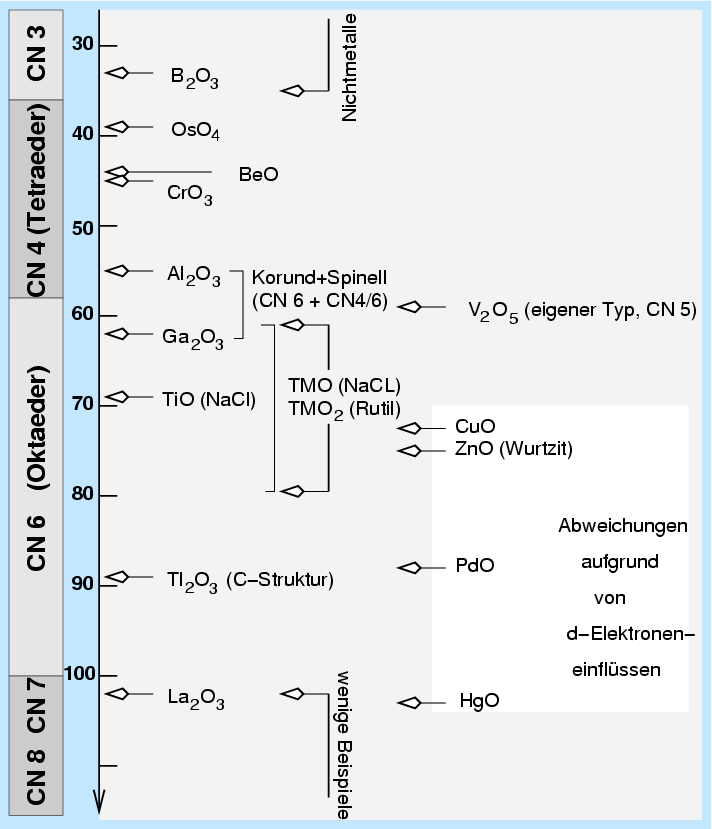
| Um jedes Kation wird ein Koordinationspolyeder gebildet. Der Abstand zwischen Kation und Anion ist durch die Summe der Ionenradien bestimmt, die Koordinationszahl dagegen vom Radienverhältnis. |
Genauer:
Nach Einführung von Polyedern um die Kationen
(Festlegung der Koordinationszahl) und bei Zuordnung von Ionenradien zu den
einzelnen Teilchen, wird die Koordinationszahl (CN) vom Radienverhältnis,
die Atomabstände vom Wert der Ionenradien bestimmt.
Demnach bestimmt also das Radienverhältnis wesentlich die Koordinationszahl
und damit auch den möglichen Strukturtyp.
Konkret sind die Koordinationszahlen der Kationen
in Oxiden (rein geometrische Betrachtung, Ligandenfelder vernachlässigt, Radius von
O2- = 140 pm) in Tabelle 4.2.1. mit aufgeführt.
| CN=4 (Tetraeder) | CN=6 (Oktaeder) | CN=8 (Würfel) | |
| Radienverhältnis (untere Grenze) | 0.225 | 0.414 | 0.732 |
| Kationenradius in Oxiden [pm] | 36 | 58 | 102 |
| Zusammensetzung | Strukturtypen | ||
| A2B | anti-CaF2 | - | - |
| AB | ZnS (Zinkblende, Wurtzit) | NaCl | CsCl |
| AB2 | SiO2 | Rutil, CdCl2, CdI2 | CaF2 |
Beispiele:
Bekanntestes Beispiel ist die Strukturtypenfolge (ZnS, NaCl, CsCl)
(s. z.B. Chemie der Metalle in Kap. 2.3.)
bei einfachen Salzen.
Bei Silicaten ergibt sich aufgrund der Ionenradien von Si4+ und O2-
unmittelbar die Koordinationszahl 4 für Silicium gegen Sauerstoff.
Die Werte für andere Kationen entsprechen den in der Tabelle 4.2.1. angegebenen.
Sind in einer Verbindung unterschiedliche Kationen vorhanden, dann
können eventuell nicht alle ideale Verhältnisse finden. In diesem Fall
weichen die Kationen mit der geringsten Ladung und dem größten Radius auf andere
Koordinationszahlen aus. Beispielsweise liegt Natrium im Sodalith
Na8[Si6Al6O24]Cl2
nicht wie sonst mit der Koordinationszahl 6, sondern nur mit einer
Koordinationszahl von 4 vor, während Si (höhere Ladung!) in CN 4
verbleibt.
 |
| Abb. 4.2.1. Radienverhätnisregel am Beispiel der Oxide ‣ SVG |
Bei Hauptgruppenmetall-Salzen mit Kationen der (maximalen Oxidationsstufe-2) (z.B. Sn2+, Pb2+) kommt es zu einer Verzerrung der Metall-Sauerstoff-Koordination durch das einsame Elektronenpaar. Z.B. sind im Pb2+-Oxid die 6 s2-Elektronen 'stereochemisch aktiv' (sd-Hybrid), so dass PbO und und auch SnO eine tetragonal verzerrte CsCl-Struktur ausbilden. Auch die Struktur der gemischtvalenten Verbindung Mennige, Pb3O4, ist ein schönes Beispiel für die stereochemische Aktivität des 'nichtbindenden Lone-Pairs' (statische Bilder s.a. Metall-Vorlesung Kap. 5.4.).
zu 2: Ligandenfeldeinfluß
In die Gitterenergie UL gehen bei Übergangsmetallionen mit
unvollständig gefüllten d-Elektronenschalen neben den elektrostatischen
Anteilen Ec und Er und kovalente Bindungsanteile, van der Waals Anteilen usw. auch
Ligandenfeldstabilisierungsenergien (LFSE, Es) ein. Die Gitterenergie ist damit in
diesen Fällen entsprechend größer.
Der Einfluß der d-Elektronen auf das Koordinationspolyeder um
Übergangsmetall-Kationen ist aus der Komplexchemie (mit Video dazu!) bekannt:
aus der Ligandenfeld-Theorie folgt, dass die Ligandenfeldstabilisierungsenergie (LFSE)
bestimmt, welches Ion welche Koordination (hier gegen den Liganden
O2-) bevorzugt.
Während sich in den isolierten Kationen alle d-Orbitale auf dem gleichen
energetischen Niveau befinden, wird
bei der LF-Theorie der Einfluß
der Liganden (die zunächst als Punktladungen betrachtet werden)
auf die Energieniveaus der verschiedenen d-Orbitale
betrachtet. Beispielsweise geben sich im oktaedrischen und im tetraedrischen
Ligandenfeld Aufspaltungen der d-Orbitale in zwei Gruppen:
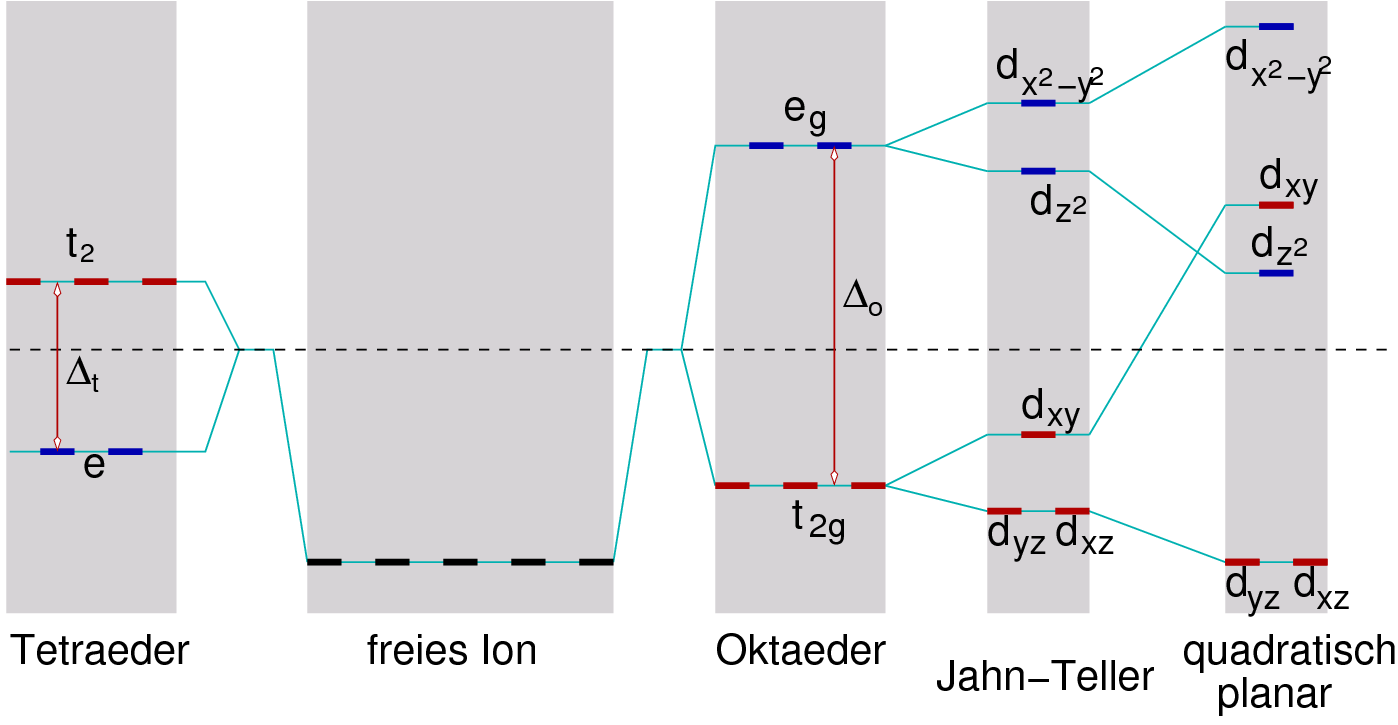 |
| Abb. 4.2.2. Ligandenfeldaufspaltungen ‣ SVG |
| Elektronenkonfiguration | Oktaeder- | Tetraeder- | ||
| Ion | Stabilisierung | Stabilisierung | Differenz | |
| d3 | Cr3+ | 225 | 67 | 158 |
| d5 | Fe3+ | 0 | 0 | 0 |
| d6 | Fe2+ | 50 | 33 | 17 |
| d8 | Ni2+ | 122 | 36 | 86 |
| d10 | Zn2+ | 0 | 0 | 0 |
Dieser Einfluß der d-Elektronenverteilung macht sich z.B. bei den verschiedenen Übergangsmetall-Oxiden unmittelbar bemerkbar:
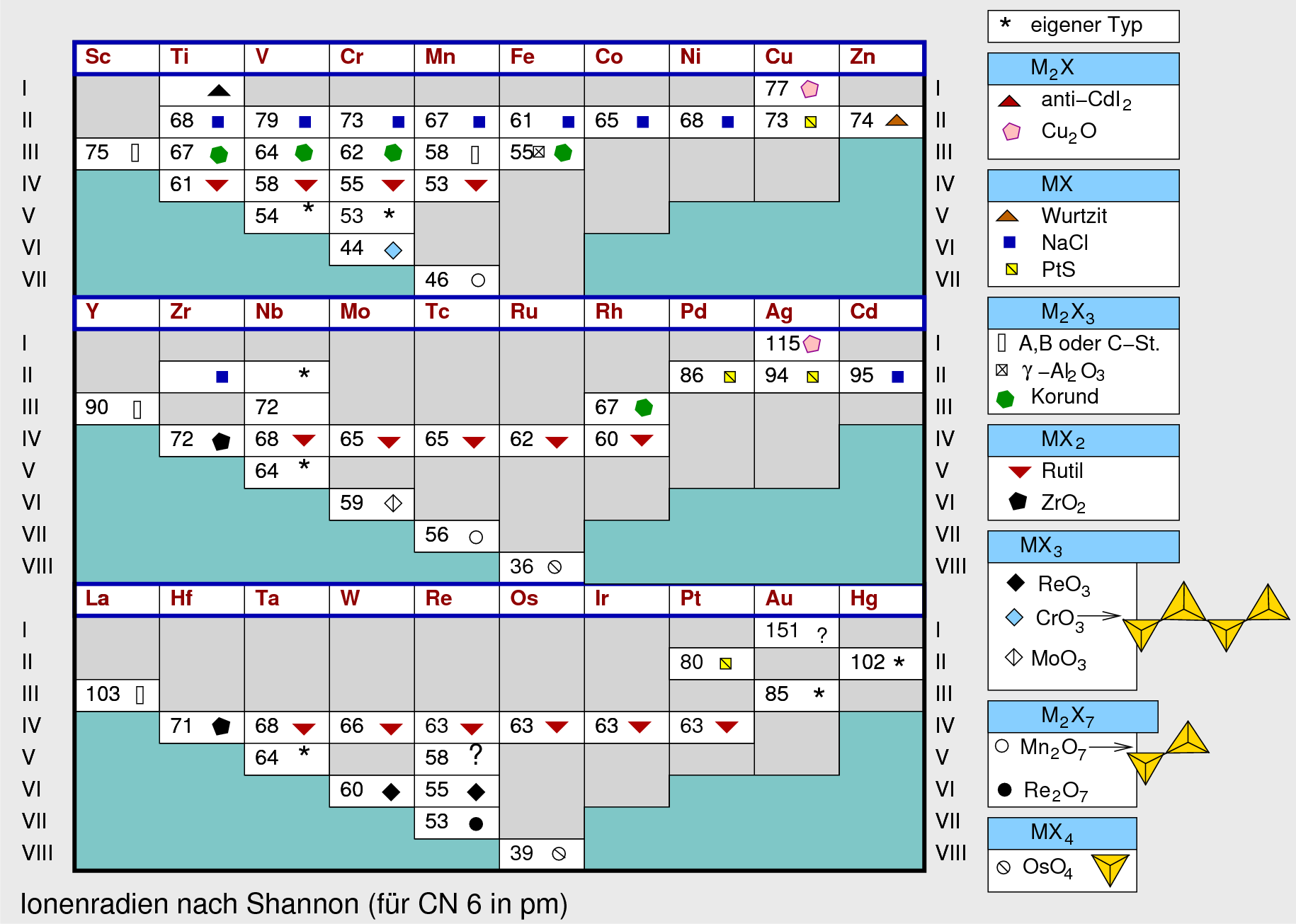 |
| Abb. 4.2.3. Strukturen der Übergangsmetalloxide ‣ SVG |
zu 3: Metall-Metall-Bindungen
Sobald in Ionenkristallen Metall-Metall-Bindungen auftreten, kommt es zu ungewöhnlichen Strukturen. Das beginnt zunächst mit einer Flächenverknüpfung der Polyeder (z.B. in den Trihalogeniden mit ZrI3-Struktur) und geht bis hin zur Bildung von Clustern. Typische Beispiele sind hier NbO, Wolfram-Halogenide ( WCl3 = W6Cl18) oder Chevrell-Phasen. Diese Effekte treten vor allem bei den frühen 4d- und 5d-Übergangsmetall-Ionen auf, die weit ausgedehnte d-Orbitale zeigen (Zr3+, W3+, Nb2+ usw.).
| Die Valenz eines Anions in einer stabilen ionischen Struktur versucht die Stärke der elektrostatischen Bindungen der umgebenden Kationen zu kompensieren (und umgekehrt). |
Für jedes Kation i mit der Ladung Z und der Koordinationszahl CNK wird die 'elektrostatische Bindungsstärke' Si angegeben:
Ein stabiles Ionengitter liegt dann vor, wenn die Ladung X der Anionen der Summe der Bindungsstärken der dieses Anion koordinierenden Kationen entspricht, also gilt:
wobei die Summation über die i Kationen um das jeweilige Anion erfolgt.
Beispiele:
| Teilung von Kanten und besonders von Flächen zwischen Koordinationspolyedern reduziert die Stabilität einer Struktur. Dieser Effekt ist besonders ausgeprägt für Kationen hoher Valenz und geringer Koordinationszahl. |
Bei Salzen mit mehreren Kationen werden diejenigen mit hoher Ladung möglichst weit voneinander weg eingebaut, so dass eine möglichst gute Abschirmung der Kationen voneinander möglich wird. D.h., dass die Kationen-Koordinationspolyeder möglichst wenige Polyederelemente gemeinsam haben sollten.
Beispiele
| In einer Struktur mit mehreren Kationen weichen Kationen mit hohen Ladungen einem Teilen von Bauelementen aus. |
Die Konsequenz z.B. für Alumosilicate ist die sogenannte Löwenstein-Regel, nach der niemals zwei Aluminium-Atome nebeneinander in den Tetraederverband eingebaut sind.
| Die Zahl verschiedener Bauelemente in einer Kristallstruktur ist klein. |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |