|
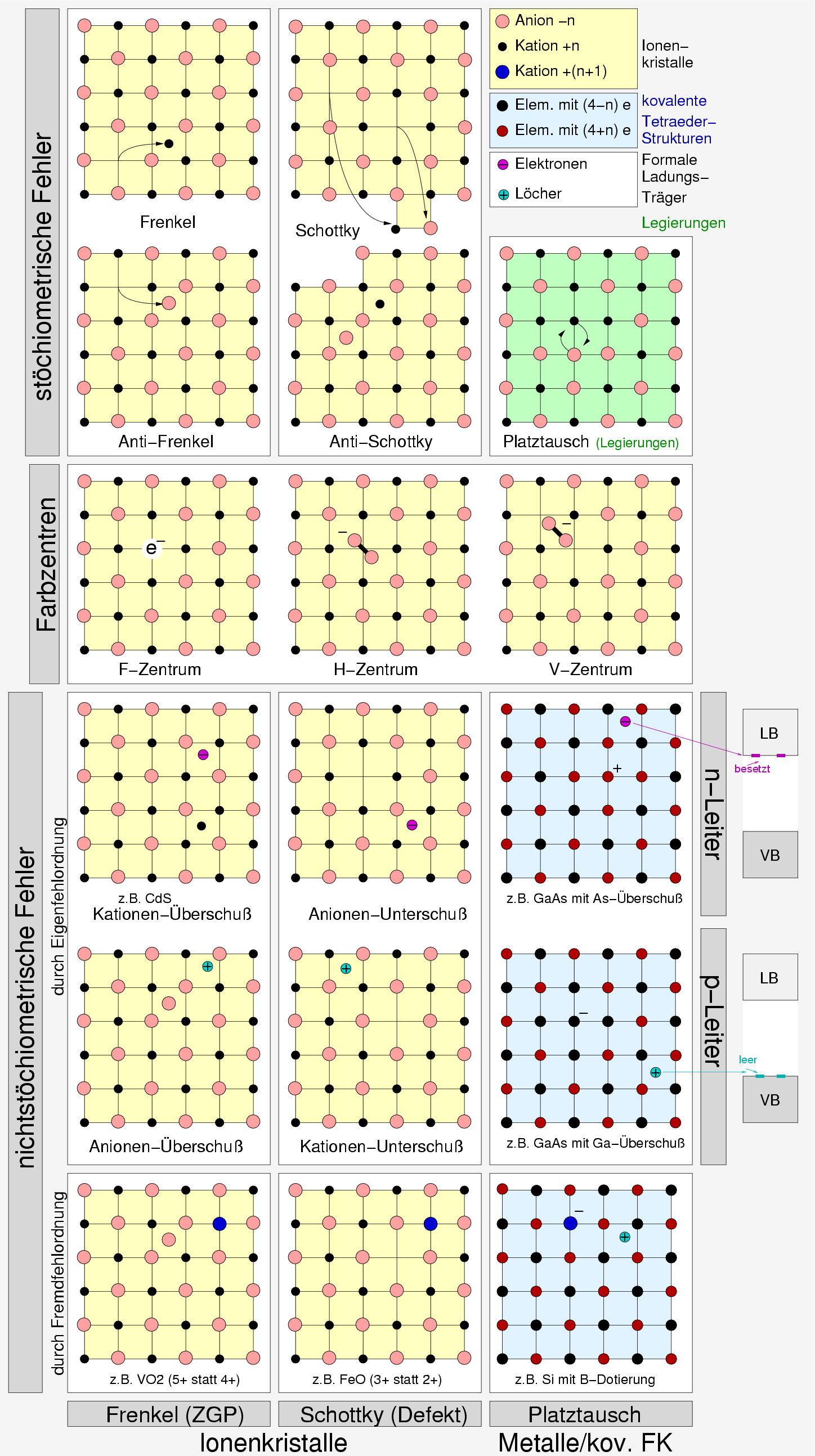
| Abb. 1.2.1. Übersicht über Punktdefekte ‣ SVG |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| Fehlstelle | Bezeichnung |
|---|---|
| Nichtmetallfehlstelle auf Nichtmetallplatz | VX |
| Metallfehlstelle auf Metallplatz | VM |
| Zwischengitternichtmetallatom | Xi |
| Zwischengittermetallatom | Mi |
| Fremdatom Y (Nichtmetall) auf Nichtmetallplatz | YX |
| Fremdatom A (Metall) auf Metallplatz | AM |
| neutrale Fehlstelle | VXx bzw. VMx |
| positiv geladene Nichtmetallfehlstelle | VX. |
| negativ geladene Metallfehlstelle | VM, |
| geladenes Zwischengittermetallatom | Mi. bzw. Mi, |
| geladenes Zwischengitternichtmetallatom | Xi, bzw. Xi. |
| freie Elektronen | e, |
| freie Löcher | h. |

|
| Abb. 1.2.1. Übersicht über Punktdefekte ‣ SVG |
| Verbindung | Strukturtyp | Fehlordnungstyp |
|---|---|---|
| AgCl, AgBr | NaCl | Kationen-Frenkel |
| Erdalkalimetallfluoride, CeO2, ThO2 | CaF2 | Anionen-Frenkel |
| Alkalimetallhalogenide (ohne Cs) | NaCl | Schottky |
| Erdalkalimetalloxide | NaCl | Schottky |
| Cs-Halogenide, TlCl | CsCl | Schottky |
| BeO | ZnS (Wurtzit) | Schottky |
|
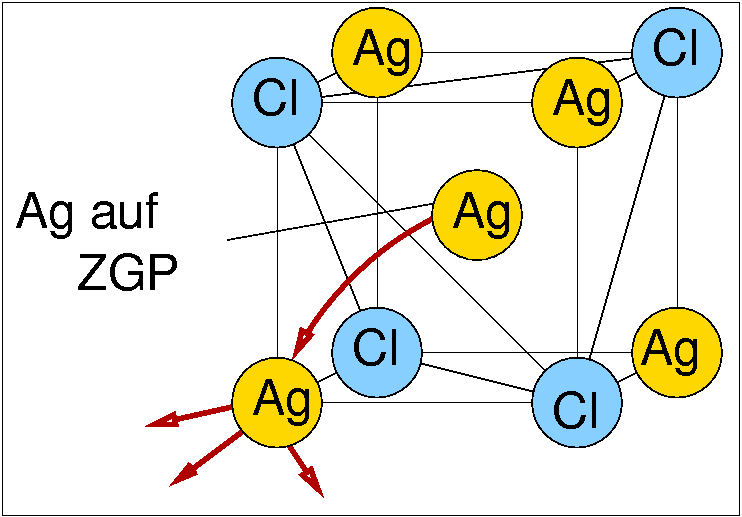
| Abb. 1.2.1.3. Mechanismus der Ionenleitung in AgCl ‣ SVG |
|
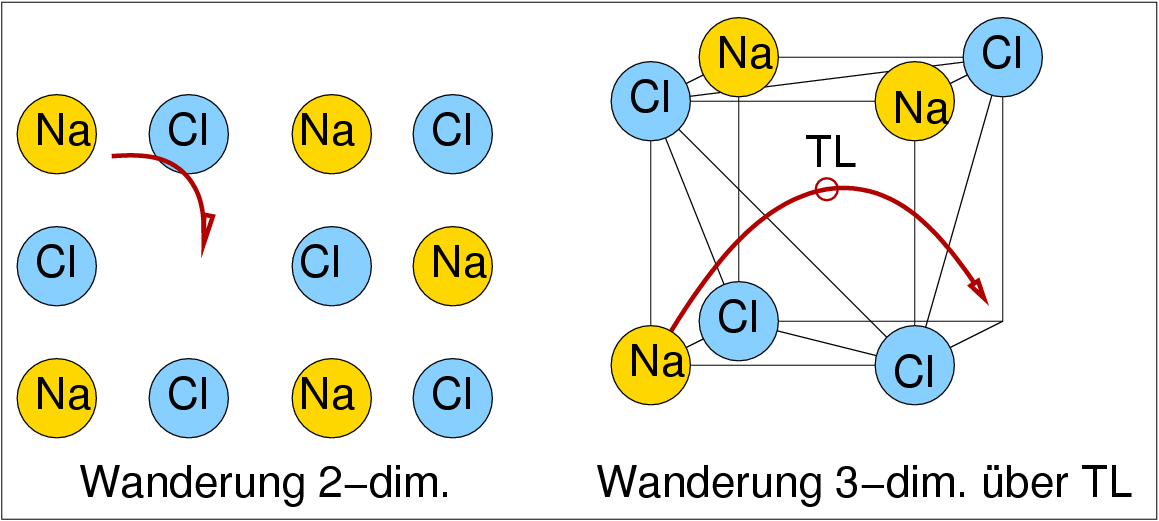
| Abb. 1.2.1.XX. Mechanismus der Ionenleitung in NaCl ‣ SVG |
Vorlagen
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |