|

|
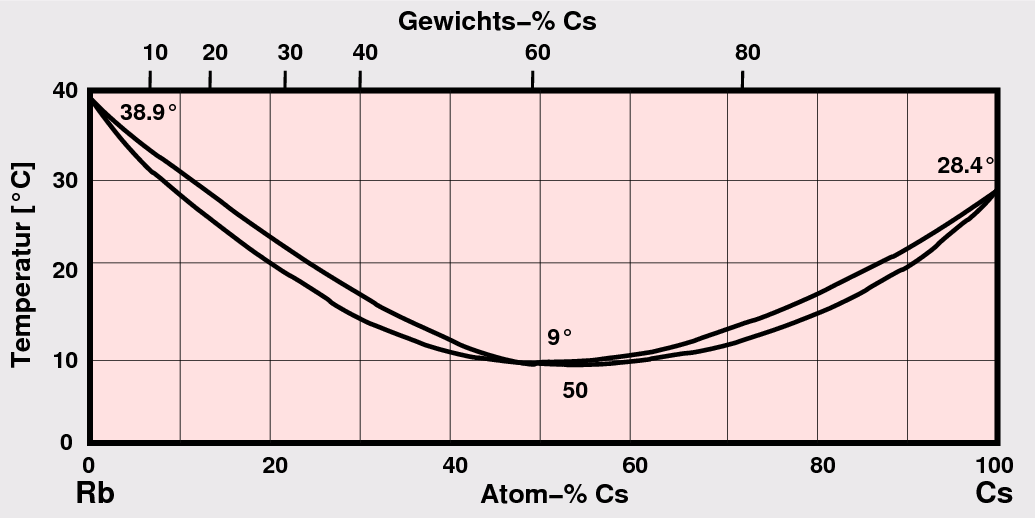
| Rb - Cs ‣SVG | Cu - Au ‣SVG |
| Abb. 3.2.1. Phasendiagramme mit kompletter Löslichkeit bzw. Überstrukturbildung bei tiefen Temperaturen | |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Festkörperchemie | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Lit. | ⇨ |

|

|
| Rb - Cs ‣SVG | Cu - Au ‣SVG |
| Abb. 3.2.1. Phasendiagramme mit kompletter Löslichkeit bzw. Überstrukturbildung bei tiefen Temperaturen | |
Sehr häufig ist auch der Fall, dass die Löslichkeit im festen Zustand nur in einem kleineren Zusammensetzungsbereich vorliegt (z.B. als Randlöslichkeit oder bei Phasenbreiten im System). Hierfür seien als Beispiel die Randphasen des Cu-Zn-Systems: Cu-Zn mit einem Zn-Gehalt von 0 bis 38.4 % und Zn-Cu mit einem Cu-Gehalt von 0 bis 2.3 % genannt.
Wenn die Bedingungen für feste Lösung nur wenig verletzt sind, z.B. beim Vorliegen von
Radiendifferenz von ca. 15-20 %, beobachtet man feste Lösungen nur bei höherer Temperatur,
bei niedrigerer Temperatur kommt es zur Bildung von Überstrukturen , die als
Ordnungsvarianten einfacher Strukturtypen angesehen werden können.
Ein Beispiel für ein Phasendiagramm eines solchen Systems gibt die Abbildung 3.2.1. rechts.
Im System Cu-Au bilden sich bei den Zusammensetzungen CuAu und Cu3Au Überstrukturen aus.
Die Strukturchemie der geordneten Legierungen
läßt sich unmittelbar an die der einfachen Metallpackungen anschließen.
Als Prinzip der Ausordnung läßt sich feststellen, dass
die Minimalkomponente möglichst nur von der Maximalkomponente koordiniert
wird.
Im folgenden werden die wichtigsten Überstrukturen der kubisch-innenzentrierten und der dichtesten Kugelpackungen getrennt behandelt:
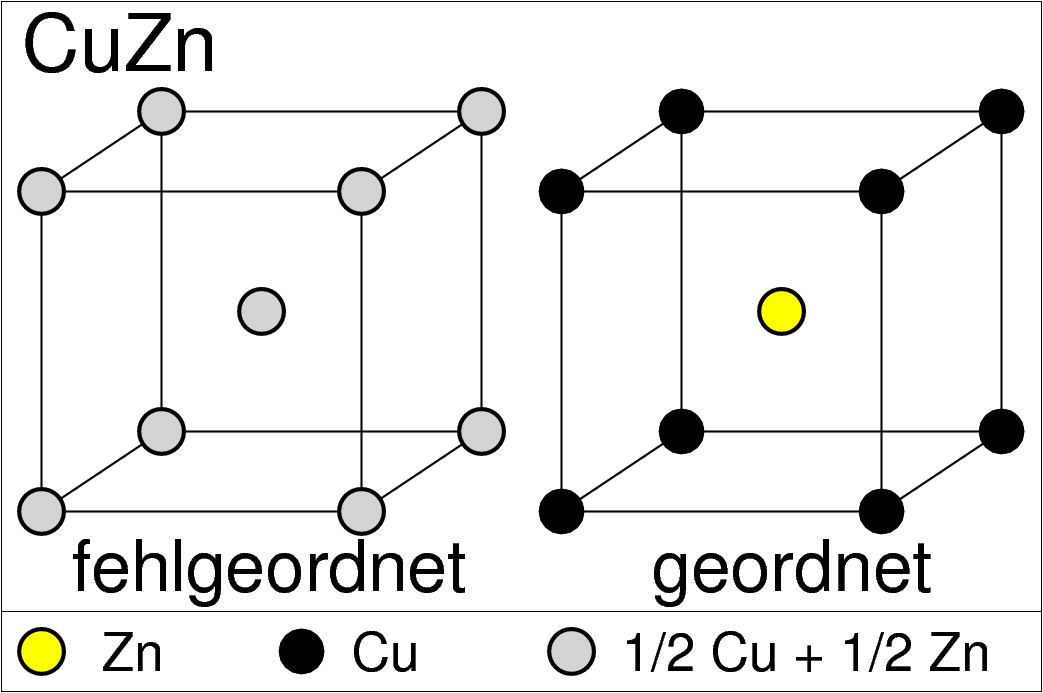
Im Fall der kubisch-innenzentrierten Strukturen (bcc-Packung) ist die AB-Zusammensetzung besonders günstig, da hier jedes der beiden Atome nur ungleiche Nachbarn hat. Der resultierende Strukturtyp ist der kubisch primitive CsCl- bzw. ß-Messing-Typ (Abb. 3.2.2. links).
|
|
|
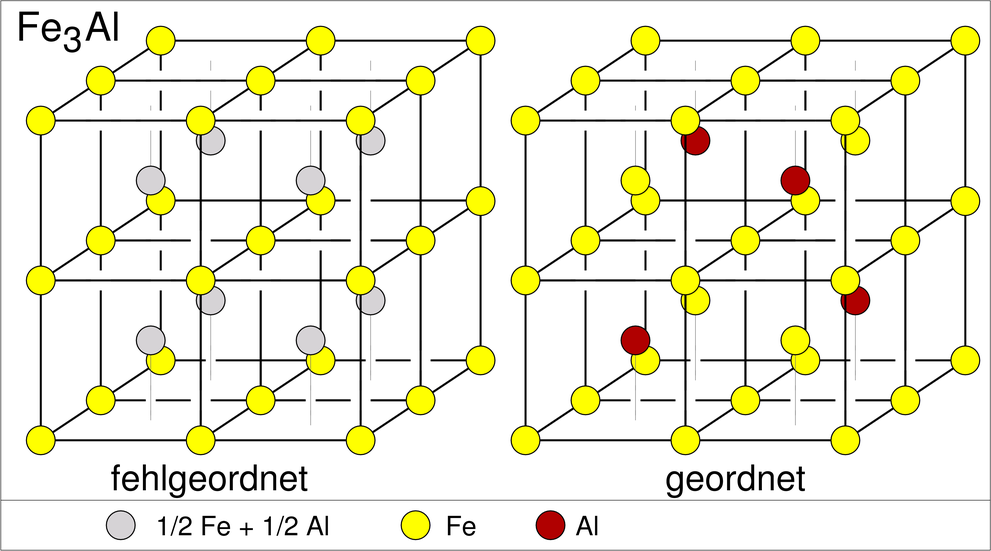
| ß-Messing ‣SVG | Fe3Al ‣SVG | Heusler-Verbindungen |
| Abb. 3.2.2. Überstrukturen der kubisch-innenzentrierten Packung | ||
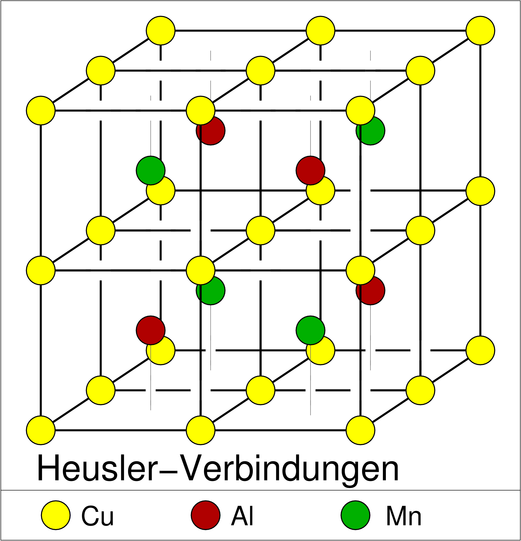
Die zweite wichtige Überstruktur der kubisch innenzentrierten Packung ist die mit AB3-Zusammensetzung, der Fe3Al-Typ (oben rechts). Die geordnete Variante ist kubisch mit der doppelten Achslänge des b.c.c.-Muttertyps. Eine ternäre Ordnungsvariante findet sich bei den sog. Heusler-Legierungen (nach Friedrich Heusler) wie z.B. Cu2MnAl. Ausgehend von Fe3Al sind hier die vier Teilwürfelzentren alternierend von Mn und Al besetzt. Einige Heusler-Verbindungen sind ferromagnetisch, obwohl keines der enthaltenen Elemente selber Ferromagnetismus zeigt. Sie sind in der Spintronik wichtig und einige von ihnen sind seit 2006 als sogenannte 'toplogische Isolatoren' (topological insulators) bekannt geworden.
Die folgende Tabelle gibt, geordnet nach Intraschichtordnungen (2. Spalte),
einen Überblick über die wichtigsten Ordnungsvarianten der dichten Packungen. In
Klammern ist zu den einzelnen Strukturtypen die Häufigkeit des Auftretens in binären intermetallischen
Systemen angegeben.
| Zusammensetzung | Überstruktur der Schicht | Basis-Stapelfolge | ||
| ABC | AB | ABAC | ||
| AB3 | dreieckig, 36 ‣SVG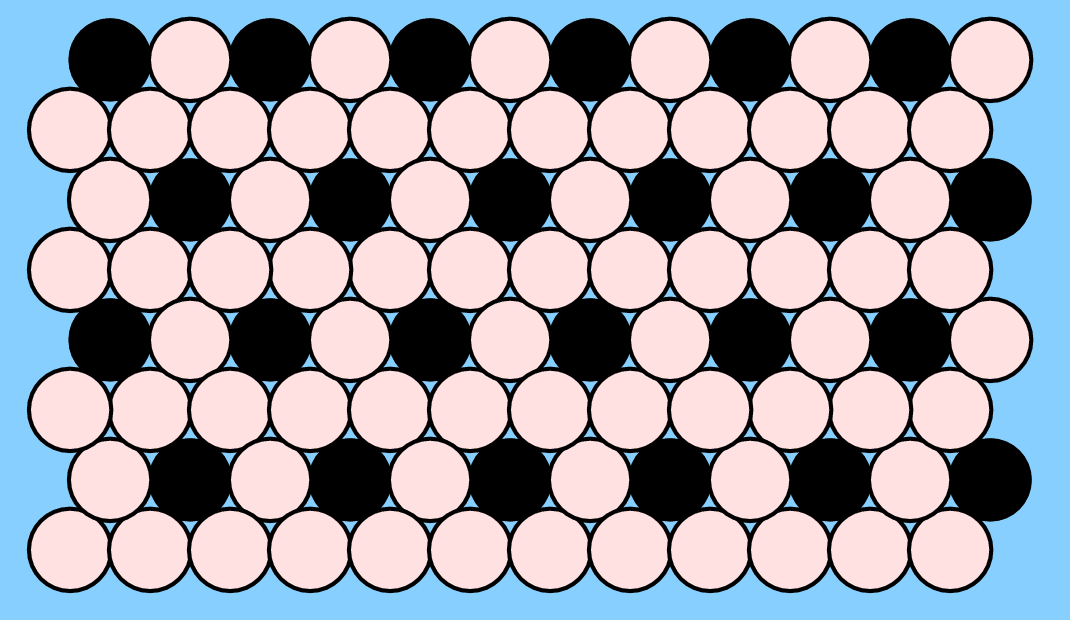
|
Cu3Au (75)‣SVG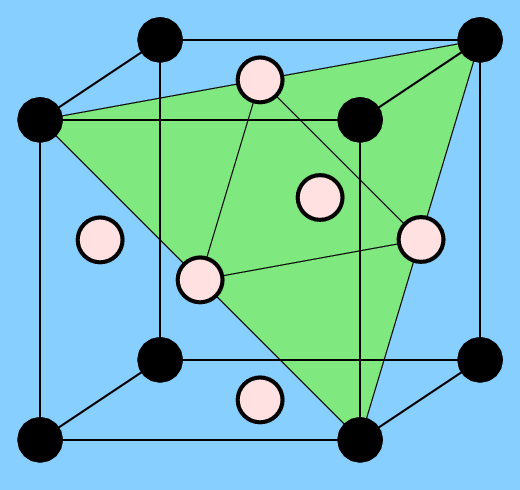 |
Ni3Sn (15) | Ni3Ti (7) |
rechteckig, 44 ‣SVG |
TiAl3 (7) ‣SVG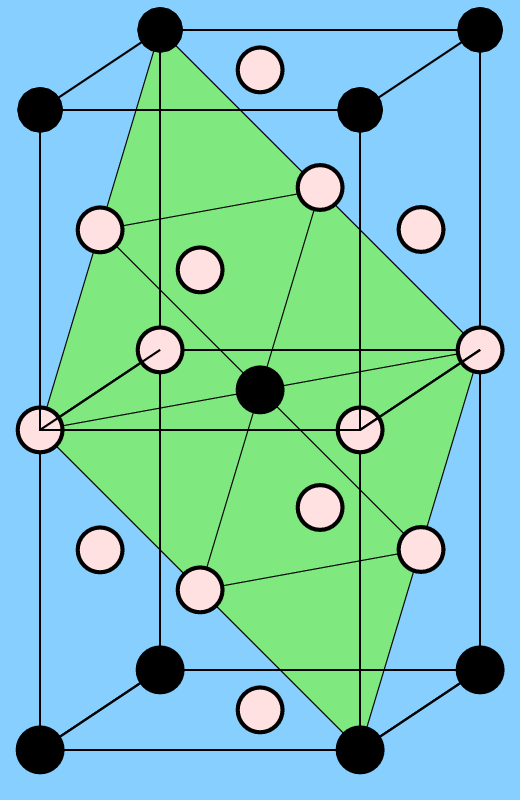 |
Cu3Ti (15) | - | |
3342 ‣SVG |
ZrAl3 ‣SVG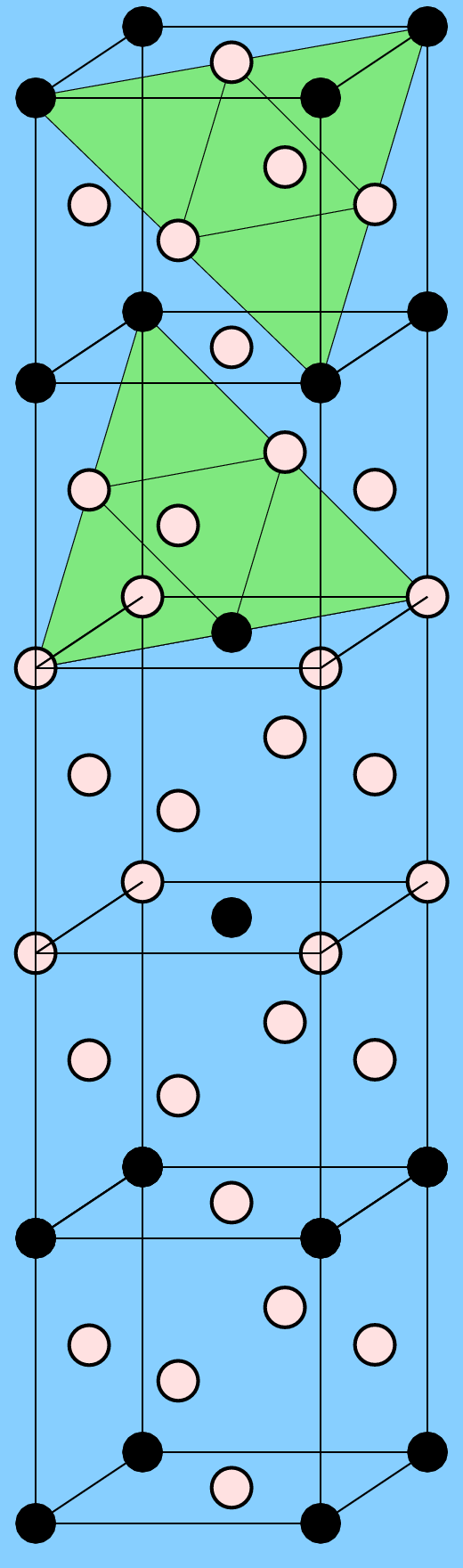 |
- | - | |
| AB4 | ‣SVG |
MoNi4 | - | - |
‣SVG |
- | ZrAu4 | - | |
| AB2 (+B3) | ‣SVG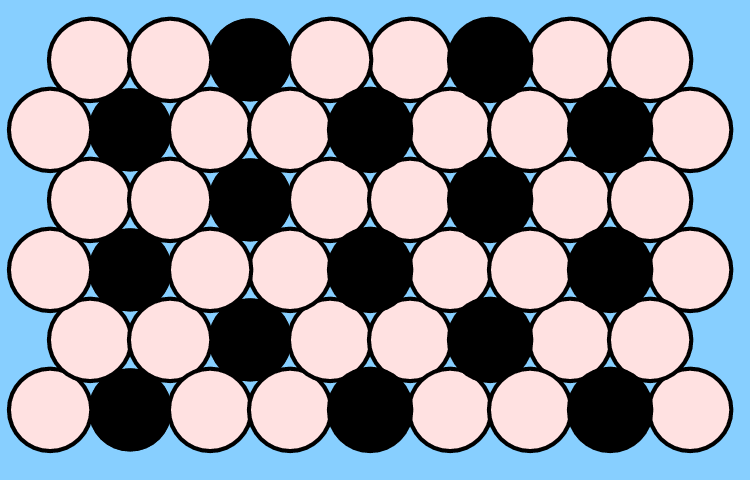 |
- | WAl5 | - |
| AB | einfache Reihen ‣SVG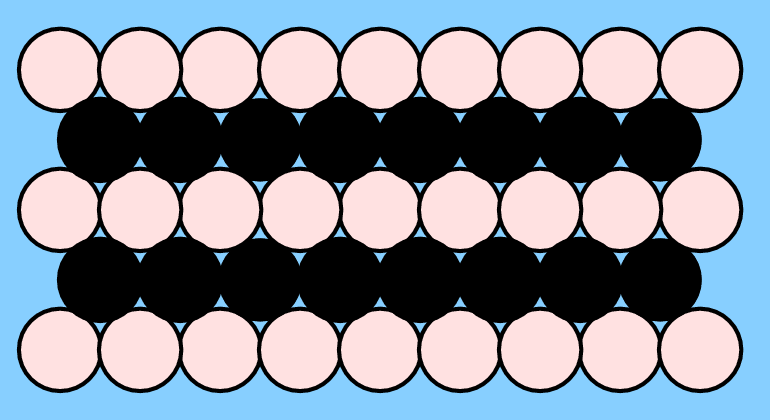 |
CuAu (19) ‣SVG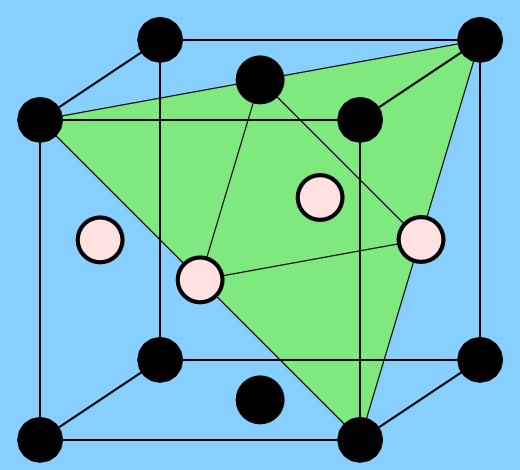 |
CuCd (3) | - |
Bei den dichten Packungen ist die AB3-Zusammensetzung besonders günstig, da in diesem Fall A nur von B koordiniert ist. Bei der dreieckigen, 36-Schichtordnung ergibt sich bei kubischer Stapelfolge nach ABC der sehr häufige Cu3Au-Typ, der in 75 verschiedenen binären intermetallischen Systemen vorkommt. Die Struktur kann als Packung von Kuboktaedern AB12 betrachtet werden. Aus der hexagonalen Stapelung nach AB ergibt sich der Ni3Sn-Typ, der in 15 intermetallischen Systemen vorkommt. Doppelt hexagonale Schichtabfolge nach ABAC ergibt entsprechend den Ni3Ti-Typ (7 x). Bei rechteckiger, 44-Schichtordnung resultiert bei ABC-Stapelfolge die TiAl3-Struktur (7 x), bei AB-Folge der Cu3Ti-Typ, der von 15 Systemen bekannt ist. Die 'Mischung' aus 44- und 36-Schichtordnung findet sich (bei kubischer Schichtfolge) beim ZrAl3.
Die Zusammensetzung AB4 ist ebenfalls noch recht häufig. A ist wie bei der AB3-Stöchiometrie ebenfalls nur von B koordiniert. Die wichtigsten beiden Varianten - mit jeweils unterschiedlicher Basisschicht - sind MoNi4 (ABC-Stapelung) und ZrAu4 (AB-Stapelung).
Verbindungen AB2 sind nicht bekannt. WAl5 enhält jedoch eine mögliche AB2-Schicht alternierend mit einer reinen Al3-Schicht (WAl5 = WAl2 + Al3).
Bei AB-Verbindungen liegen innerhalb der Basisschicht eine Reihen-artige Verteilung von A und B vor. Bei kubischer Stapelung dieser Schichten ergibt sich der CuAu-, bei hexagonaler Schichtfolge der CuCd-Typ.
Interessant bei den Überstrukturen sind die Vorgänge bei der Ausordnung, die sogenannten Ordnungs-Unordungs-Phasenübergänge. (s. Kapitel 2.1, Phasenumwandlungen, in der Vorlesung Festkörperchemie).
Ebenfalls von großem technischen Interesse ist die Auswirkung, die die Ordnung auf die physikalischen Eigenschaften der Legierung ausüben.
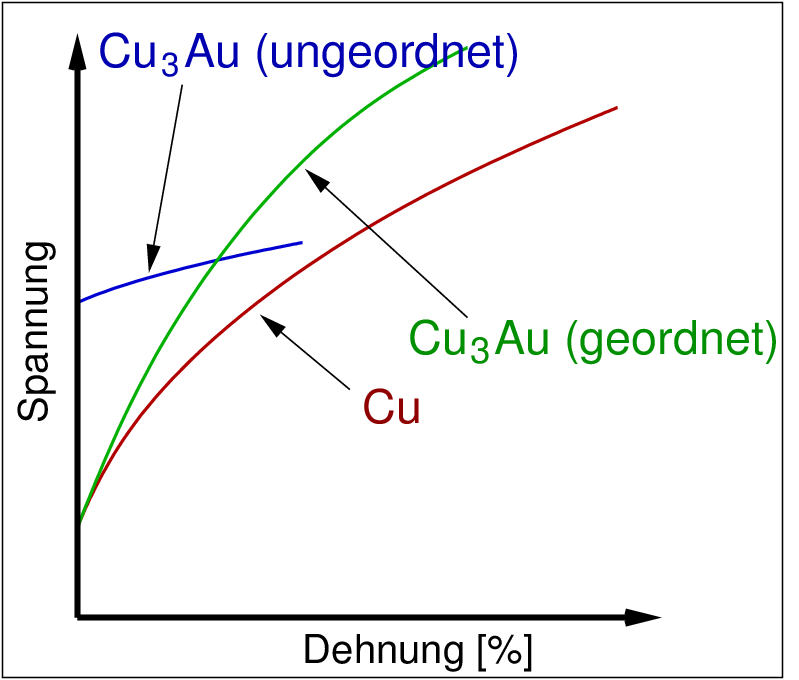
Dies zeigt die Abbildung 3.2.2. am Beispiel der mechanischen Eigenschaften und des elektrischen Widerstands von Legierungen (geordnet und ungeordnet) im System Cu-Au.
|

|
| Spannungs-Dehnungs-Diagramm ‣SVG | Elektrischer Widerstand ‣SVG |
| Abb. 3.2.2. Physikalische Eigenschaften von Cu-Au-Legierungen | |
Das Spannungs-Dehnungs-Diagramm zeigt, dass die geordnete Legierung (grüne Kurve) deutlich härter ist als reines Kupfer (rote Kurve). Bei kleinen Spannungen ist die ungeordnete Legierung (blaue Kurve) weniger dehnbar als reines Kupfer oder die geordnete Legierung, d.h. für Anwendungen in der Mechanik günstiger. Bei größeren Spannungen ist die geordnete Legierung fester (weniger dehnbar).
Der Verlauf des elektrischen Widerstand mit dem Cu/Au-Verhältnis (Abb. 3.2.2. rechts) zeigt, dass die Legierungsbildung grundsätzlich zu einer Erhöhung des elektrischen Widerstands führt. Bei geordneten Legierungen (rote Kurve) ist der Widerstand jedoch geringer als in der ungeordneten.
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Lit. | ⇨ |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Festkörperchemie | Oxide | Silicate | Strukturtypen |