| cr_home | Metalle | Nichtmetalle | Strukturchemie | Festkörperchemie | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Lit. | ⇨ |
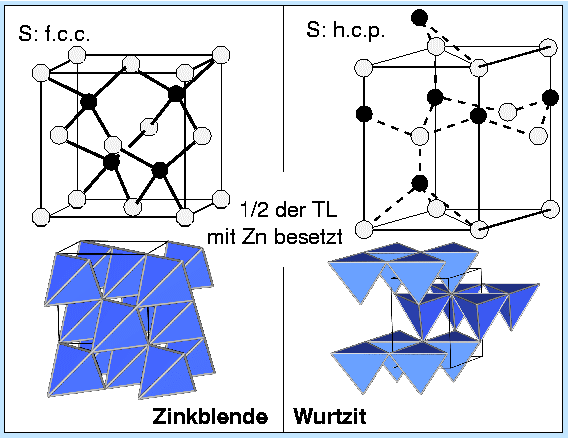
Bei den Tetraederstrukturen gibt es neben der Zinkblende als zweiten wichtigen Typ die Wurtzit-Struktur, die jedoch vor allem bei großen Elektronegatvitätsdifferenzen zwischen den beiden Partnern auftritt:

| Zinkblende | Wurtzit |
| VRML | VRML |
| Sechsecke alle in Sesselkonformation | Sechsecke in der Schicht in Sessel-, dazwischen in Wannen-Konformation |
| bei großen Nichtmetallatomen | bei kleinen Nichtmetallatomen |
| bei wenig elektronegativen Anionen | bei stark elektronegativen Anionen |
| bei kleinem ΔEN | bei großem ΔEN |
| typische Halbleiter | typische Salze |
| Beispiele: GaAs, HgTe | Beispiele: BeO, ZnO, AlN, GaN |
Außer bei den binären Verbindungshalbleitern findet man - vorausgesetzt die mittlere Valenzelektronenkonzentration ist 4 - diverse Überstrukturvarianten der Zinkblende. Für binäre Verbindungen tritt die Zinkblendestruktur also auf, wenn die beiden Bindungspartner symmetrisch zur 4. Hauptgruppe stehen. (Alkali- und Erdalkalimetalle sind zu elektropositiv und bilden mit den Halogenen bzw. Chalkogenen typische Salzstrukturen, sind also Isolatoren.):
| Si,Ge | IV | ||||||
| Ga, In, Tl | P, As, Sb | III-V | |||||
| Zn, Cd, Hg | Se, Te | II-VI | |||||
| Cu, Ag | Cl, Br | I-VII |
Extrem wichtig für die technische Anwendung der Halbleiter ist die Größe der Bandlücke. Hier eine graphische Übersicht für die Bandlücken binärer Grimm-Sommerfeld-Verbindungen, gegen die Molmasse aufgetragen:
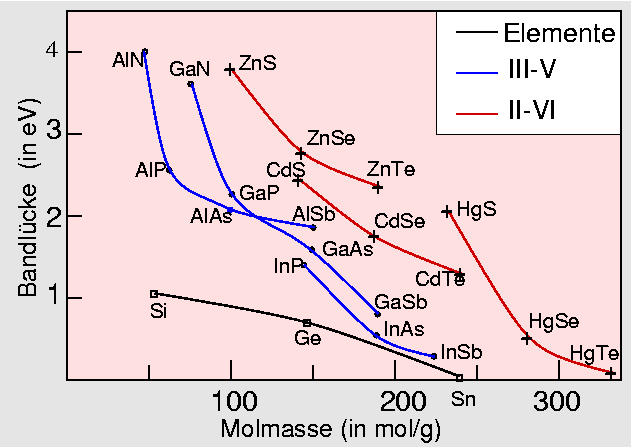
Während AlN noch zu den Isolatoren zu rechnen ist, nimmt die Bandlücke mit steigender Ordnungszahl ab, d.h. die Verbindungen werden metallischer. Verbindungen zeigen stets eine größere Bandlücke als die Elemente derselben Periode. Dies ist insofern verständlich, als hier Elektronegativitätsunterschiede vorliegen und damit der salzartiger Charakter erhöht ist.
Neben den einfachen III-V- und II-VI-Verbindungen bilden die B-Elemente miteinander diverse weitere Verbindungen...
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Lit. | ⇨ |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Festkörperchemie | Oxide | Silicate | Strukturtypen |