Vorlesung Intermetallische Phasen
6. Zintl-Phasen (A1-B2)
6.1 Bindung, Strukturprinzipien, Eigenschaften
Zintl-Phasen entstehen, wenn elektropositive Metalle der Gruppe A1 (ohne Beryllium)
mit elektronegativen B2-Elementen oder auch mit Zinn, Blei, Aluminium, Gallium, Indium oder Thallium
eine Verbindung eingehen.
Die eigentliche Trennlinie für das Auftreten von Zintl-Phasen verläuft
zwischen der 3. und 4. Hauptgruppe (sog. Zintl-Linie für die Ausbildung von Anionen).
Viele Verbindungen mit Elementen an oder links der Zintl-Linie z.B. mit Sn, Pb, Al, Ga, In oder Tl
sind typische Clusterverbindungen, die sich aber
mit dem erweitertenZintl-Klemm-Konzept unter Anwendung der Wade-Regeln für den Anionenverband ebenfalls
strukturell verstehen lassen.
Namensgeber der Verbindungsklasse ist Eduard Zintl (1898-1941)
der von München kommend 1928 bis 1933 in Freiburg und ab 1933 in Darmstadt
gearbeitet hat.
Bei seinen ersten systematischen Untersuchungen intermetallischer Phasen
hat er erstmals die Beugung als wichtigster Charakterisierungsmethode eingeführt.
Er hat verschiedene Lösungen zum Umgang mit sehr luftempfindlichen Substanzen
erarbeitet. Die Legierungen der Systeme Na-Pb und Na-Sn hat er systematisch
untersucht und dabei auch flüssigen Ammoniak als Lösungsmittel für die Anionen
sowie elektrochemische Verfahren eingesetzt.
Auf der theoretischen Seite hat er den Begriff der Anionenbildner (Zintl-Linie)
geprägt und erstmals erkannt, daß in diesen Legierungen die Anionen
den isoelektronischen Elemente analoge Bauverbände ausbilden (Zintl-Konzept im engeren Sinne).
Nach seinem Tod hat Laves vorgeschlagen, diese Verbindungen nach Eduard Zintl als
Zintl-Phasen zu bezeichnen. Eine genaue Grenze für diese Verbindungen anzugeben ist
nicht einfach, heute werden auch die Clusterverbindungen allgemein noch dazu gerechnet.
Das Prinzip der Bindung in den Zintl-Phasen ist, daß
eine recht große Differenz der Elektronegatvitäten zwischen den beiden Bindungspartner
vorliegt und damit zunächst ionische Konzepte greifen.
Es ist also für das Verständnis der Strukturen und Bindungsverhältnisse möglich,
die Phasen formal in A1-Kationen und (meist komplexe) [B2]x-Anionen
zu zerlegen. Der Anionenteilverband wird dann nach den Regeln für kovalente Verbindungen
(8-N-Regel) strukturell verständlich, sog. Zintl-Klemm-Busmann-Konzept.
Der Anionenverband muß in diesem verallgemeinerten Fall also nicht notwendigerweise
isoelektronisch zu einem Element sein.
Von den physikalische Eigenschaften her sind die Zintlphasen Halbleiter.
Die Bandlücke steigt, wenn der B2-Partner weiter rechts im Periodensystem steht.
Damit erhält man beim Gang von B2 nach links den Übergang zu den 'echten' metallischen
Legierung, nach rechts den Übergang zu den typischen Salzen.
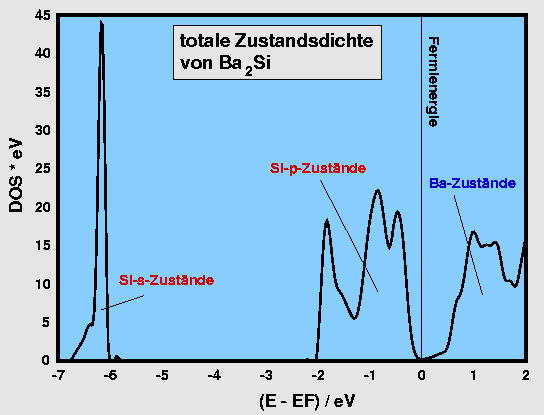
Als Beispiel für eine typische elektronische Struktur von Zintlphasen mit isolierten
(d.h. Edelgas-analogen Zintl-Anionen ist unten links die Zustandsdichte von Ba2Si
dargestellt. Die Si s- und p-Zustände befinden sich vollständig unter der Fermikante,
d.h. es ist gerechtfertigt von Si4--Anionen zu sprechen. Die Bandlücke
ist allerdings sehr gering, die Ba-Zustände liegen alle oberhalb von EF,
d.h. das Erdalkalimetall liegt als Kation Ba2+ vor.
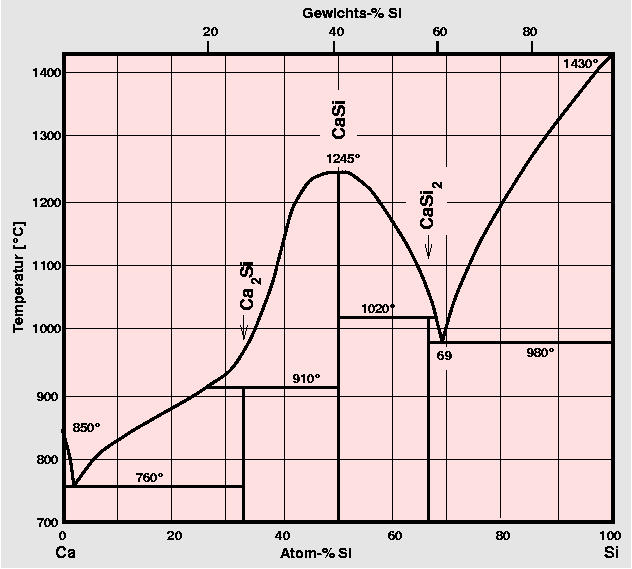
Zintl-Phasen sind stöchiometrisch scharf. Sie schmelzen im Vergleich zu anderen Legierungen
meist recht hoch. Als Beispiel ist oben rechts das Phasendiagramm Ca-Si angegeben.
Je nach Elementkombination sind sie metallisch glänzend oder tief gefärbt.
Die Reaktivität ist sehr unterschiedlich und reicht von extrem luftempfindlich
bis sehr stabil. Sie sind als Halbleiter schlechtere elektrische Leiter als die Metalle,
die Leitfähigkeit steigt mit der Temperatur.
Technisch sind Zintl-Phasen ohne Bedeutung.
Im folgenden werden für verschiedene Gruppen von Zintl-Phasen jeweils Beispiele
diskutiert:

