Vorlesung Intermetallische Phasen
7. Packungsdominierte Phasen
7.2. Laves-Phasen
Allgemeines, Strukturen
Unter Laves-Phasen (nach Fritz Laves, 1906-1978) werden drei wichtige und häufige Strukturtypen
von intermetallischen Phasen der stöchiometrisch scharfen Zusammensetzung AB2
zusammengefaßt. Prinzip der drei Strukturtypen
(MgCu2-, MgZn2- und MgNi2-Typ)
ist eine extrem dichte Packung, die dadurch ermöglicht wird, dass
die beiden Atomsorten unterschiedliche Radien (mit einem idealen
Radienverhältnis zwischen A und B von 1.228) aufweisen. Da die
tetraedrischen Lücken in dichten Packungen deutlich kleiner sind als
oktaedrische Lücken, sind folglich Packungen, die nur (verzerrte)
Tetraederlücken zeigen entsprechend dichter. Betrachtet man umgekehrt
die Koordinationspolyeder um die einzelnen Atomsorten, dann haben diese
keine Vierecksflächen als Begrenzungsflächen. Polyeder, die nur
Dreiecksflächen aufweisen, sind die sog. Frank-Kasper-Polyeder.
Das kleinste Polyeder dieser Art ist das Ikosaeder (CN 12 = 12 Ecken, 20
Dreiecksflächen als Begrenzungsflächen). Verzerrte Ikosaeder
(CN 6 A +6 B) sind die Koordinationspolyeder der kleineren B-Atome Cu/Zn/Ni
wie unten genauer erläutert wird. Das zweite Frank-Kasper-Polyeder
in den Laves-Phasen hat die Koordinationszahl 16: Die größeren A-(Mg)Atome
sind von 12 B- und 4 A-Atomen koordiniert. Es läßt sich als 4-fach überkapptes
gekapptes Tetraeder beschreiben. Die folgende Bilderserie soll die Prinzipien der
Strukturchemie der Laves-Phasen verdeutlichen:
 |
 |
 |
 |
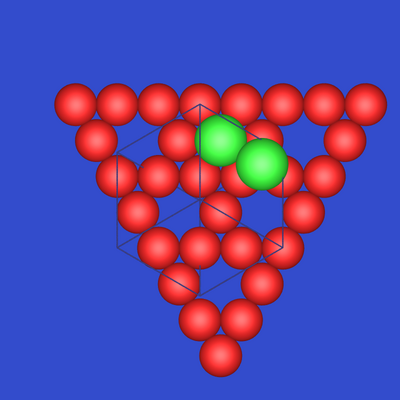
| Abb. 7.2.1. Cu-Kagomenetz mit zwei
verschiedenen Mg-Positionen |
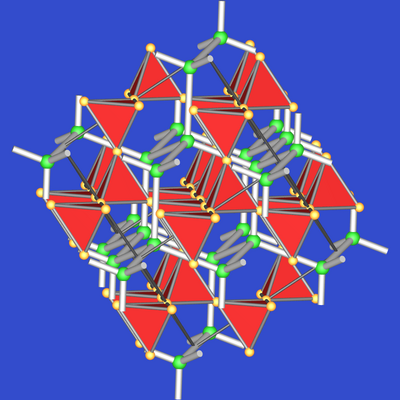
Abb. 7.2.2. Gesamtstruktur von MgCu2 |
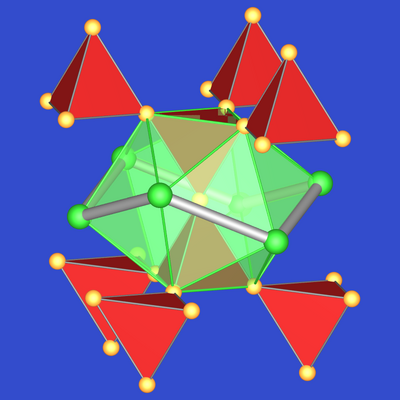
Abb. 7.2.3. Ikosaedrische Koordination von Cu im MgCu2-Typ |
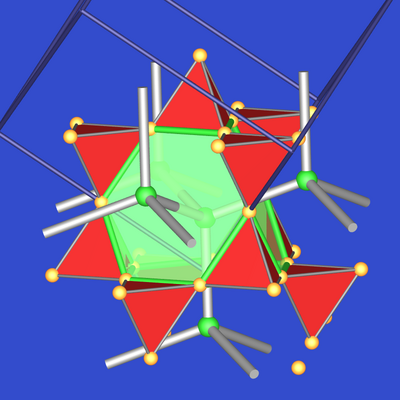
Abb. 7.2.4. 12+4-Koordination von Mg im MgCu2-Typ |
Die folgenden Abbildungen zeigen den Aufbau des MgCu2-Typs sehr detailliert:
- Die erste Serie zeigen die Packungsprinzipien mit Kugelmodellen.
Obwohl dies bei größeren Ausschnitten recht unübersichtlich wird, läßt
sich doch gut die hohe Dichte der Packung in den Laves-Phasen
veranschaulichen.
- Der Aufbau der Struktur erfolgt ähnlich wie bei den einfachen Metallpackungen.
Sie beginnt mit einer
Schicht aus Cu-Atomen, die ein sogenanntes
Kagome-Netz (Schläfli-Netz 3.6.3.6.) bilden. Dies ist nichts weiter
als eine dichte Kugelpackung in der Ebene, in der 1/4 der Atom entfernt sind.
Diese Schicht wird im Folgenden mit 'Kagome-Netz der Orientierung A' bezeichnet.
- Über der Hälfte der Dreieckmaschen der Kagomenetze (kleine Zwickel, genau wie bei
den einfachen
dichten Packungen) werden die nächsten Cu-Atome gestapelt, so dass bereits die charakteristischen
Cu4-Tetraeder.
gebildet werden.
- Über den Sechseckmaschen der Kagomenetze (große Zwickel) werden nun
die ersten Mg-Atome eingepaßt, hier das
Ergebnis. Der Schwerpunkt der Mg-Atome liegt unterhalb der der Cu-Zwischenschicht.
- Über der zweiten Hälfte der Dreiecksmaschen (kleine Zwickel) folgt
die zweite Schicht aus Mg-Atomen.
Hierbei liegt der Schwerpunkt dieser Mg-Atome entsprechend oberhalb der der Cu-Zwischenschicht.
Betrachtet man nur die Mg-Atome, so liegt ein gewelltes Sechsecknetz vor.
- Auf die so entstandene Schicht aus Cu- und Mg-Atomen auf unterschiedlicher Höhe
paßt ein weiteres
Kagome-Netz aus Cu-Atomen mit der Orientierung B.
- Alle weiteren Schichten folgen analog
( usw.,
usw.,
usw., usw. )
wobei im Fall des MgCu2-Typ die Stapelfolge |:ABC:|
der Kagome-Netze eingehalten wird. Stapelung nach |:AB:| führt zum
MgZn2- und doppelt hexagonale Stapelung |:ABAC:| zum MgNi2-Typ (s.u.).
Die
Gesamtstruktur von MgCu2 ist nur schwer im Kugelmodell zu erkennen.
- Die zweite Serie zeigt daher die gleiche Struktur in einer übersichtlicheren Darstellung
(nicht als Kugelpackung). Die durch die Cu-Kagomenetze gebildeten LEEREN Cu4-Tetraeder
sind hier der Übersichtlichkeit halber als Polyeder dargestellt. Diese Art
der Abbildung wird für alle anderen Lavesphasen und Verwandte entsprechend
verwendet:
- Die 1. Abbildung
zeigt die Anordnung der Cu4-Tetraeder
in der kubischen Elementarzelle. Die Tetraederanordnung
entspricht der im Cristobalit. Die großen Lücken in diesem Verband sind mit Mg-Atomen
besetzt, die untereinander (Atomabstand ca. 440 pm) der besseren räumlichen Übersicht halber
mit Bindungsstrichen verknüpft sind. So ist zu erkennen, dass die
Mg-Atome untereinander
eine Diamant-Struktur ausbilden. Beide Teilverbände zusammen bilden die
Gesamtstruktur von MgCu2
- Die Koordinationspolyeder um die Atome sind die im
Kapitel 7.1 beschriebenen Frank-Kasper-Polyeder.
Die Cu-Atome sind von sechs weiteren Cu- und sechs Mg-Atomen umgeben:
Die Mg-Atome sind die Zentren
von 4-fach überkappten gekappten Tetraedern (12 Cu-Atome) und 4 weiteren Mg-Atomen:
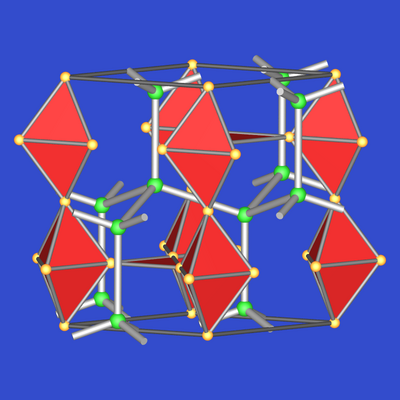
Die MgZn2-Struktur unterscheidet sich vom MgCu2-Typ lediglich durch
die Stapelfolge der Kagomenetze. Durch die Stapelfolge |:AB:| sind die Cu4-Tetraeder
über gemeinsame Flächen verknüpft.
Hier die gesamte Struktur in der
Darstellung mit Zn4-Tetraedern. Die Mg-Atome bilden untereinander eine Wurtzit-analogen Teilverband.
Sie sind wie in MgCu2 Zentren von
16-er Frank-Kasper-Polyedern (CN 12+4).
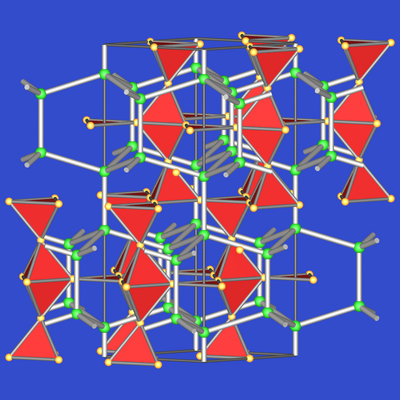
Im MgNi2-Typ sind die Kagomenetze nach |:ABAC:| gestapelt, so dass die
gesamte Struktur als Stapelvariante
von MgCu2 und MgZn2 betrachtet werden kann.
 |
 |
| Abb. 7.2.5. MgZn2-Typ |
Abb. 7.2.6. MgNi2-Typ |
Und noch ein kleines Video zu dem Ganzen (WS 2021, Strukturchemie-Vorlesung)
| Laves-Phasen: Prinzipien der Strukturen, Modellvorstellungen ;-)
(172MB|MP4|H264) |
|
Vorkommen, Elementkombinationen
Die drei Laves-Phasen sind extrem häufig und treten mit den verschiedensten Elementkombinationen
auf. Die folgende Tabelle gibt einen Überblick über die Zahl der Vertreter und einige
Beispiele:
| Strukturtyp |
Gesamtzahl Verbindungen |
Beispiele für die wichtigsten Elementkombinationen |
| A1-A1 |
A1-A2 |
A1-B1 |
(A1-B2) |
A2-A2 |
A2-B1 |
(A2-B2) |
| MgCu2 | ca. 500 | KNa2 | BaPt2, NaAg2 | CaAl2 | KBi2 | YFe2,TaV2 | YAl2 | BiAu2 |
| MgZn2 | ca. 350 | CaLi2, CsNa2 | BaPt2, NaAg2 | CaCd2 | - | TiMn2 | - | - |
| MgNi2 | ca. 50 | - | MgNi2 | - | - | TaCo2 | TaZn2 | - |
Tab. 7.2.1. Laves-Phasen
Bei der Kombination A1-A1 kommen Laves-Phasen nur selten vor, wenn die Radienverhältnisse stimmen.
Sehr häufig sind sie bei den Kombinationen A1-A2 und A1-B1.
In den A2-A2 Systemen treten sie nur dann auf, wenn beide A2-Elemente im Periodensystem
relativ weit auseinander stehen.
Seltener sind Lavesphasen bei A2-B1 und extrem selten bei A2-B2 Systemen.
Für die Frage, welche der drei Strukturtypen wann auftritt gibt es
Einflüsse der Valenzelektronenkonzentration
Für die Stablität der einzelnen Strukturtypen sind ähnliche Effekte wie bei Hume-Rothery-Phasen zu beobachten.
Die Phasenfolge wird von der Valenzelektronenkonzentration beeinflußt. Besonders deutlich kann
dies bei Mischkristallreihen z.B. der Art A(B1)x(B2)2-x verfolgt werden, wenn
B1 und B2 unterschiedliche VE-Zahlen zur Verfügung stehen (vgl. Abb. 7.2.7.).
Die Phasenfolge kann mittlerweile wie auch die der Hume-Rothery-Phasen durch
Bandstrukturrechnungen theoretisch verifiziert werden.
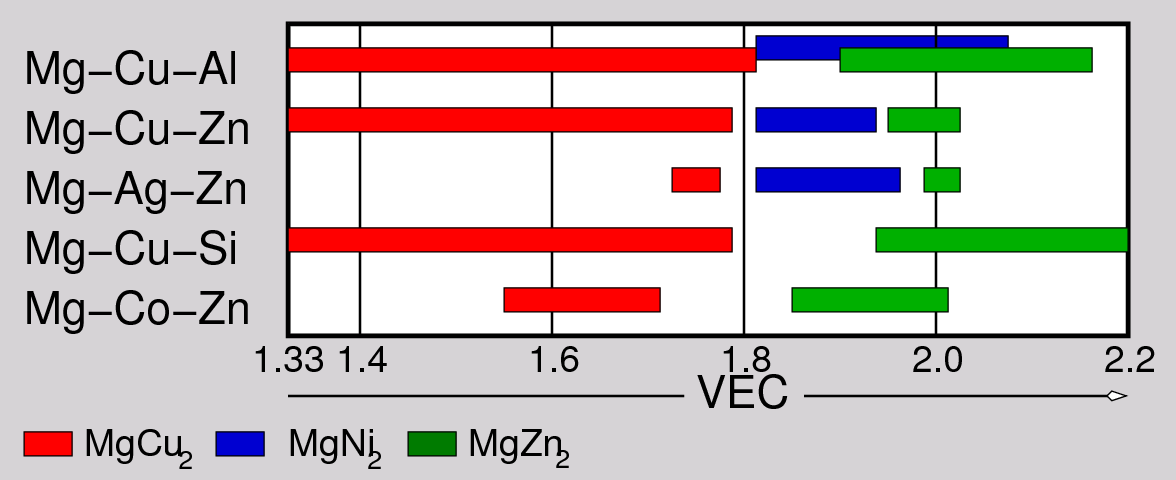 Abb. 7.2.7. Typen von Laves-Phasen in Abhängigkeit von
der Valenzelektronenkonzentration
‣SVG
Abb. 7.2.7. Typen von Laves-Phasen in Abhängigkeit von
der Valenzelektronenkonzentration
‣SVG
Die berechneten Zustandsdichten der beiden Mutterverbindungen MgCu2 und MgZn2 (Abb. 7.2.8.)
lassen relative Minima im Bereich der in Abbildung 7.2.7. gezeigten Stabilitätsbereiche
erkennen.
 |
 |
Abb. 7.2.8. Berechnete totale und partielle
Zustandsdichten von
‣SVG








