| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
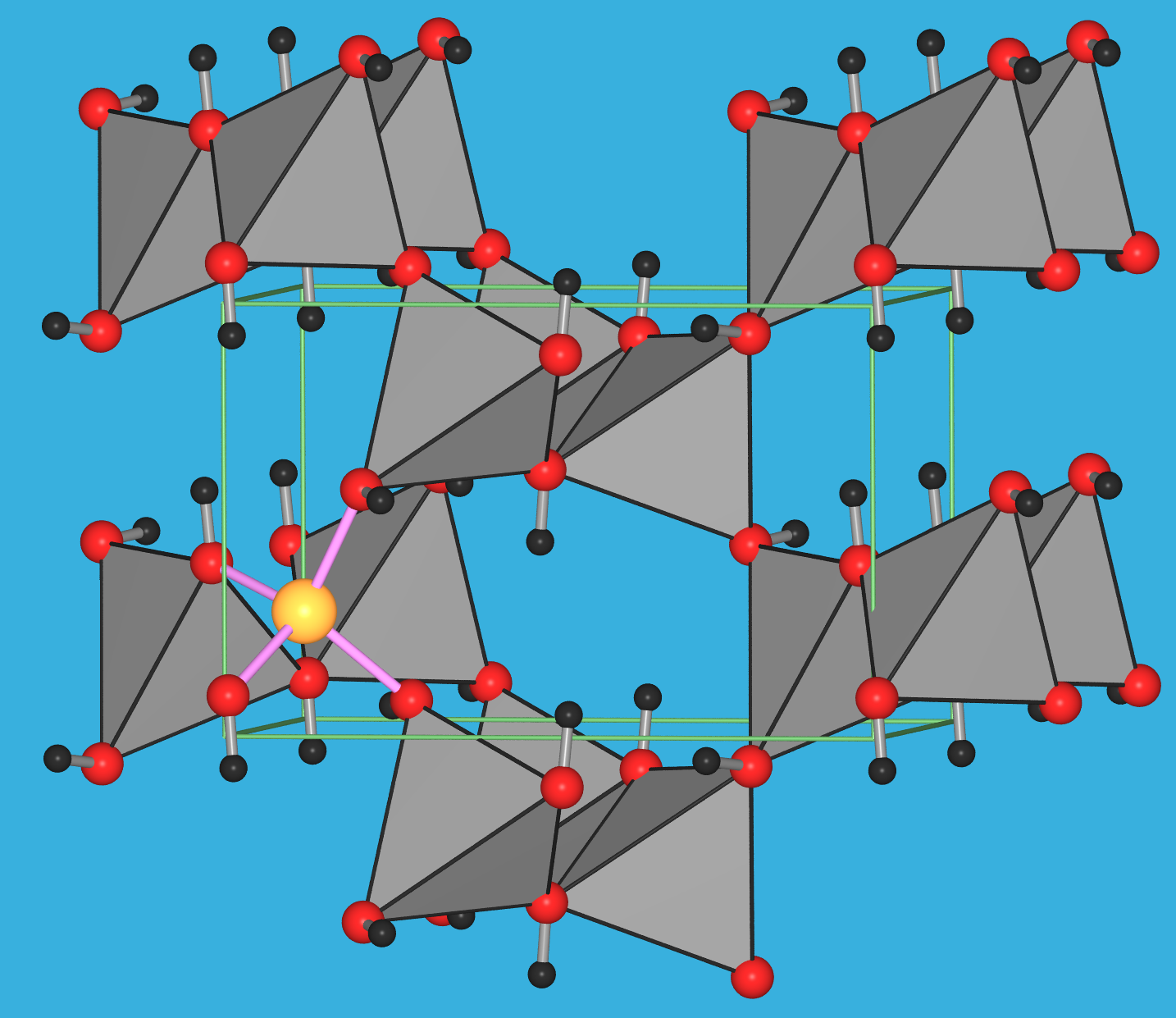
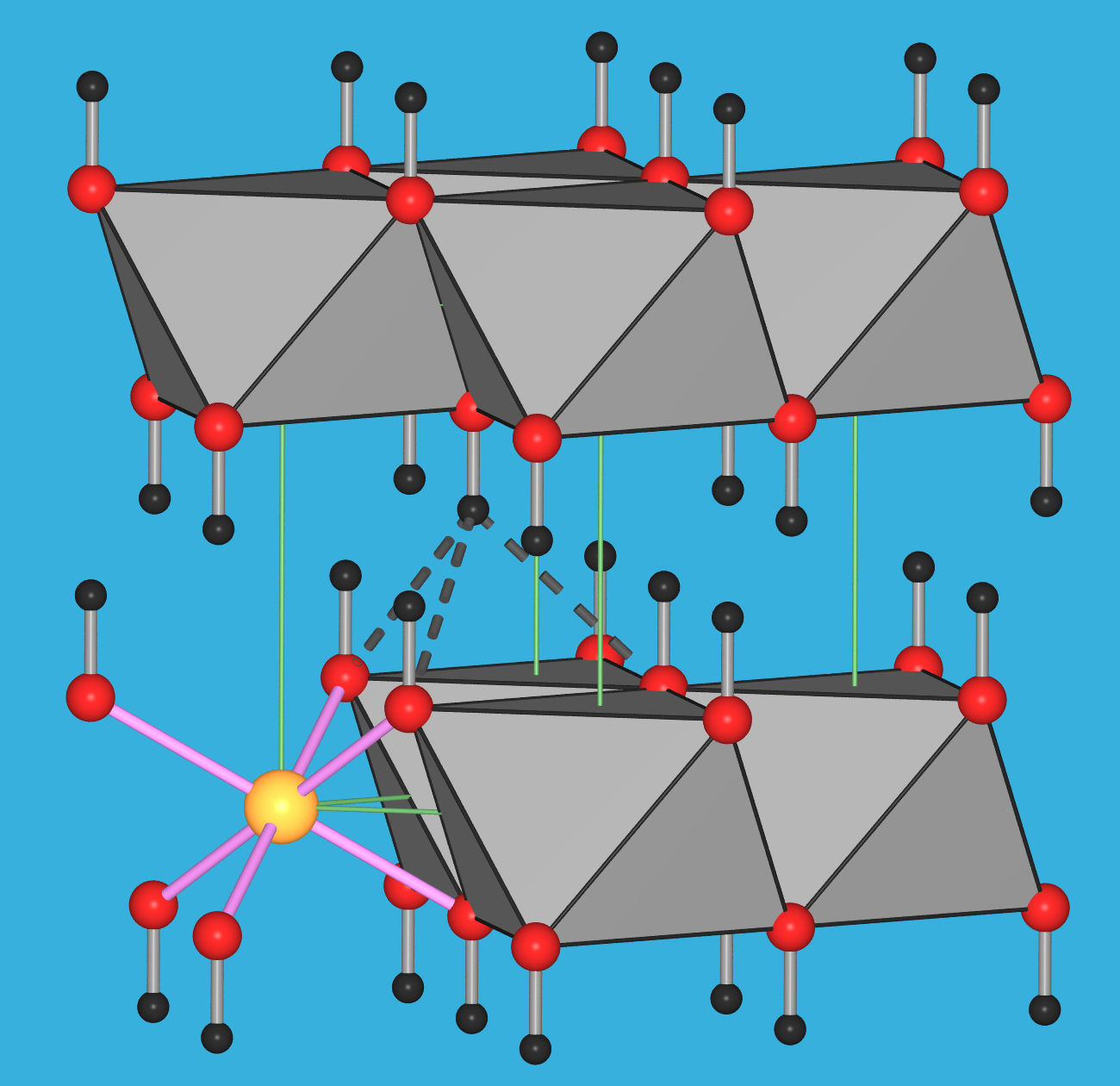
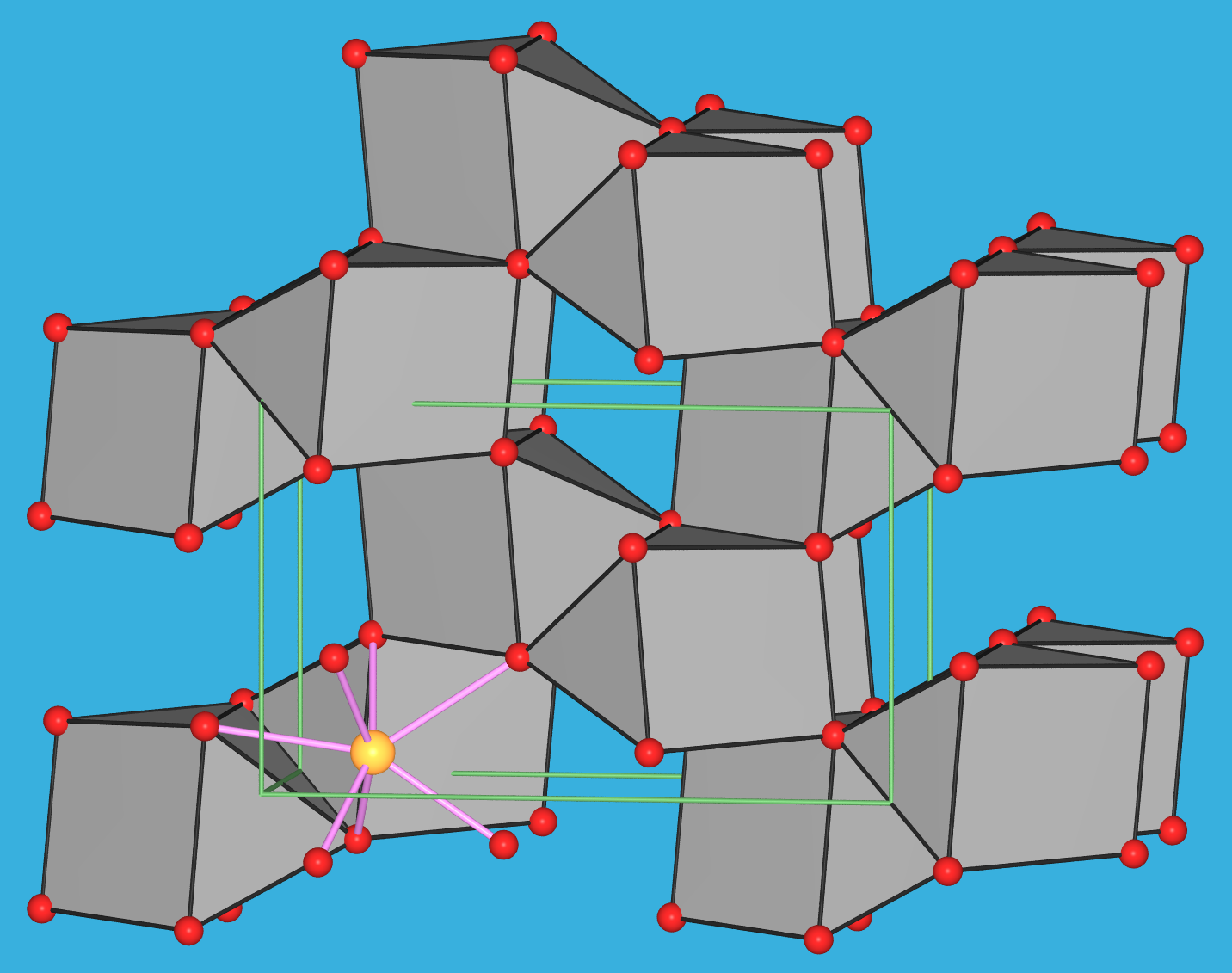
Zu den einzelnen Verbindungen:
| ⇦ | Inhalt | Kap. 1 | Kap. 2 | Kap. 3 | Kap. 4 | Kap. 5 | Kap. 6 | Kap. 7 | Kap. 8 | Kap. 9 | Literatur | ⇨ |
| cr_home | Nichtmetalle | Strukturchemie | FK-Chemie | Interm. Phasen | Oxide | Silicate | Strukturtypen |