- CaCO3 ist trimorph, kristallisiert also in drei verschiedenen Strukturtypen:
- Die Calcit-Form (zur Strukturchemie)
kommt in der Natur als Marmor, Kreide, Perlen, Kalkstein
oder Kalkspat vor. Besonders zu nennen ist hier die
Eigenschaft der Doppelbrechung gut ausgebildeten Kalkspat-Einkristallen (s. Abb. 3.7.1. rechts).
Diese resultiert aus der Struktur von Calcit, aus der sich eine Richtungsabhängigkeit
des Brechungsindexes n ergibt.



Abb. 3.7.1. Calcit (Kalkspat), rechts Doppelbrechung - Der Aragonit ist die Hochtemperaturform (s. Abb. 3.7.2.;
zur Strukturchemie).

Abb. 3.7.2. Aragonit - Der Vaterit-Typ lässt sich nur synthetisch erhalten (zur Strukturchemie).
- Die Calcit-Form (zur Strukturchemie)
kommt in der Natur als Marmor, Kreide, Perlen, Kalkstein
oder Kalkspat vor. Besonders zu nennen ist hier die
Eigenschaft der Doppelbrechung gut ausgebildeten Kalkspat-Einkristallen (s. Abb. 3.7.1. rechts).
Diese resultiert aus der Struktur von Calcit, aus der sich eine Richtungsabhängigkeit
des Brechungsindexes n ergibt.
- Alle Erdalkalimetall-Carbonate sind schwer löslich (vgl. 'Carbonat'-Gruppe des Kationentrennungsgangs),
CaCO3, SrCO3 und BaCO3 zeigen vergleichbare
Löslichkeit. MgCO3 ist dagegen in Säuren löslich.
Die Auflösung von CaCO3 gelingt durch Bildung von Ammoniakaten
CaCl2 + 8 NH3 ⟶ [Ca(NH3)8]2+ + 2 Cl- oder durch Komplexbildung mit Chelatliganden (s. Kap. 8.3.). - Die Carbonate gehen bei thermischer Zersetzung unter Abspaltung von CO2
in die einfachen Oxide MO über:
CaCO3 ⟶ CaO + CO2 Dabei kann CaO durch alkalische Reaktion mit Wasser, CO2 mit Barytwasser:CO2 + Ba(OH)2 ⟶ BaCO3 + H2O nachgewiesen werden.
⚗ Kalkbrennen und -Löschen; Kalkmilch; alkalische Reaktion (36MB|MP4|H264)
Die Zersetzungstemperatur steigt dabei von ca. 550 oC für Magnesiumcarbonat bis auf 1400 oC für die Bariumverbindung. Mit der Zersetzungstemperatur steigt entsprechend die Reaktionsenthalpie von 117 kJ/mol für MgCO3 bis auf 256 kJ/mol für BaCO3. Der Grund hierfür sind die Differenzen der Gitterenergien der Carbonate und der Oxide. Im Fall des kleineren Magnesium-Ions ist die Gitterenergie des Oxids deutlich größer als die des Carbonates, während im Fall von Ba2+ das Carbonat eine höhere Gitterenergie aufweist ('Passung' von großem Anion/Kation). - BaCO3 wurde früher als Rattengift verwendet.
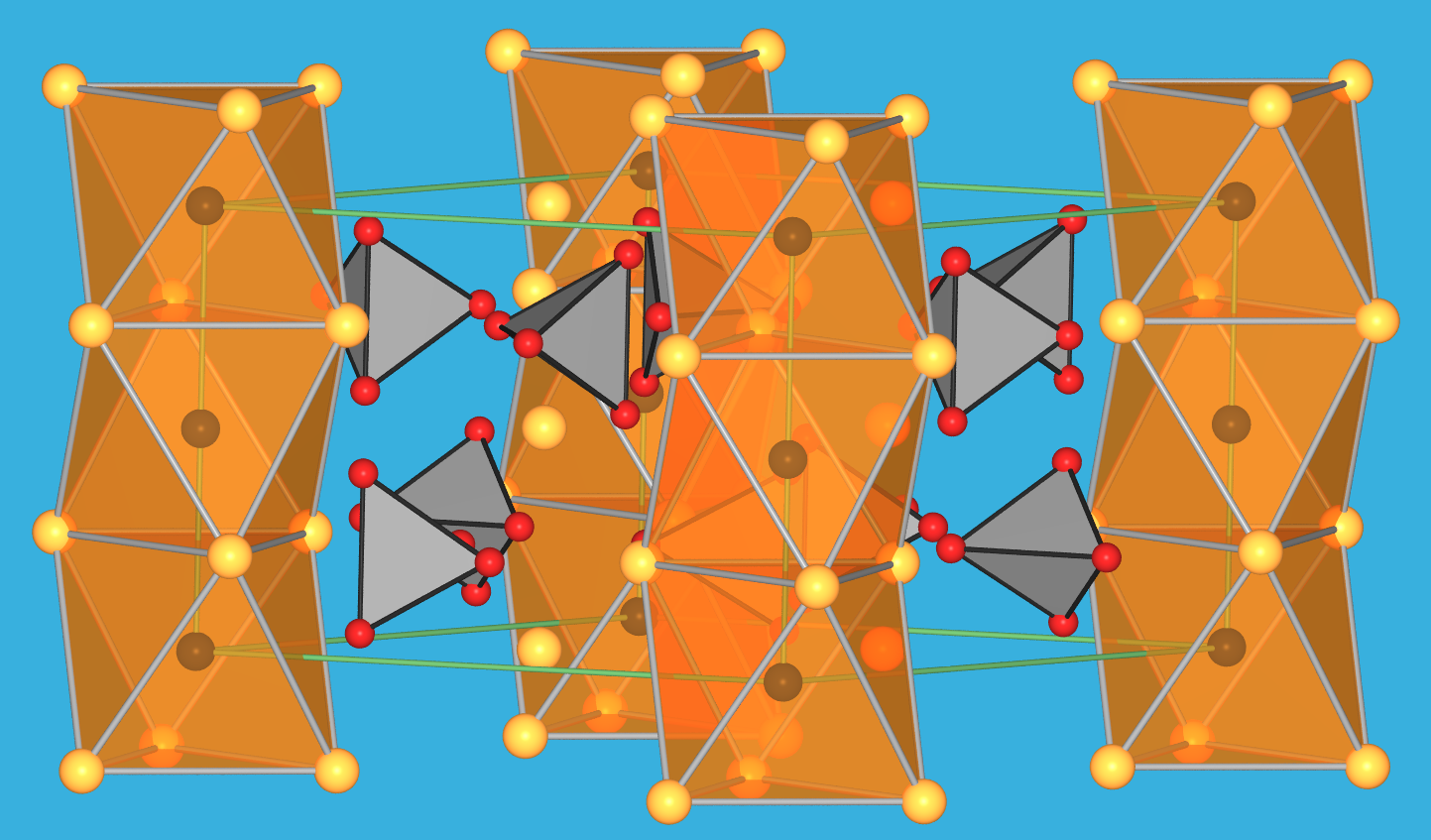 |
| Abb. 3.7.3. Kristallstruktur von Apatit, Ca5[PO4]3X ‣VRML |
Aus Ca3(PO4)2 bzw. Fluor-Apatit, Ca5(PO4)3F, werden wichtige Phosphat-Düngemittel wie z.B. (s. Abb. 3.7.4.)
- 'Superphosphat'
Ca3(PO4)2 + 2 H2SO4 + 4 H2O ⟶ Ca(H2PO4)2 + 2 CaSO4.2 H2O und - 'Nitrophoska' (Blaukorn, zweistufiges, sog. 'Odda'-Verfahren, BASF, 1927)
Ca5(PO4)3F + 10 HNO3 ⟶ 3 H3PO4 + 5 Ca(NO3) + HF 3 H3PO4 + 2 Ca(NO3) + 5 NH3 ⟶ 2 CaHPO4 + (NH4)H2PO4 + 4 NH4NO3 gewonnen.
 |
| Abb. 3.7.4. Die Phosphatdünger 'Superphosphat' (links) und 'Nitrophoska' (rechts). |
Das gemischte Salz MgNH4(PO4).6H2O ist schwerlöslich,
obwohl die einfachen Phosphate von Magnesium und Ammonium leicht löslich sind. Dies ist
auf ein ausgedehntes Wasserstoffbrückenbindungssystem zurückzuführen, das in Abbildnung 3.7.5
in die orthorhombische Struktur eingezeichnet ist (gestrichelte Bindungen). Das Salz bildet
charakteristische Kristalle ('Sargdeckel')
und dient daher in der analytischen Chemie zum Nachweis von Ammonium-, Magnesium- oder Phosphat-Ionen.
Zur quantitativen gravimetrischen Bestimmung nutzt man dann das Diphosphat MgP2O7, das beim Erhitzen entsteht (Wägeform).
Als Mineral 'Struvit' kommt MgNH4(PO4).6H2O in der Natur vor; beim Vorliegen bestimmter Nierenerkrankungen
von Tieren wird es mit dem Urin kristallin ausgeschieden.
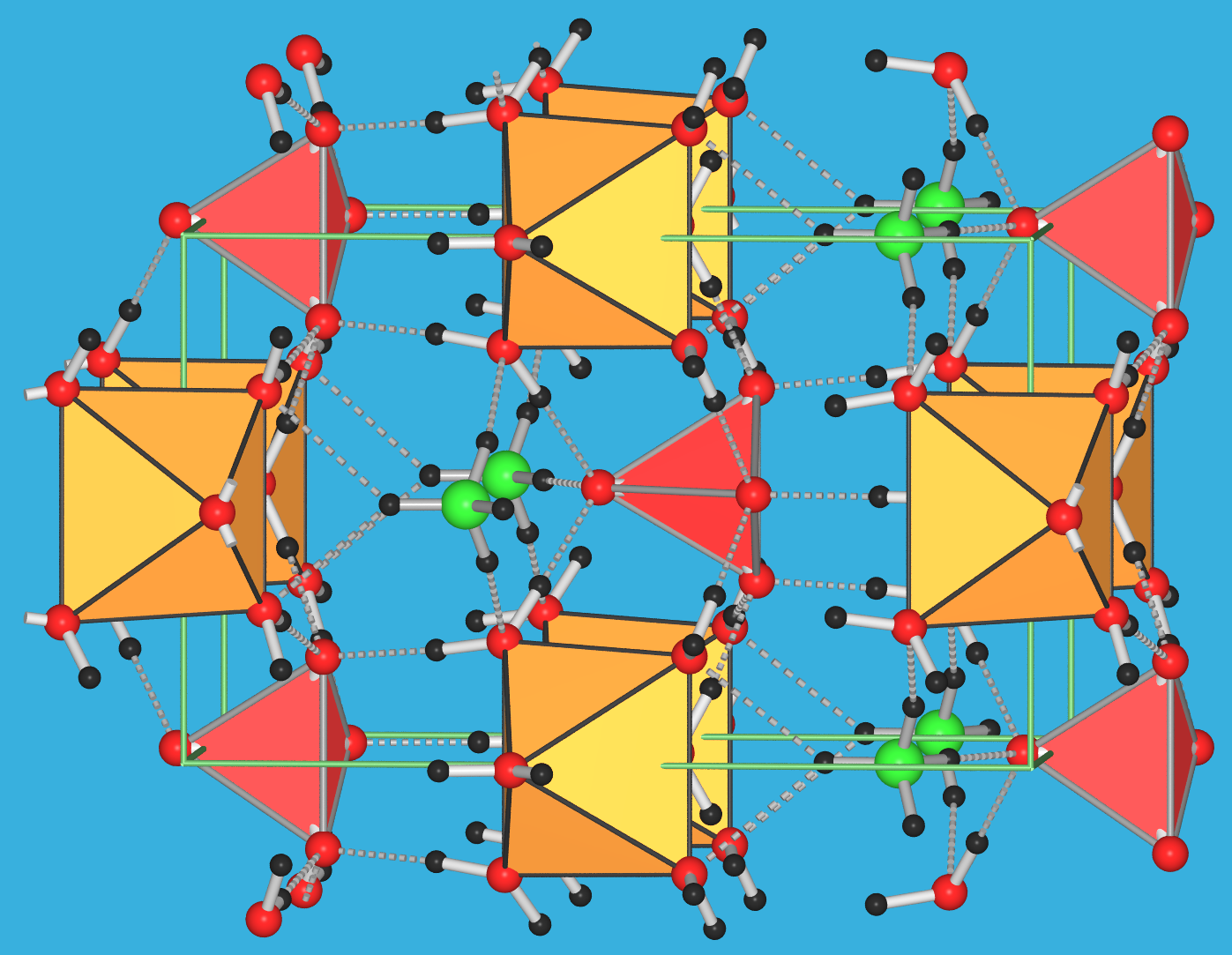 |
| Abb. 3.7.5. Kristallstruktur von Struvit, [Mg(H2O)6]NH4[PO4] (O/N/H: rote/grüne/schwarze Kugeln; [MgO6]-Oktaeder: gelbe Polyeder; PO4-Tetraeder: rote Polyeder). ‣VRML |
- Unter der permanenten Wasserhärte versteht man die Menge an CaSO4 im Wasser, während die temporäre Härte dem Ca(HCO3)2--Gehalt zugeschrieben wird.
- Das Heptahydrat von Magnesiumsulfat, MgSO4.7 H2O, nennt man auch Bittersalz. Es ist leicht löslich und wird als Abführmittel und Düngemittel verwendet.
- Das Dihydrat von Calciumsulfat CaSO4.2 H2O
(Gips, Struktur s. Abb. 3.7.7) ist dagegen wenig löslich. Je nach Morphologie nennt man das
Dihydrat Alabaster oder Gips (s. Foto Abb. 3.7.6.), ohne Kristallwasser Anhydrit und mit nur 1/2 H2O-Molekül
Halbhydrat.


Abb. 3.7.6. Kristalle von Gips in der Natur: links: besonders nette Variante mit drei Generationen von Gips-Kristallen (ca. 5 cm) und rechts: ein 'Mini'kristall (ca. 15 cm) aus der Naica-Höhle.
Die monokline Struktur von Gips ist in Abbildung 3.7.7. in zwei verschiedenen Ansichten gezeigt. Die Ca-Ionen sind insgesamt achtfach von Sauerstoff umgeben, sechs Sauerstoffatome gehören dabei zu Sulfationen, zwei zu Wassermolekülen. Diese Ca-Polyeder (gelb) sind über Kanten mit den Sulfat-Tetraedern (rot) zu Ketten verknüpft. Diese Ketten verlaufen entlang der typischen Gipsnadeln. Die Wassermoleküle bilden ein Wasserstoffbrückensystem (gestrichelte Linien, Abb. 3.7.7.). Diese liegen in der Spaltfläche der Kristalle senkrecht zur monoklinen b-Achse.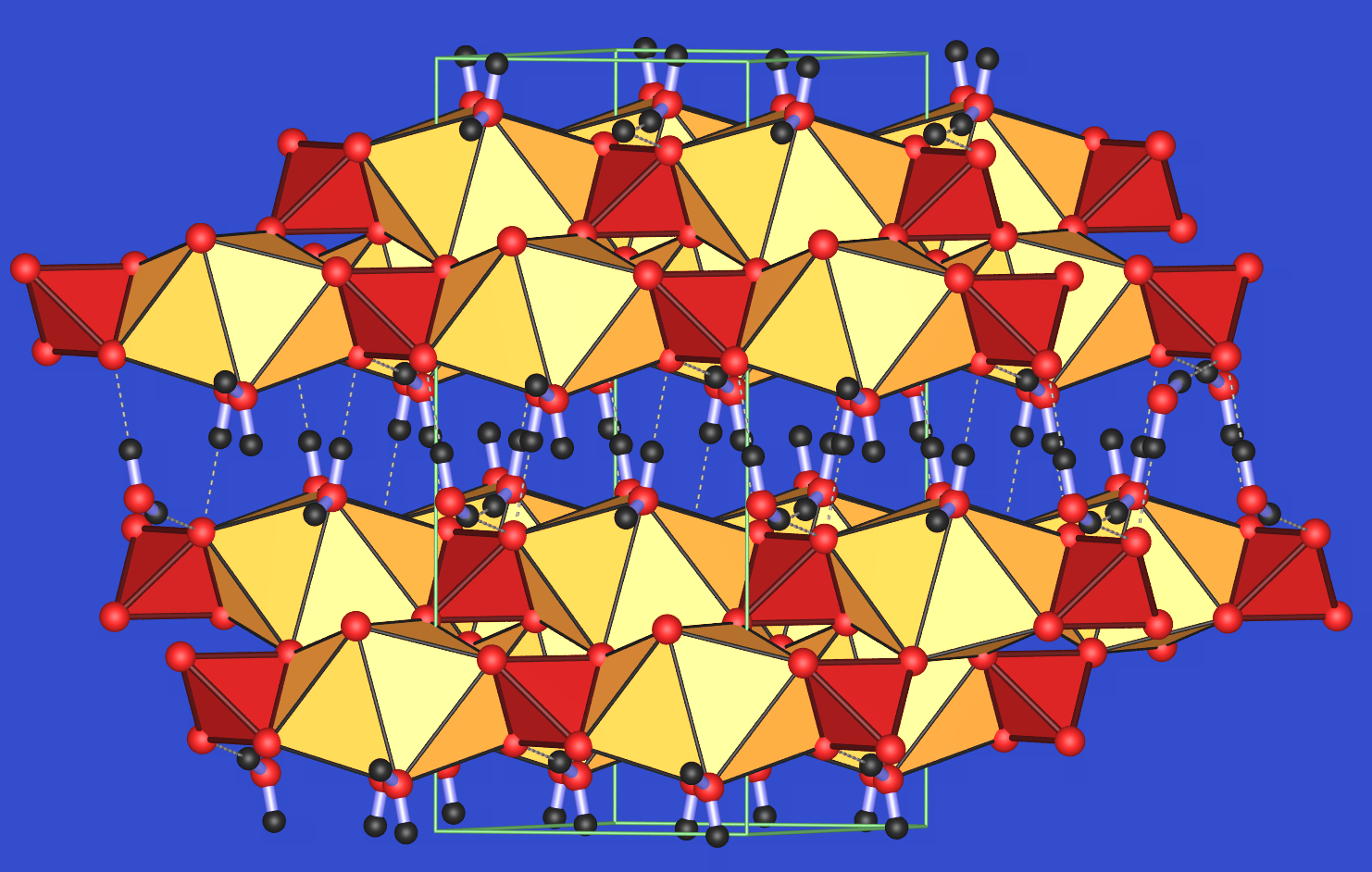
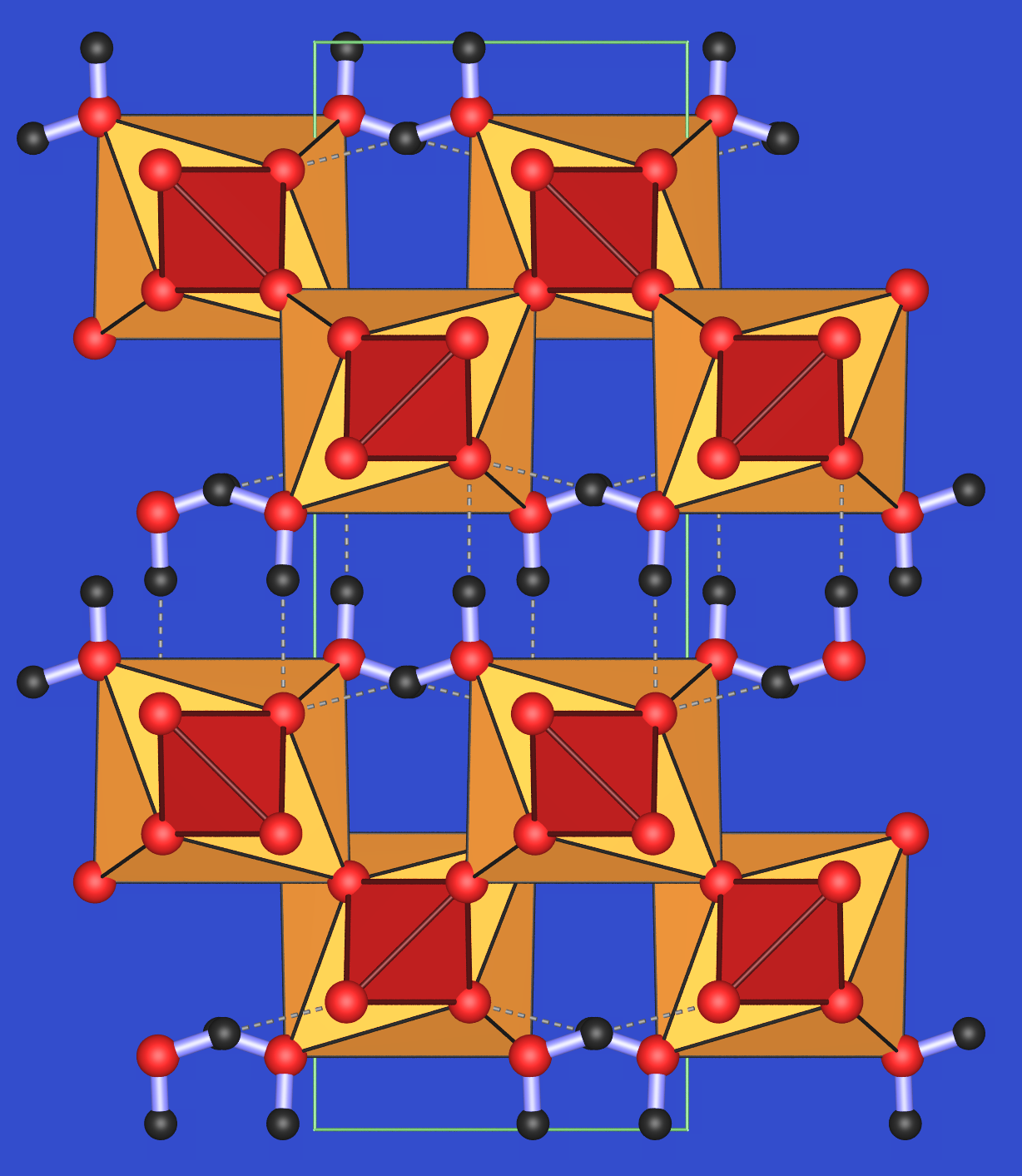
Abb. 3.7.7. Struktur von Gips: links: perspektivische Ansicht mit Spaltebene und Ketten; rechts: Projektion auf die Ketten=Nadel-Achse ‣VRML.
- SrSO4 (Coelestin, s. Foto des Minerals in Abb. 3.1.8.) ist schwerlöslich.
- BaSO4 (Schwerspat) ist sehr schwerlöslich,
fand früher Verwendung
als Anstrichfarbe und wird heute noch als Papier- und Kunststoff-Füllmittel,
zur Bohrlochspülung und als Röntgenkontrastmittel eingesetzt.
Vor der 'Entdeckung' von Rutil war es (mit ZnS als sog. Lithopone) ein wichtiges
Weisspigment.
Schwerspat wird bis heute noch in der Grube Oberwolfach im Kinzigtal abgebaut.
BaSO4 ist zwar sehr schwerlöslich, kann aber mit konzentrierter Schwefelsäure
wieder aufgelöst werden.
⚗ Fällung und Wiederauflösen von BaSO4 (30MB|MP4|H264)
Abbildung 3.7.8. zeigt ein Foto einer Schwerspat-Stufe, sogenannten 'Meissel-Spat' aus Oberwolfach/Kinzigtal.
Abb. 3.7.8. Schwerspat-Stufe (Meissel-Spat) aus Oberwolfach - Die Unterschiede in der Löslichkeit können zur Trennung/Nachweis
von Calcium und Strontium eingesetzt werden:
- Sr2+ + CaSO4 ⟶ SrSO4 + Ca2+
- Ba2+ + CaSO4 ⟶ BaSO4 + Ca2+
- Sr2+ + K2CrO4 (Essigsäure, pH=5) ⟶ keine Fällung
- Ba2+ + K2CrO4 (Essigsäure, pH=5) ⟶ BaCrO4 (Fällung)