Zur Herstellung des Zementklinkers wird CaCO3
mit Alumosilicaten (Tone, also Schichtsilicate) und Quarz bei 1450 oC im
Drehrohrofen gebrannt. Hierbei
kommt es zu in einer Folge mehrerer Reaktionen, bei
denen im wesentlichen der Alumosilicat-Verband der Tonminerale und von Quarz (kurz: 'S') durch CaO ('C')
zu Inselsilicaten (C3S, C2S) und Dialuminaten abgebaut wird. (Die gesamte
Reaktion ist also nichts weiter als ein gigantischer basischer Aufschluß):
In Abbildung 3.8.2. (oben links) ist die Zusammensetzung im Brennofen in Abhängigkeit von der
Brenntemperatur dargestellt. Im Einzelnen laufen die folgenden Prozesse ab:
- Ausgangsmaterial der Klinkerherstellung sind Calcit (CaCO3, in Abb. 3.8.2. in rosa),
Quarz (SiO2, bei den Betonleuten kurz 'S', gelb) und
Tonminerale (Schichtsilicate, z.B. Kaolinit mit der Zusammensetzung
Al2[Si2O5(OH)4], hellblau).
- Bis 700 oC (Vorwärmung) wird Wasser verdampft, die Tonminerale
werden zu 'aktiven' Oxiden wie Al2O3 dehydratisiert.
- Zwischen 700 und 1250 oC wird Calcit zersetzt. Es entsteht CaO (hellrosa, C), der
mit Quarz (S) und Aluminiumoxid (A) zu den ersten Klinkerphasen wie
Ca2SiO4 (C2S, braun),
Ca2Al2O5 (C2A) und
Ca12Al14O33 (C12A7, violett) reagiert.
- Zwischen 900 und 1250 oC ist die Bildung von Ca2SiO4 (C2S)
abgeschlossen. Es entsteht ferner eine Schmelze aus
Ca3Al2O6 (C3A).
- Zwischen 1250 und 1450 oC entsteht aus CaO (C) und
Ca2SiO4 (C2S) die Hauptmenge des Klinkers
mit der Zusammensetzung Ca3SiO5=
Ca3[SiO4](0) (C3S, braun),
also ein Orthosilicat-Oxid.
- Die Aluminium-Komponente ist am Ende des Brennvorgangs 'C4A', d.h.
mit Ca4[Al2O7] ein Dialuminat.
- Links zur Klinkerherstellung:
 |
| Abb. 3.8.2. Klinkerherstellung (oben)
und Phasenentwicklung beim Ansteifen und Aushärten von Portlandzement (unten) (Details s. Text)
‣SVG
|
Der eigentliche Zement wird dann durch Mischung des Klinkers mit Gips, Wasser und Sand erhalten.
Portlandzement besteht z.B. aus
Ca2[SiO4] (C2S, 'Belit') und
Ca3[SiO4](O) (C3S, 'Alit')
(beides Inselsilicate, s. die Strukturen in Abb. 3.8.3.) im Verhältnis 1:2.
Unter Beton versteht man Zement, der mit Kies oder Schotter versetzt ist.
 |
 |
| Abb. 3.8.3. Kristallstrukturen von Alit (links) und Belit (rechts).
(rote Kugeln: Oxid-Ionen; graue Polyeder: Orthosilicat-Anionen; gelbe Kugeln: Ca2+-Ionen;
gelbe Polyeder (bei Alit): Ca-Koordinationspolyeder um die isolierten Oxid-Ionen).
|
Die Verfestigung erfolgt in mehreren Schritten und ist ein komplizierter Prozess.
Hierbei spielt der Wassergehalt der gebildeten kristallinen und amorphen Materialien eine sehr entscheidende
Rolle (Bedeutung des 'CSH'-Phasendiagramms CaO - SiO2 - H2O, Abb. 3.8.5.).
Bei der Verarbeitung unterscheidet man in 'Ansteifen' (erste Verfestigung durch Bildung
nadelförmiger Sulfat/Aluminate, Ettringite, s. Abb. 3.8.5. links) und das
abschliessende Aushärten über Tage/Monate
(Reaktion der Inselsilicate zu Hydroxid-haltigen Silicaten, s. CSH-Phasen) (s. Abb. 3.8.2. unten).
Die CSH-Phasen sind röntgenamorph mit Teilchengrößen um die 100 nm.
Auch hier wieder (vgl. Abb. 3.8.2.) einige Details zu den (zeitabhängig) ablaufenden chemischen Reaktionen:
- Direkt nach dem Anteigen des Zements mit Gips und Wasser hydrolysieren vor allem die
Aluminate (alkalische Reaktion, pH 12!) und bilden auf den Aluminat-Partikeln
mit dem Gips nadelförmige Ettringit-Kristalle
(Ca3Al2O6.3 CaSO4. 32
H2O; Trisulfat; besser:
Ca3[Al(OH)6]2(SO4)3.27 H2O). Diese
Kristallite verhindern die weitere rasche Auflösung des Aluminates.
Sie reagieren aber langsam mit dem Ca-Aluminat weiter zum Monosulfat
(Ca3Al2O6 . CaSO4. 12 H2O bzw.
wieder besser: Ca4[Al(OH)6]2(SO4).6 H2O),
wobei die Nadeln wachsen und die Masse sich verfestigt.
- Die Ettringit-Struktur besteht aus kationische Säulen
[Ca3Al(OH)6(H2O)12]3+,
die von den Sulfatanionen und weiteren
Kristallwassermolekülen (im Kristall fehlgeordnet) umgeben sind.
 |
| Abb. 3.8.4. Kristallstruktur von Ettringit
Ca6Al2(SO4)3(OH)3(H2O)27
= [Ca3Al(OH)6(H2O)12]2(SO4)3 * 3 H2O
(rote Kugeln: Oxid-Ionen; rote Polyeder: Sulfat-Ionen;
gelbe Polyeder: Ca2+-Koordinationspolyeder;
grüne Polyeder: Al-Koordinationspolyeder). Man erkennt die
kationischen Säulen aus den Al/Ca-Koordinationspolyedern entlang der trigonalen c-Achse, die
auch der Nadelachse der Kristalle entspricht.
‣VRML
|
- Die Orthosilicate Ca3[SiO4](O) (über Tage) und Ca2[SiO4]
(über Monate) binden beim Aushärten
zu sogenannten CSH-Phasen ab, die i.A. röntgenamorph sind.
- 2 C3S + 6 H ⟶ C3S2H3 + 3 CH
- 2 C2S + 4 H ⟶ C3S2H3 + CH
Dabei wird also Ca(OH)2 (CH) frei, das als blockartige Kristalle (Portlandit, Abb. 3.8.5.)
kristallisiert.
Es sorgt dafür, dass der Beton sehr basisch bleibt und damit der
zur Verstärkung einbetonierte Stahl nicht korrodiert. Der Stahl muss
also vom Beton immer gut überdeckt sein.
Beim Zutritt von CO2 erfolgt Karbonisierung (auch Kalktreiben genannt)
und es entsteht wieder Calcit (unter Volumenvergrößerung!).
Dadurch kann sich der pH des Betons verringern. Kalktreiben kann aber auch erwünscht sein,
weil sich der Beton dadurch weiter verdichtet, die Porosität also abnimmt.
 |
 |
Abb. 3.8.5. Elektronenmikroskopische Aufnahmen
von Ettringit-Nadeln (links) und Portlandit [Ca(OH)2] (rechts).
(Aufnahmen: Dr. Michael Schwarz)
|
- Externe Links zum Beton und zum Verfestigen/Erhärten:
- Wer es ganz genau wissen will, betrachtet dazu das ternäre Diagramm der CSH-Phasen in Abb. 3.8.5,
also das System mit den Eckpunkten CaO, H2O und SiO2
 |
| Abb. 3.8.6. Übersicht CSH-Phasen
‣SVG |
Durch die Hydrolyse einer Mischung der Inselsilicate C2S und C3S
wird zuerst das Gebiet der amorphen CSH-II-Phasen erreicht (gelbes Sechseck in Abb. 3.8.5).
Später
scheidet sich Calciumhydroxid (Portlandit) aus (s.o.) und es bleiben CSH-I-Phasen zurück, die
ebenfalls amorph sind. Die dicht benachbarten kristallinen Tobermorite (z.B. 10: grün,
oder Nr. 13 in Abb. 3.8.7.) geben
Hinweise auf die im amorphen Beton vorliegenden Silicat-Bauverbände:
Die Tetraeder sind also entweder mit zwei oder mit drei weiteren
Silicattetraedern verknüpft; es entstehen Silicat-Teilverbände, die
zwischen Ketten- und Bandsilicaten liegen. Dazu ist in Abbildung 3.8.7.
als Beispiel die Struktur von Clinotobermorit, Ca5[Si6O17](H2O)5,
(Nr. 13 in Abb. 3.8.6.) gezeigt.
 |
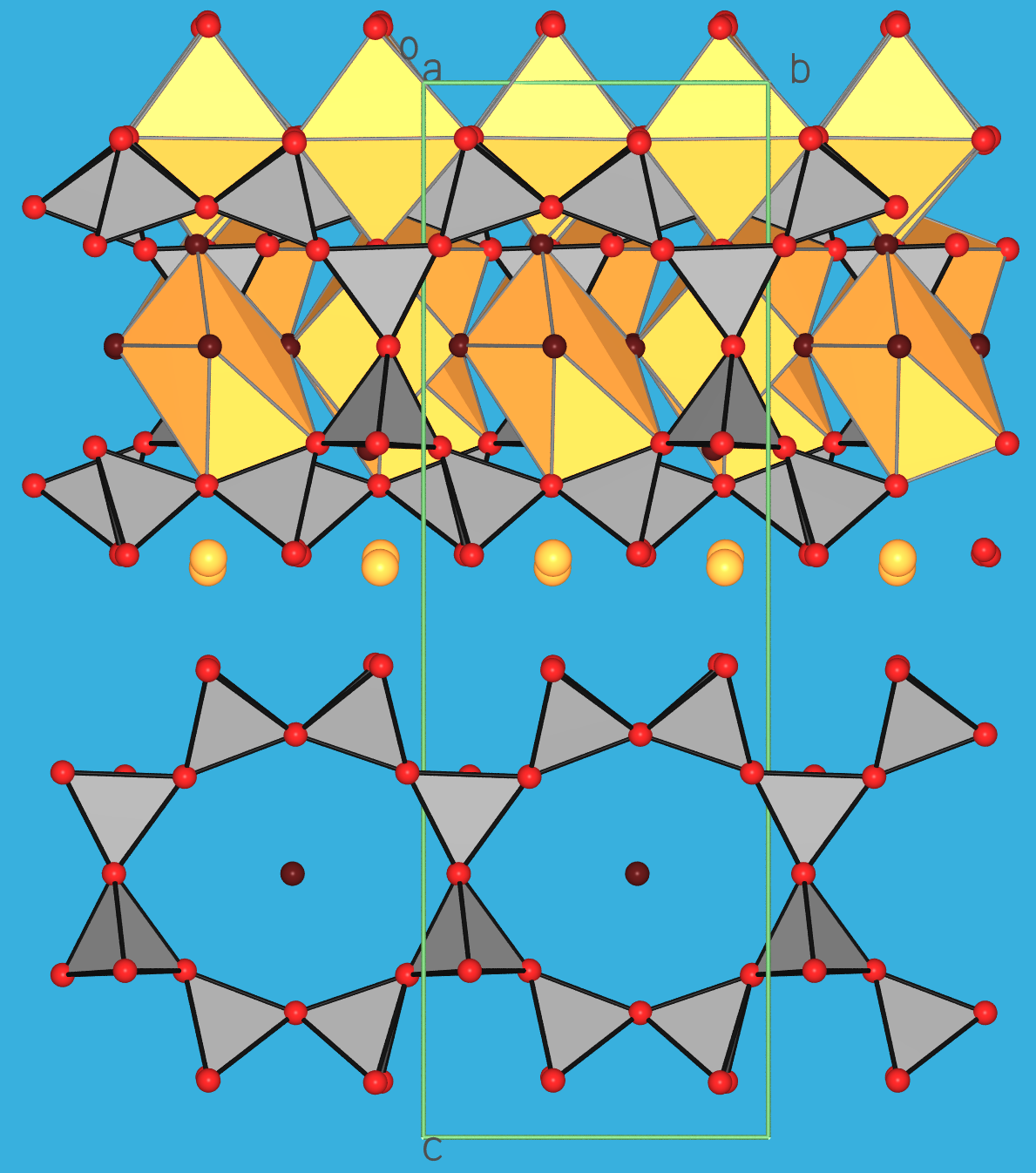 |
| Abb. 3.8.7. Kristallstruktur
von Clinotobermorit C5S6H5,
Ca5[Si6O17](H2O)5 (Nr. 13 in Abb. 3.8.6) in zwei verschiedenen Ansichten
(rote Kugeln: Oxid-Ionen; dunkelrote Kugeln: O-Atome von Wassermolekülen;
graue Polyeder: Silicat-Tetraeder;
gelbe Kugeln: Ca2+-Ionen;
gelbe Polyeder: Ca-Koordinationspolyeder).
‣VRML
|
- Weitere Literatur: Chiuz 7, 19-24 (1973) bzw. im Ullmann S. Sprung: Cement and Concrete.