- AlF3 kristallisiert im
VF3-Typ (Abb. 4.3.1.), der
mit dem einfachen kubischen ReO3-Typ (Abb. 4.3.2. links)
eng verwandt ist. Die Oktaeder sind im unverzerrten ReO3-Typ über lineare
Al-F-Al-Brücken verknüpft, beim VF3-Typ ist dieser Winkel
durch die Oktaederdrehung verkleinert und die große kuboktaedrische Lücke in Zentrum
der kubischen Elementarzelle von ReO3 fehlt. Ist diese Lücke mit einem
weiteren grossen Kation besetzt, resultiert der ebenfalls praktisch extrem wichtige
Perowskit-Typ
(CaTiO3).
Der VF3-Typ
entspricht einer kubisch dichtesten Kugelpackung von Fluorid-Ionen, in denen jede Schicht
zu 1/3 mit Vanadium(III)-Kationen besetzt ist.
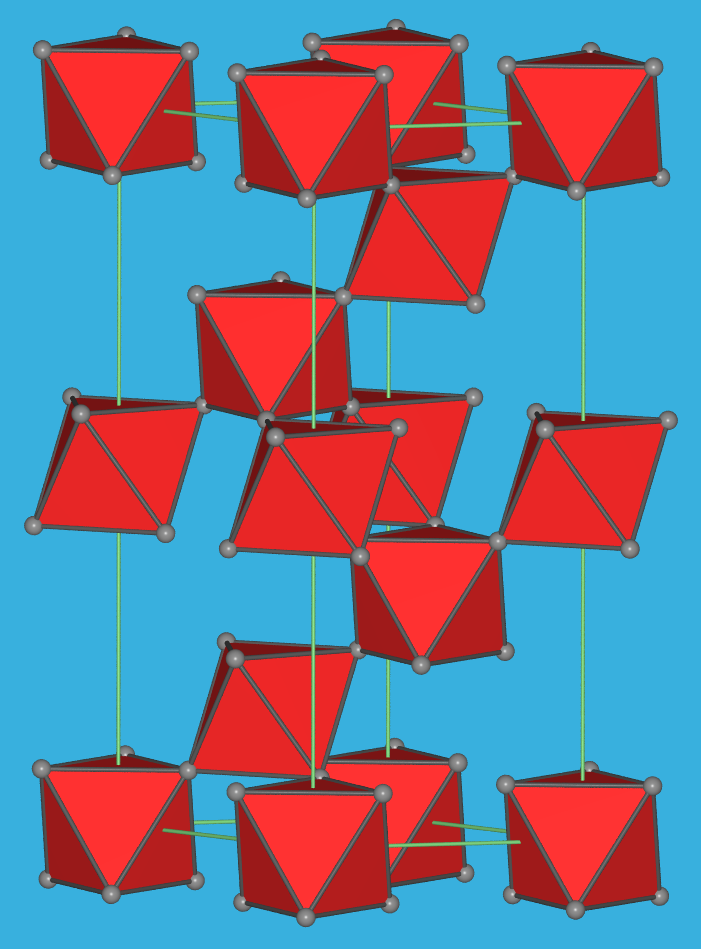
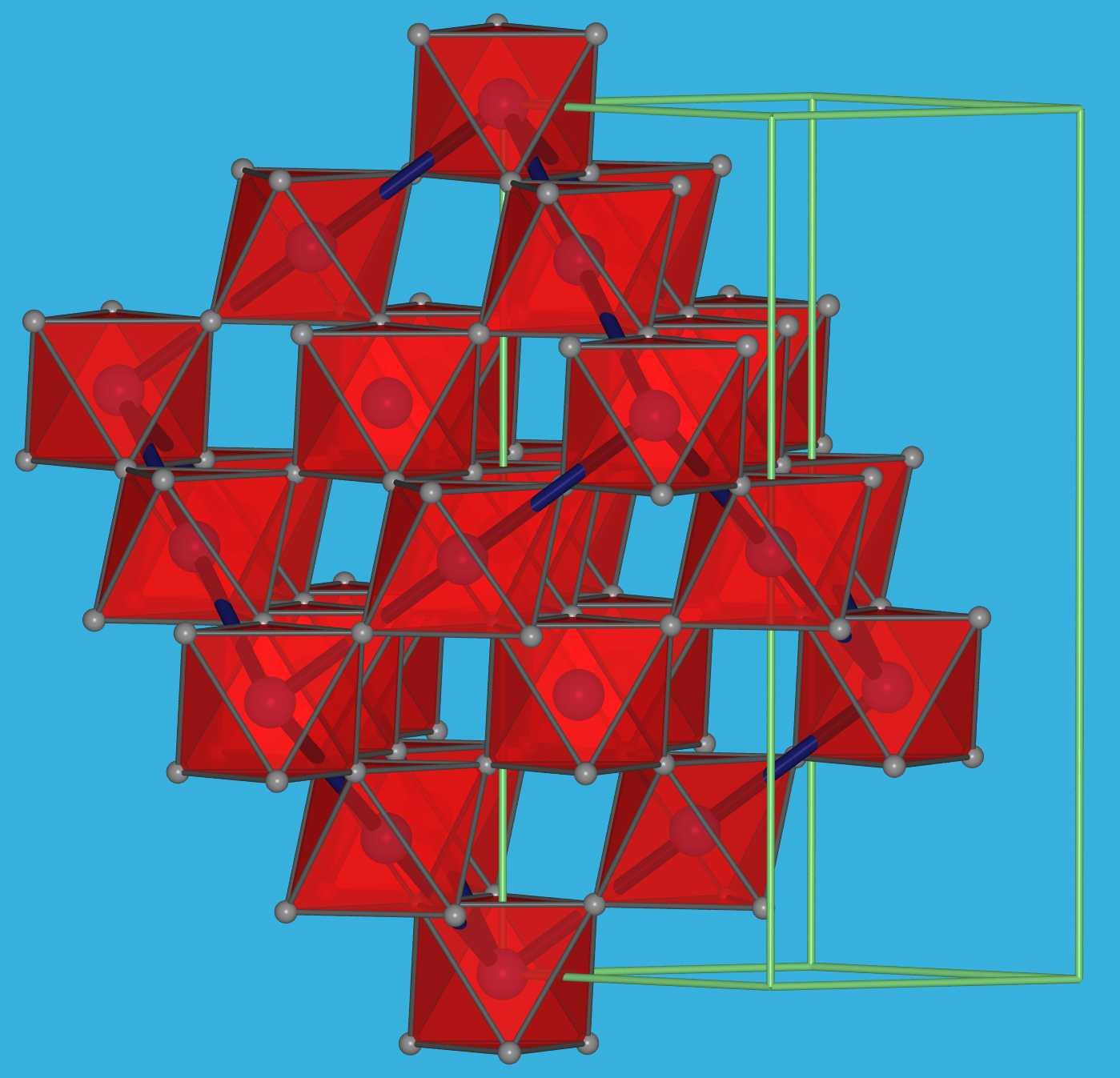
Abb. 4.3.1. AlF3-Struktur (VF3-Typ): Links: Darstellung der [AlF6]-Oktaeder in der hexagonalen Aufstellung der rhomboedrischen Elementarzelle ‣VRML. . Rechts: Darstellung nur der Polyeder in der rhomboedrischen Elementarzelle, die sehr nahe an einem Würfel ist (dunkelblaue Kanten). So wird deutlich, dass es sich bei VF3 um eine 2x2x2-Verzerrungsvariante des ReO3-Typs handelt ‣VRML. Struktur Raumnetz Schichten Ketten isolierte Oktaeder statische Abb. 

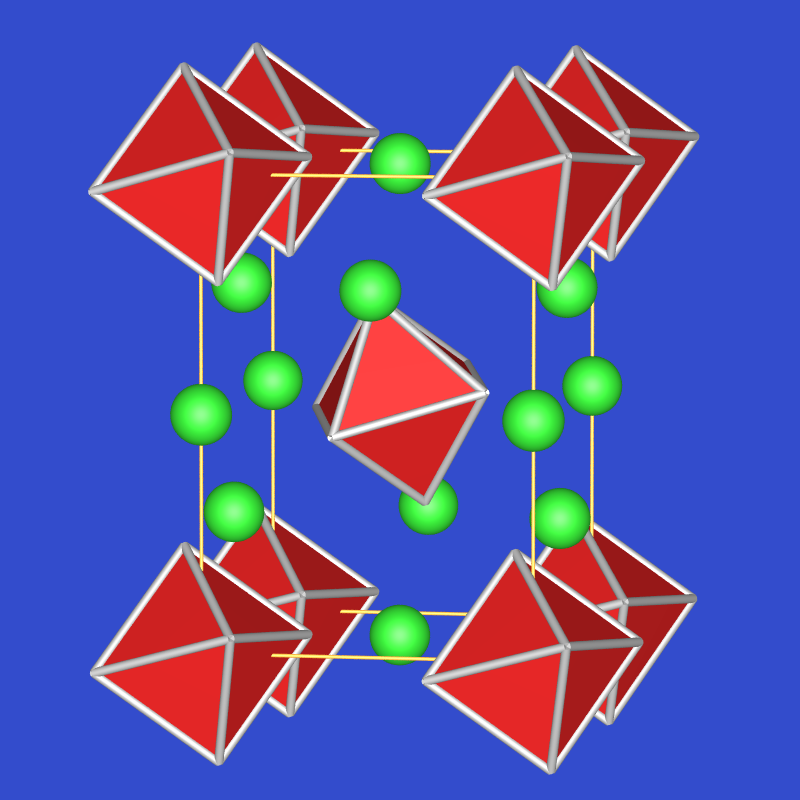
VRML I AlF3 (ReO3-Typ) Tl[AlF4] Tl2[AlF5] Na3[AlF6]
Abb. 4.3.2. Strukturprinzipien der Fluorido-Aluminate - Dagegen ist AlCl3 leicht flüchtig, sublimiert bei 129 oC und
schmilzt nur unter Druck. Im Festkörper ist es ionisch aufgebaut und kristallisiert in
der
AlCl3-Struktur (auch CrCl3-Typ genannt).


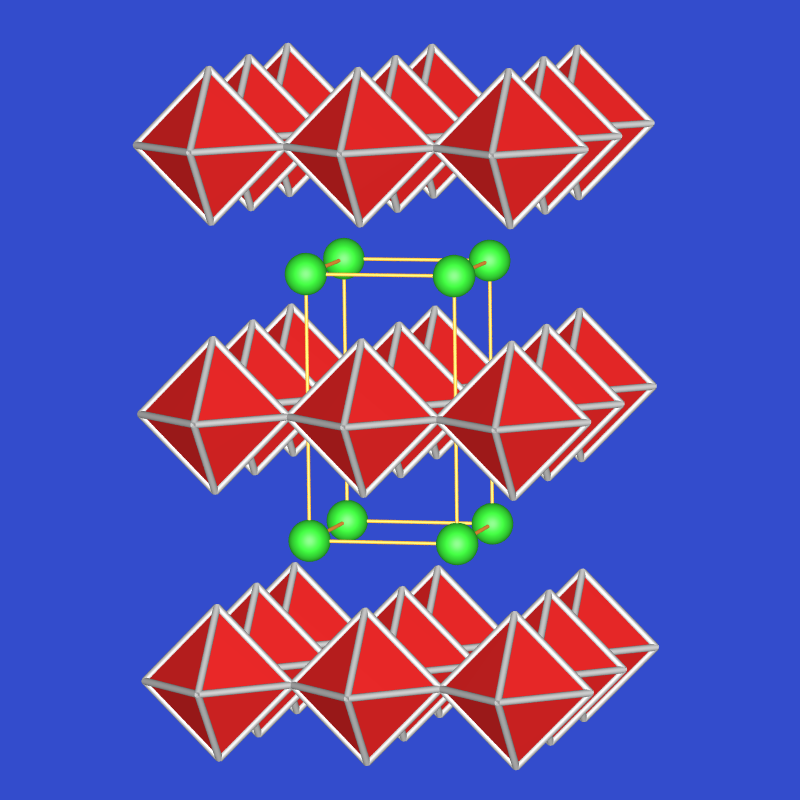
Abb. 4.3.3. AlCl3-Struktur (CrCl3-Typ) ‣VRML Abb. 4.3.4. AlCl3-Struktur: eine Schicht ‣VRML Reines wasserfreies AlCl3 ist in Ether löslich, das Hydrat AlCl3 * 6 H2O ist dagegen in diesem Lösungsmittel unlöslich. mit Wasser reagiert es stark exotherm (Δ H = -330 kJ/mol):
AlCl3 + 6 H2O ⟶ [Al(H2O)6]3+ + 3 Cl- Das Produkt bildet beim Erhitzen und Kondensation der [AlO6]-Oktaeder schließlich Korund:[Al(H2O)6]Cl3 ⟶ Al2O3 + 3 HCl ⚗Löslichkeit von Aluminiumtrichlorid (18MB|MP4|H264) Im Dampf und in organischen Lösungsmitteln bildet Aluminiumtrichlorid dimere Baugruppen (Doppeltetraeder) Al2Cl6, die die Lewis-Säure- und Lewis-Base-Funktion von AlCl3 zeigen. AlCl3 wird wegen seines Lewis-Säure-Charakters als Katalysator in organischen Synthesen eingesetzt. Bekannte Reaktionen sind z.B. die sogenannten Friedel-Crafts-Acylierungen und -Alkylierungen. In der Petrochemie ist AlCl3 inzwischen durch Zeolithe vollständig verdrängt.
- AlBr3 und AlI3 liegen auch im Festkörper als dimere Moleküle M2X6 vor.