Vorlesung Chemie der Metalle
4.Triele (3. Hauptgruppe, Erdmetalle, Bor-Gruppe: Al, Ga, In, Tl)
4.2. Elementare Metalle
Elemente und ihre Strukturen
Die Elemente Aluminium, Gallium, Indium und Thallium sind in den Abbildungen 4.2.1 bis 4.2.4 zu sehen.
Thallium ist bereits relativ luftempfindlich, wir haben es daher unter Argon in einem
Schnappdeckelglas fotografiert (Abb. 4.2.4.). An Luft bekommt es schnell einen gelblichen Oxidüberzug.
 |
 |
 |
 |
| 4.2.1. Aluminium |
4.2.2. Gallium |
4.2.3. Indium |
4.2.4. Thallium |
- Aluminium (Abb. 4.2.1.) kristallisiert in einer kubisch
dichtesten Kugelpackung (f.c.c., CN=12)
und ist entsprechend ein recht duktiles (Leicht)-Metall (s.u.).
- Gallium hat nicht nur besondere Eigenschaften (s.u.), sondern auch
eine besondere Struktur (s.a. hier):
In der Struktur ist jedes Ga-Atom von sieben anderen Atomen koordiniert, wobei ein Nachbar
jedoch sehr nah ist, so dass - ähnlich wie bei Quecksilber - bereits im
Festkörper eine Art Hantelbildung vorliegt.
Die elektronische Struktur
(s. DOS in Abb. 3.2.6.) zeigt, dass ein deutliches Minimum am Fermi-Niveau, eine sog.
Pseudo-Bandlücke vorliegt. Dies ist ebenfalls ein Hinweis auf kovalente Bindungsanteile.
Gallium schmilzt, wie z.B. auch Wasser, unter Volumenkontraktion, hier um 3.4%.
- Indium kristallisiert in einer tetragonal verzerrten f.c.c.-Struktur.
Die Verzerrung bewirkt, dass vier nahe und acht weiter entfernte Nachbarn vorliegen
(s.a. hier, mit C-Filmchen).
- Thallium (Abb. 4.2.4.) bildet die hexagonal dichteste Kugelpackung
(h.c.p.) mit der Koordinationszahl 12.
Zur Darstellung der Elemente:
- Zur Darstellung von Aluminium wird im wesentlichen eine
Elektrolyse von Al2O3 in geschmolzenem Kryolith, Na3AlF6,
durchgeführt, wobei das Al2O3 aus Bauxit,
AlO(OH), hergestellt wird.
Da natürliche Aluminium-Quellen bis zu 30% Fe2O3 bzw. SiO2
enthalten, verläuft die Aluminiumherstellung in zwei Schritten, der Gewinnung des reinen Oxids
und der eigentlichen Schmelzflußelektrolyse:
- Zur Herstellung des reinen Oxids können zwei verschiedene Aufschlußverfahren
verwendet werden:
- Der sog. nasse Aufschluß, auch Bayer-Verfahren genannt,
ist heute das Hauptverfahren. Dabei können nur Kieselsäure-arme Bauxite eingesetzt werden
(s.u.). Bei diesem Aufschlußverfahren wird die Gleichgewichtslage ausgenutzt:
Al(OH)3 + NaOH ⥂ Na[Al(OH)4]
Fe(OH)3 + NaOH ⥃ Na[Fe(OH)4]
mit anderen Worten: Aluminiumhydroxid kann aufgrund der amphoteren Eigenschaften
im Alkalischen gelöst werden. Technisch sind damit folgende Teilschritte
notwendig:
- Der eigentliche Aufschluß wird in einem Autoklaven mit 35 %-iger NaOH
bei 5 bis 7 bar und 150 oC durchgeführt. Dabei bleibt
schwerlöslicher 'Rotschlamm', eine Mischung aus
Fe(OH)3 und Na2[Al2SiO6] . 2 H2O
(Al-Verlust bei Anwesenheit von Kieselsäure) zurück, Aluminium geht entsprechend
der obigen Gleichung als Hydroxidokomplex in Lösung.
- Abfiltrieren des Rotschlamms
- Rückreaktion zum Hydroxid entweder durch
- Verdünnung
- Temperaturerniedrigung und Entspannung (z.B. auf 60 oC und Normaldruck)
- Zusatz von Kristallisationskeimen (Hydragillit bzw. Bayerit)
- Brennen bei 1400oC im Drehrohrofen
- Beim heute kaum noch verwendeten trockenen Aufschluß wird ebenfalls
der amphotere Charakter von Al2O3 ausgenutzt. Die
Gesamtreaktion ist hier:
Al2O3 + Na2CO3 ⟶ 2 NaAlO2 + CO2
Die Teilschritte:
- Eisenhaltiger Bauxit wird in einer Na2CO3-Schmelze
aufgeschlossen. Produkte dieses Prozesses sind NaAlO2 und NaFeO2.
- Der Schmelzkuchen wird mit H2O versetzt:
NaAlO2 + 2 H2O ⟶ Na[Al(OH)4] (löslich)
NaFeO2 + H2O ⟶ Fe(OH)3 ⬇ (unlöslich)
und
- das unlösliche Fe(OH)3 abfiltriert.
- Nach Ausfällen mit CO2 und anschließendem Glühen des Hydroxids
entsteht reiner Korund:
Na[Al(OH)4] + CO2 ⟶ Al(OH)3 ⟶ Al2O3
 |
 |
| 4.2.5. Al-Herstellung nach Heroult I |
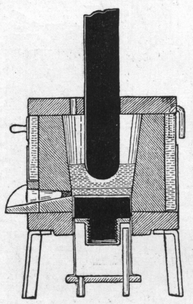
4.2.6. Al-Herstellung, historisch II |
-
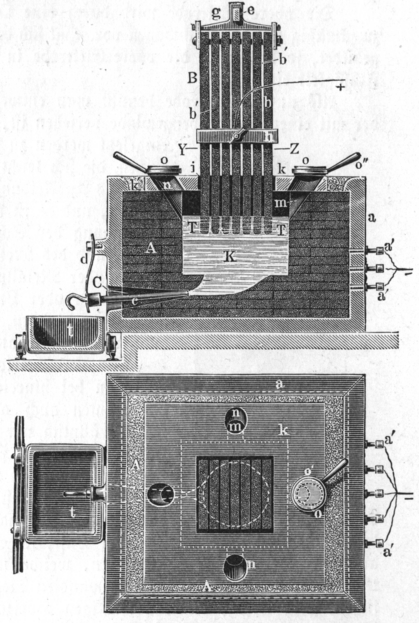
Die Schmelzflußelektrolyse (nach Heroult und Hall, 1886, s. Abb. 4.2.5. und 4.2.6.) wird aus einer
eutektischen Mischung von Al2O3 mit 80% Kryolith Na3AlF6
unter Zugabe weiterer Zusätze wie CaF2, LiF und AlF3 durchgeführt.
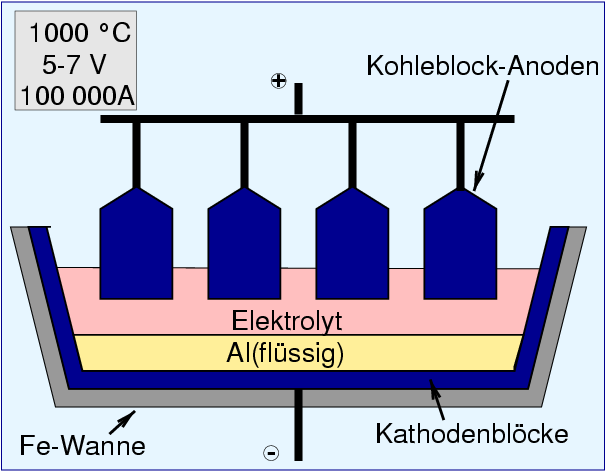
Diese eutektische Mischung (Schema in Abb. 4.2.7. in rosa) hat einen Schmelzpunkt von 935 oC und eine Dichte von
2.15 g/cm3, d.h. das Aluminium-Metall (Abb. 4.2.7. in gelb) ist etwas schwerer als
die Schmelze (Dichte 2.35 g/cm3 bei 900 oC).
In eine Eisenblechwanne, die mit Kohleblöcken als Kathode unten und an den Seiten
ausgekleidet ist, sind als Anode geschaltete Kohleblöcke,
die während der 'Elektrolyse' abbrennen, eingetaucht.
Die Bruttoreaktion ist:
Al2O3 + 3 C ⟶ 2 Al + 3 CO
Gearbeitet wird bei einem Stromfluß von ca. 10 000 bis 30 000 A
und einer Badspannung von 5 V. Theoretisch wären zwar nur 2.2 V
erforderlich, die zusätzlich zugeführte Energie dient dazu, das Bad flüssig zu halten.
Al2O3 wird kontinuierlich nachgefüllt, das Aluminium
wird alle ein bis zwei Tage abgesaugt.
 |
| Abb. 4.2.7. Aluminium-Herstellung (schematisch)
‣SVG
|
Der Gesamtverbrauch pro t Al liegt bei
- 4 t Bauxit,
- 0.5 t Kohle,
- 4 kg Kryolith und
- 15 000 kWh Strom.
Damit ist unmittelbar klar, dass Al-Recycling sehr sinnvoll ist, da nur 5% des Energieaufwands
der Neudarstellung zur Aufarbeitung aufgewendet werden müssen.
Mit der Entwicklung des Herstellungsverfahrens haben sich die Preise von Aluminium
extrem verändert:
- 1852: 1000 Dollar/kg
- 1895: 1.1 Dollar/kg
- 1964: 0.5 Dollar/kg
- 2022: 2.8 Euro/kg (aktuell gerade heftige Preissteigerung wegen Energiebedarf!)
2014 wurden weltweit insgesamt 108 Millionen Tonnen
metallisches Aluminium (primär und sekundär) hergestellt.
Die Produktionsmenge von Primär-Aluminium lag 2017 bei ca. 60 Millionen Tonnen.
- Gallium entsteht als Nebenprodukt der Bauxit-Aufarbeitung und
kann durch Elektrolye des Hydroxids gewonnen werden.
- Indium und Thallium werden aus den Röstgasen
von Pb-, Zn-, Fe- und Cu-Sulfiden gewonnen.
Eigenschaften und Verwendung
Externe Links zum Aluminium











