- Die α-Modifikation von Al2O3, der
sogenannte Korund (oder Tonerde), ist sehr hart (Mohs-Härte 9)
und verschleissfest und hat einen hohen Schmelzpunkt von 2045 oC.
Auch ist sie chemisch sehr inert.
Aufgrund dieser Eigenschaften werden α-Al2O3-Keramiken
praktisch vielfach verwendet als:
- Hochtemperatur-Werkstoff (z.B. Tiegelmaterialien)
- Schleifmittel, Düsen, Fadenführung, Schneidgeräte, Dichtringe ....
.... etc etc etc ... s. Abbildung 4.4.1.
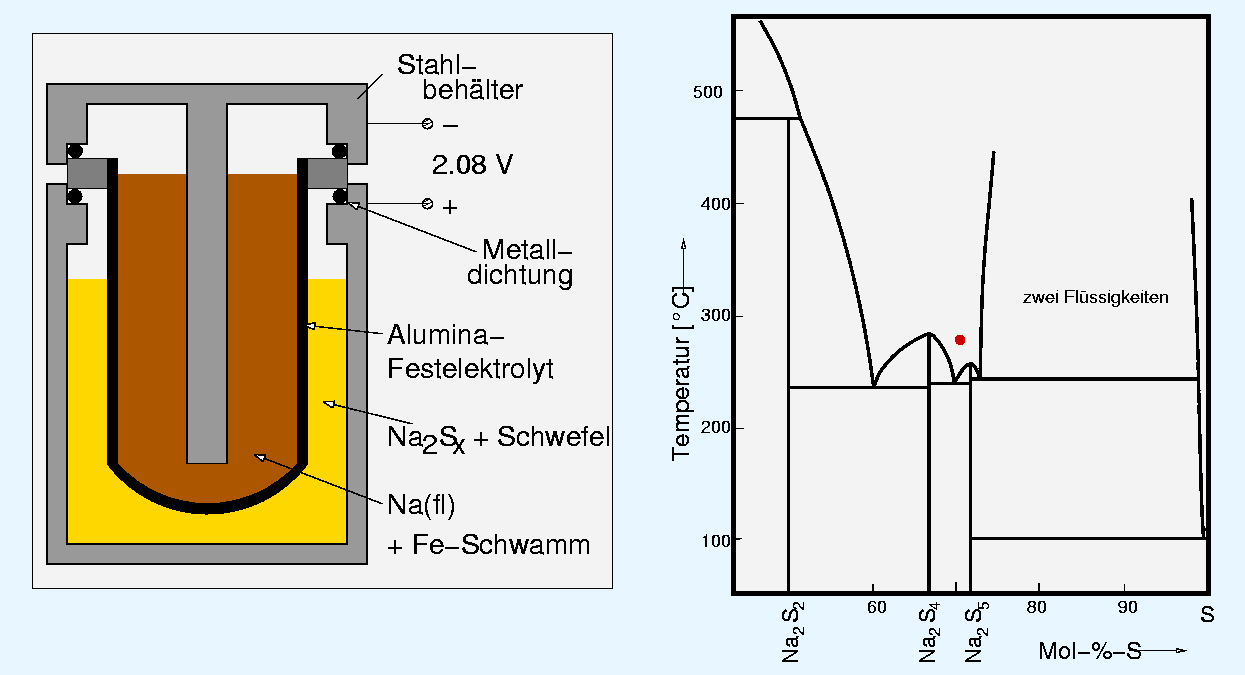
4.4.1. Keramische Bauteile aus Korund - Substrate für die Elektronik, s. Abbildung 4.4.2.


Keramische Substrate, z.T. metallisiert (hergestellt durch Foliengiessen) Einkristallscheibe aus Korund ('Saphir-Wafer', Dank an das IAF Freiburg)
4.4.2. Keramischer bzw. Einkristalliner Korund als Substrat für die Elektronik - Fasern (z.B. zur Metallverstärkung)
- Korund ist auch in klassischen Keramiken enthalten und entsteht bei der Herstellung von Tonwaren und Porzellan aus Aluminiumsilicaten, s. hierzu einen Auszug aus einem Seminar-Vortrag.
- Rubin (durch CrIII rot)
- Saphir (durch FeII/III bzw. TiIV blau)
- 'orientalischer Smaragd' (durch CrIII, VIII grün) (Dagegen ist echter Smaragd ein Cr-dotierter Beryll Be3Al2[Si6O18]).
- 'orientalischer Amethyst' (durch CrIII, TiIV violett gefärbt). (Dagegen ist echter Amethyst eine Quarz-Varietät).
 |
 |
| Rubin (aus Verneuill-Züchtung) | natürlicher Saphir |
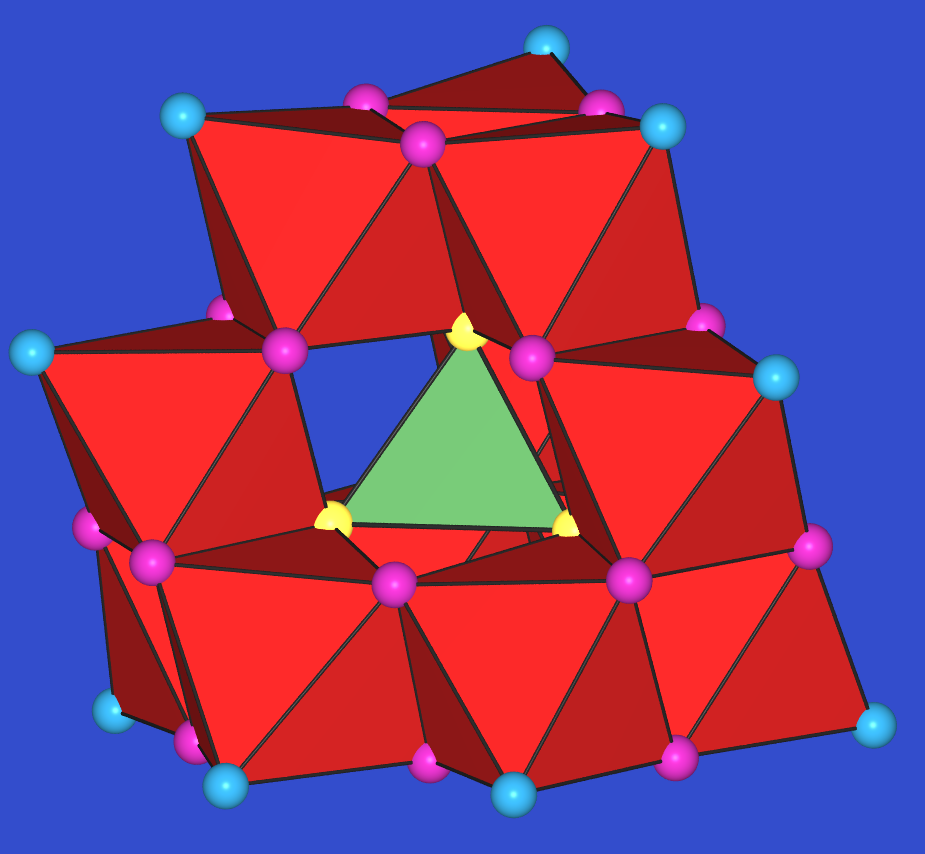
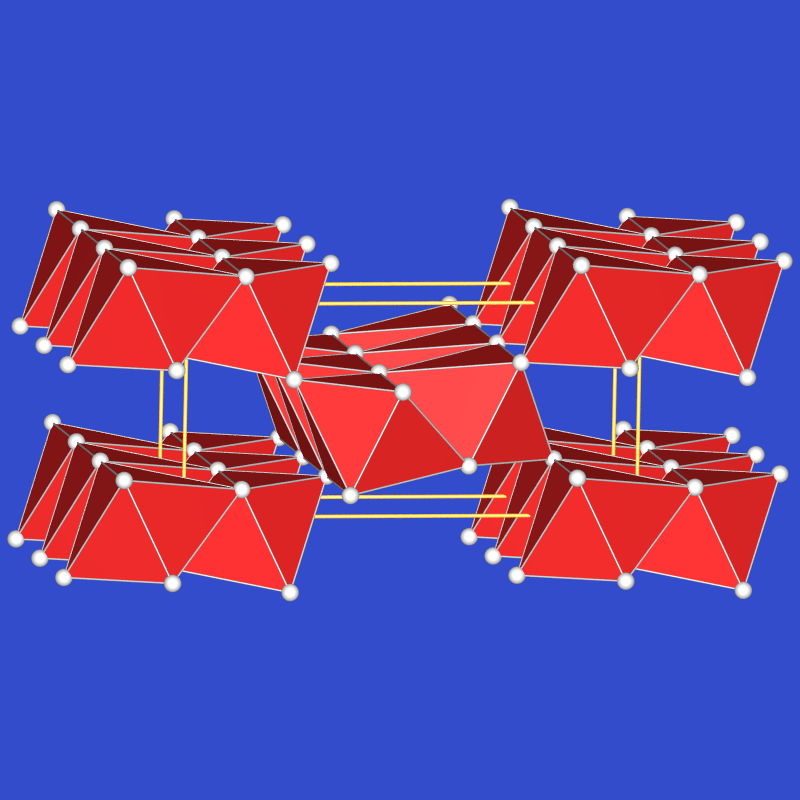
In der Kristallstruktur von Korund (s. Abb. 4.4.4)
bilden die Oxid-Ionen eine hexagonal dichte Kugelpackung.
2/3 aller Oktaederlücken aller Schichten
sind besetzt (eine Schicht),
so dass in der Gesamtstruktur
Doppel aus zwei über eine Fläche verknüpften Oktaedern entstehen.
Der Ilmenit FeTiO3 ist eine Ordnungsvariante (Überstruktur) des
Korunds, in der die Al-Positionen regelmäßig und alternierend von Eisen und
Titan besetzt sind.
 |
 |