- AsF3, AsCl3, AsBr3, SbCl3 und
SbBr3 sind typische monomere Moleküle
mit ψ-tetradrisch koordiniertem Pentel und einem Winkel X-M-X
von 96 bis 100 o (Lone-Pair-Kationen, Gillespie-Nyholm-Regeln, Abb. 6.3.1.).
Es handelt sich um Flüssigkeiten bzw. niedrig schmelzende Festkörper.

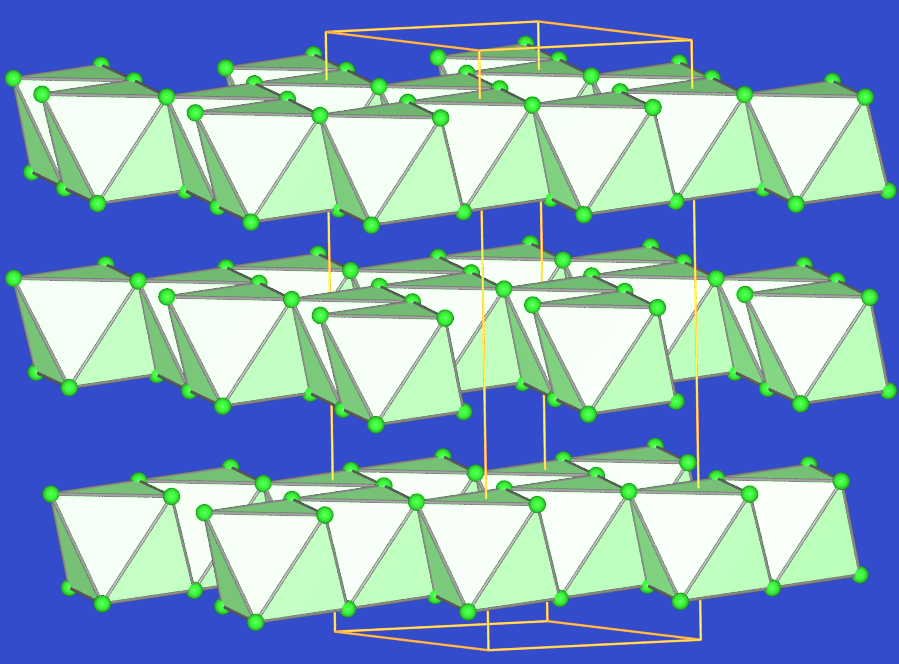
Abb. 6.3.1. AsBr3 ‣VRML Abb. 6.3.2. BiI3 ‣VRML: eine Schicht - AsI3, SbF3, AsI3 und alle Bi-Trihalogenide sind Festkörper. BiI3 hat eine charakteristische Schichtstruktur, in der die Iodid-Ionen hexagonal dicht gepackt sind und die Oktaederlücken jedes zweiten Schichtzwischenraums zu 2/3 gefüllt sind.
Bei den Strukturen gibt es ebenfalls wieder zwei Gruppen:
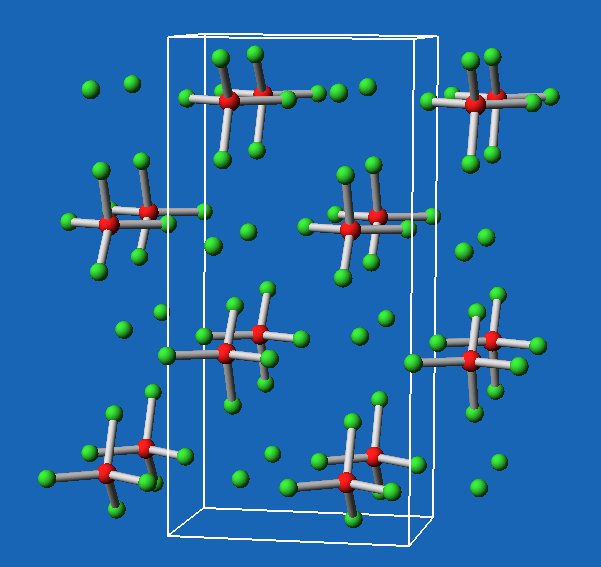
- Die Molekülverbindungen wie z.B. AsF5 bestehen aus trigonal bipyramidal aufgebauten Monomeren (Abb. 6.3.3.).
- Übergang: SbF5 ist eine hochviskose Flüssigkeit, die aus Oktaederketten aufgebaut ist, im Festkörper liegen Tetramere vor.
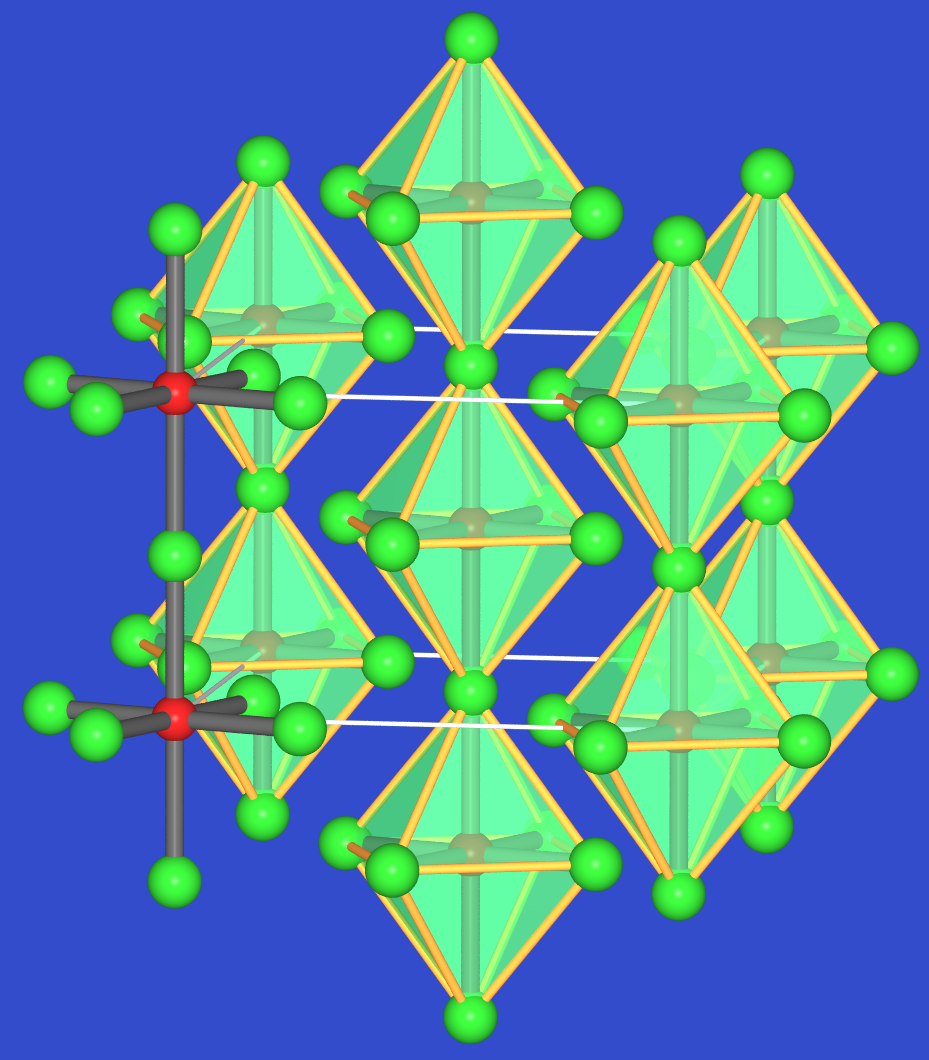
- Die typischen Festkörper wie z.B. BiF5 enthalten Ketten eckverknüpfter Oktaeder und kristallisieren dementsprechend in Form langer weißer Nadeln.
 |
 |
 |
| Abb. 6.3.3. AsF5 ‣VRML | Abb. 6.3.4. PBr5 ‣VRML | Abb. 6.3.5. BiF5 ‣VRML |
Eigenschaften
Die meisten Pentahalogenide sind hochwirksame Fluorierungs- und Oxidationsmittel, erwartungsgemäß
am heftigsten reagiert BiF5, das z.B. mit Wasser explosionsartig unter
Bildung von O3 und OF2 reagiert.
Die Neigung zur Komplexbildung ist bei allen Verbindungen groß, entsprechende
Anionen wie z.B. SbF6- sind sehr stabil.
Außer den monomeren Halogeno-Pentelaten sind auch viele höher kondensierte
wie z.B. das Tetramere [Sb4F16]4- bekannt.
Diese Anionen sind für die Kristallisation von niedrig geladenen Metallkomplexen oft
sehr günstige Gegenionen (sog. Schwach-koordinierende Anionen, WCA).
SbF5 wird zur Herstellung von Supersäuren verwendet:
 |
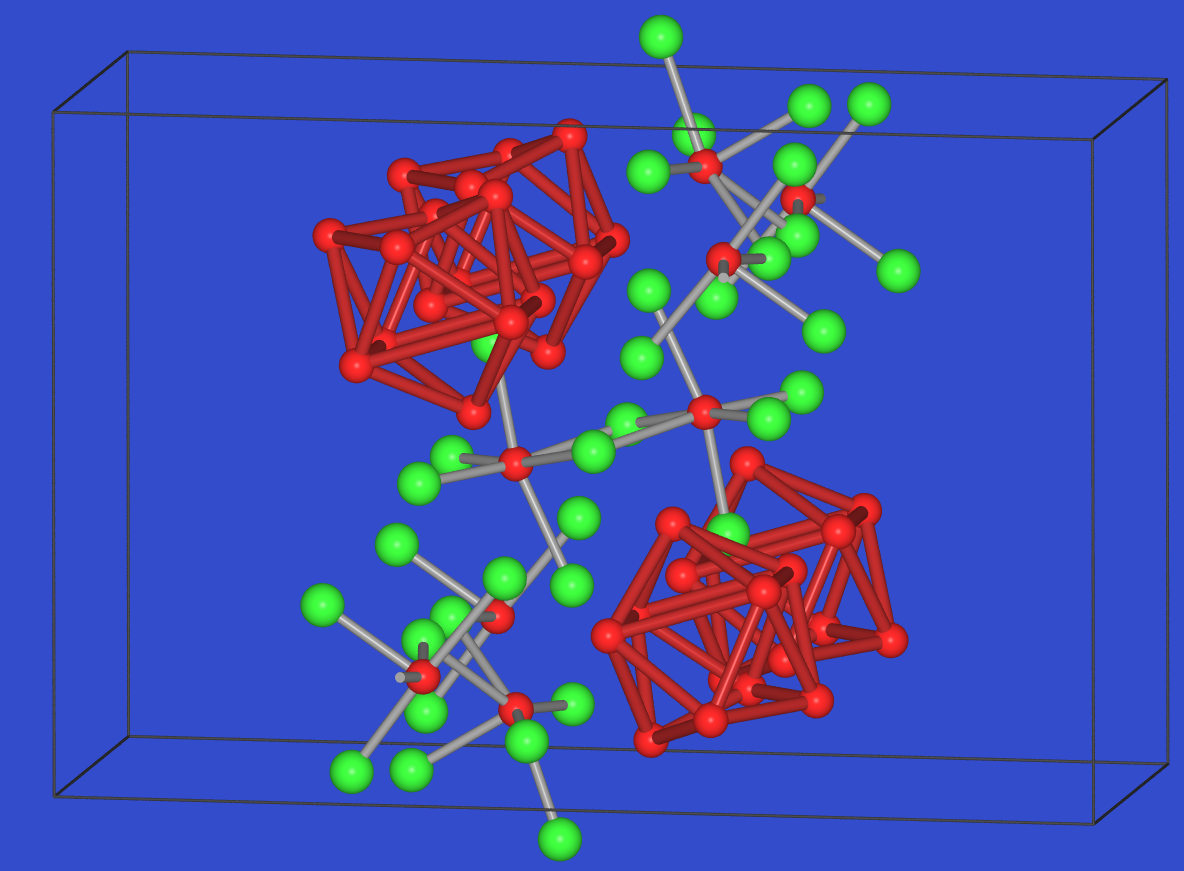 |
| Abb. 6.3.6. BiBr ‣VRML | Abb. 6.3.7. Bi6Br7 ‣VRML |
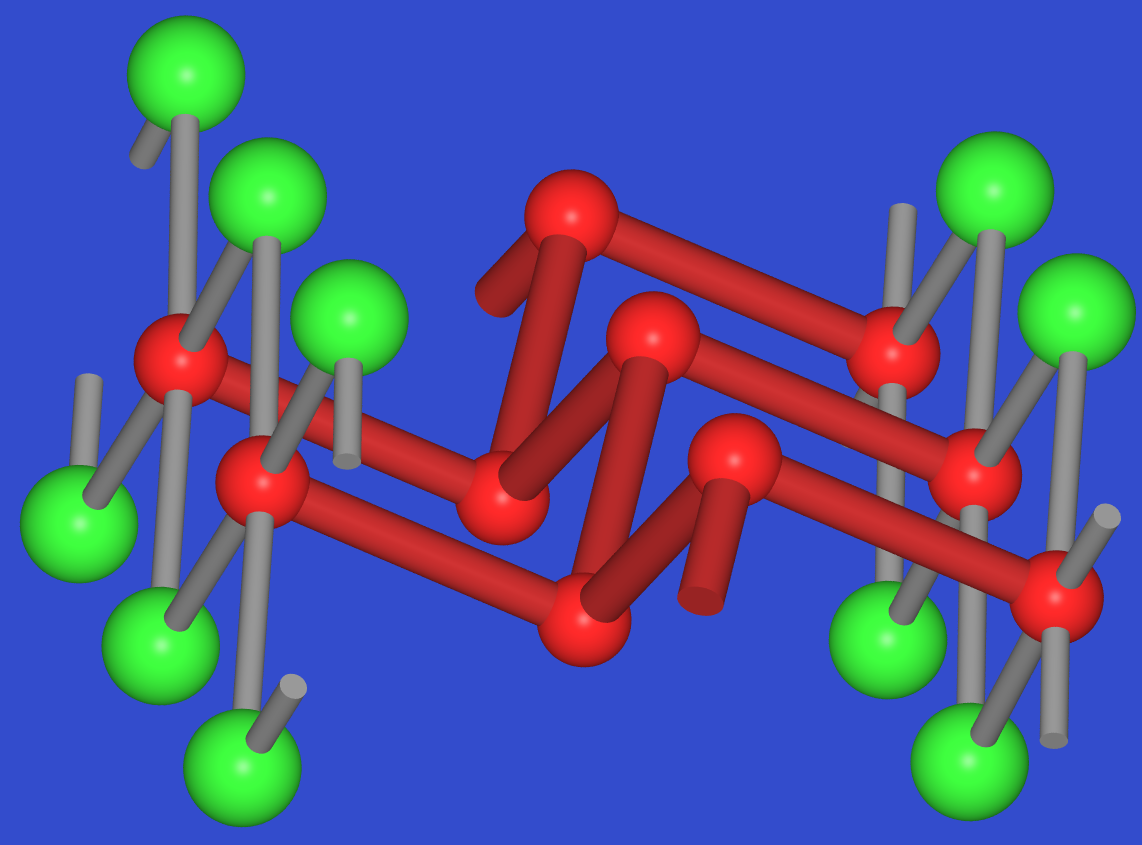
BiBr enthält eine Zick-Zack-Kette dreibindiger Bi-Atome (Bi 0).
Die verzweigenden Bi-Atome haben einen Bi-Nachbarn der Kette und
sind damit formal zweiwertig. Ihre Koordination ist pseudo-oktaedrisch
entsprechend stereochemischer Aktivität des nichtbindenden Elektronenpaars.
Nochmals komplex ist die Struktur von Bi6X7:
Hier liegen nach der ionischen Zerlegung nido-Cluster
Bi95+ (vgl. Sn94-)
neben Doppeloktaedern [BiIII2X8]2- (!Achtung,
in der Struktur durch Fehlordnung normale Doppeloktaeder) und Ketten
[BiIIIX5]2- ([BiIIIX4X2/2]2-) vor.