Vorlesung Chemie der Nichtmetalle
3. Edelgase
3.3. Edelgasverbindungen
|
Übersicht
Die folgende Tabelle gibt eine Übersicht
über die wichtigsten und einfachsten Edelgasverbindungen.
Es handelt sich dabei fast auschließlich um Xe-Verbindungen,
nur KrF2 kann noch als einigermassen faßbare Verbindung genannt
werden. Aufgeführt sind auch die wichtigsten Xe-F-Ionen.
| OS |
Fluoride (mit Ionen) |
Oxide (mit Ionen) |
Fluoridoxide |
| +2 |
XeF+ |
XeF2 |
|
|
|
| +4 |
XeF3+ |
XeF4 |
XeF5- |
|
|
XeOF2 |
|
| +6 |
|
XeF6 |
XeF7- |
XeF82- |
XeO3 |
XeO42- |
|
XeO2F2 |
XeOF4 |
| +8 |
|
XeO4 |
XeO52- |
XeO64- |
XeO3F2 |
XeO2F4 |
|
|
| Tab. 3.3.1. Xe-Fluoride und -Oxide (jeweils mit Ionen) sowie
gemischte Xe-Oxid-Fluoride
|
Fluoride
Vom Xe kennt man die Fluoride XeF2 (Mp: 129 oC),
XeF4 (Mp: 117 oC) und XeF6 (Mp: 49.5 oC).
Auch KrF2 und RnF2 sind bekannt, thermodynamisch
sind jedoch nur die Xe-Fluoride stabil.
XeF4 und XeF6 sind hydrolyseempfindlich, dagegen ist
XeF2 sogar einige Zeit in H2O stabil.
Die Stabilität der Verbindungen nimmt allgemein mit dem
Fluor-Gehalt ab, XeF6 wirkt als Fluorierungsmittel.
Die Strukturen der Xe-Fluoride können generell nach dem VSEPR-Konzept
erklärt werden. Danach ist XeF2 linear
(drei freie Elektronenpaare), XeF4 quadratisch planar
gebaut. XeF6 liegt im Festkörper ionisch als [XeF5]+ + F-
vor (s. Abb. 3.3.1), im Gas hat es als Molekül oktaedrische Gestalt, d.h. der
Einfluß des freien Elektronenpaars fehlt hier.
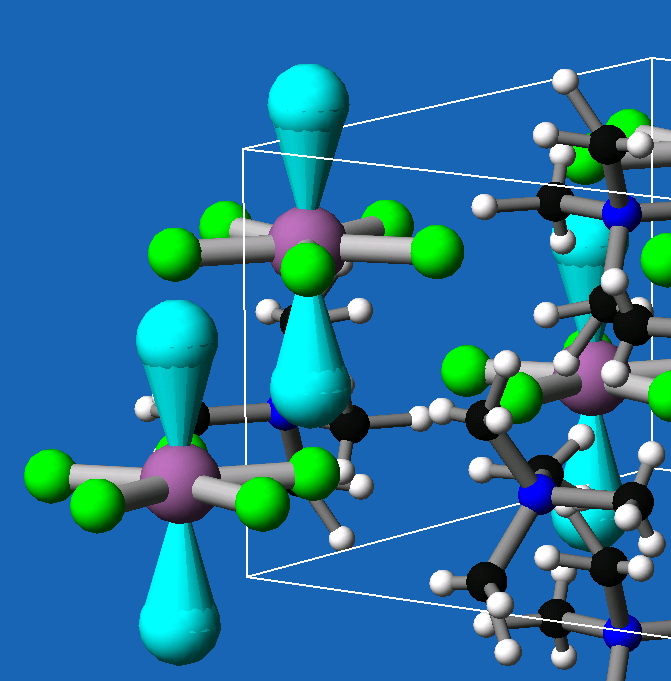
| Abb. 3.3.1. Kristallstrukturen
von XeF6 und [(CH3)4N+][XeF5-] |
Die Darstellung gelingt aus den Elementen
durch Druckfluorierung, z.B. gemäß:
Xe + 3 F2 ---> XeF6
bei einer Temperatur von 400 oC, 60 bar Druck und einem Xe:F-Verhältnis von
1:40.
Höhere Fluoride können aus den niedrigeren Verbindungen erhalten werden:
XeF4 + F2 ---> XeF6
Wie wichtigsten Reaktionen der
Edelgasfluoride sind:
- die fluorierende Wirkung, besonders von XeF6:
XeF4 + 2 H2 ---> 130oC ---> Xe + 4 HF
- die oxidierende Wirkung, besonders von XeF2 und XeF4:
2 Cl- ---> Cl2 + 2 e-
bei der elementares Xe gebildet wird:
XeF2 + 2 e- --->Xe + 2 F-
- die Salzbildung, die auch als Säure-Base-Reaktion beschrieben werden kann.
D.h. die Wirkung der Xe-Fluoride:
- als F-Donator:
BF3 + XeF6 <---> [XeF5]+ + [BF4]-
AsF5 + XeF6 <---> [XeF5]+ + [AsF6]-
- als F-Akzeptor:
XeF6 + CsF ---> CsXeF7 ---> Cs2XeF8
- sowie Substitutionen der F-Liganden:
XeF6 + HSO3F ---> F5XeOSO2F+ HF
VORSICHT beim Arbeiten mit Xe-Fluoriden. Diese Verbindungen reagieren mit Quarz gemäß
2 XeF6 + SiO2 ---> 2 XeOF4 + SiF4
zu Oxiden bzw. Oxidfluoriden, die sehr explosiv sind (s.u.).
Oxide
Bekannt sind die Xe-Oxide XeVIO3 und XeVIIIO4.
Deren Darstellung gelingt nicht direkt aus den Elementen, sondern
- im Fall von XeO3 durch Hydrolyse der Fluoride:
3 XeIVF4 + 6 H2O ---> Xe0 + 12 HF + XeVIO3
XeF6 + 3 H2O ---> XeO3 + 6 HF
- für XeO4 aus Ba-Perxenat(VIII)
(Ba2[XeO6]) durch Entwässerung mit H2SO4:
XeO64- + 4 H+ ---> H4XeO6 ---> XeO4 + 2 H2O
Quelle für die Perxenate(VIII) ist dabei XeO3, das
bei Basenüberschuß disproportioniert:
2 HXeO4- ---> [XeVIIIO4]2- + Xe0 + O2
Eigenschaften und Strukturen
- XeO3 ist ein farbloser, sehr explosiver Festkörper.
Es handelt sich um Molekülkristalle, das Molekül ist
isoelektronisch und isostrukturell zu IO3-.
Bei Einwirkung von Basen und Erwärmen
entsteht Xenat(VI):
XeVIO3 + Ba(OH)2 ---> XeVIO42-
Bei Basenüberschuß erfolgt Disproportionierung
unter Bildung von elementarem Xe und Perxenat(VIII):
2 HXeO4- ---> [XeVIIIO4]2- + Xe0 + O2
Perxenate zerfallen bei Zugabe von konzentrierter H2SO4
zu XeO4.
- XeO4 ist ein farbloses schon bei -40 oC explosives Gas.
Das Molekül ist isoelektronisch und isostrukturell zu IO4-
und hat wie dieses ideal tetraedrische Form (Punktgruppe -43m).
Die korrespondierenden Salze sind die Perxenate XeO64-.
Oxidfluoride
Bekannt sind die Oxidfluoride des Xenons XeF4O, XeF2O, XeF2O2,
XeF2O3, die bis auf das erstere sehr instabil sind.
Sie entstehen bei der Hydrolyse der entsprechenden Fluoride, der Bau der Moleküle kann
mit Hilfe der VSEPR-Theorie, Kap. 3.4. hergeleitet werden.
Andere Verbindungen
Es gibt auch Xe-Verbindungen mit Xe-O-, Xe-N- und Xe-C-Bindungen, z.B.
- Xe-O-Bindung in O-Xe(OTeF5)4 (große Gruppen EN!)
- Xe-N-Bindung in F-Xe-N(SO2F)2
- Xe-C-Bindung in +[Xe-C6F5] (nur bis -40 oC stabil)
und in der Kristallstruktur des
Salzes mit [BF4]--Anion.
- Xe kann sogar als Ligand in Goldkomplexen fungieren.
Chemische Bindung in den Edelgasverbindungen
Wie bei allen kovalenten Verbindungen und z.B. bereits beim Wasserstoff H2
in Kapitel 2.1. genannt, kann die chemische Bindung
in den Edelgasverbindungen mit verschiedenen Modellen beschrieben werden:
- Die VSEPR-Theorie (Kap. 3.4.) erlaubt
ohne Details der chemischen Bindungen die Bestimmung des Baus der Moleküle.
- In der VB-Beschreibung ist zur Erklärung der Stabilitäten
die Hybridisierung mit den d-Orbitalen notwendig, die nach heutiger
Kenntnis jedoch keine oder nur eine geringe Bedeutung hat.
- Die MO-Theorie erlaubt die umfassendste Beschreibung von Bindung und Stabilität.
Im Fall der Edelgasverbindungen handelt es sich jedoch um hypervalente
Verbindungen (Überschreitung der Oktett-Regel), die erst nach
der Gewöhnung an die MO-Beschreibung bei den Halogenen und Sauerstoff
am Beispiel der chemischen Bindung in SF6 beim Schwefel
diskutiert werden sollen.