Vorlesung Chemie der Nichtmetalle
4. Halogene: F, Cl, Br, I, At
4.3. Interhalogenverbindungen
|
Verbindungen der Halogene untereinander (sogenannte Interhalogen-Verbindungen) sind mit den
allgemeinen Formeln XY, XY3, XY5, XY7 bekannt, wobei
- X stets das elektropositivere Halogen ist, das entsprechend in
den Oxidationsstufen +1, +3, +5 und +7 vorliegt.
- Y in den meisten Fällen Fluor, seltenen auch Chlor ist. Y liegt immer in der
Oxidationsstufe -1 vor.
Bei den Interhalogenverbindungen handelt es sich um reaktionsfähige, typisch kovalente Verbindungen,
die sämtlich aus den Elementen oder durch Fluorierungen mit XeF2 hergestellt werden können.
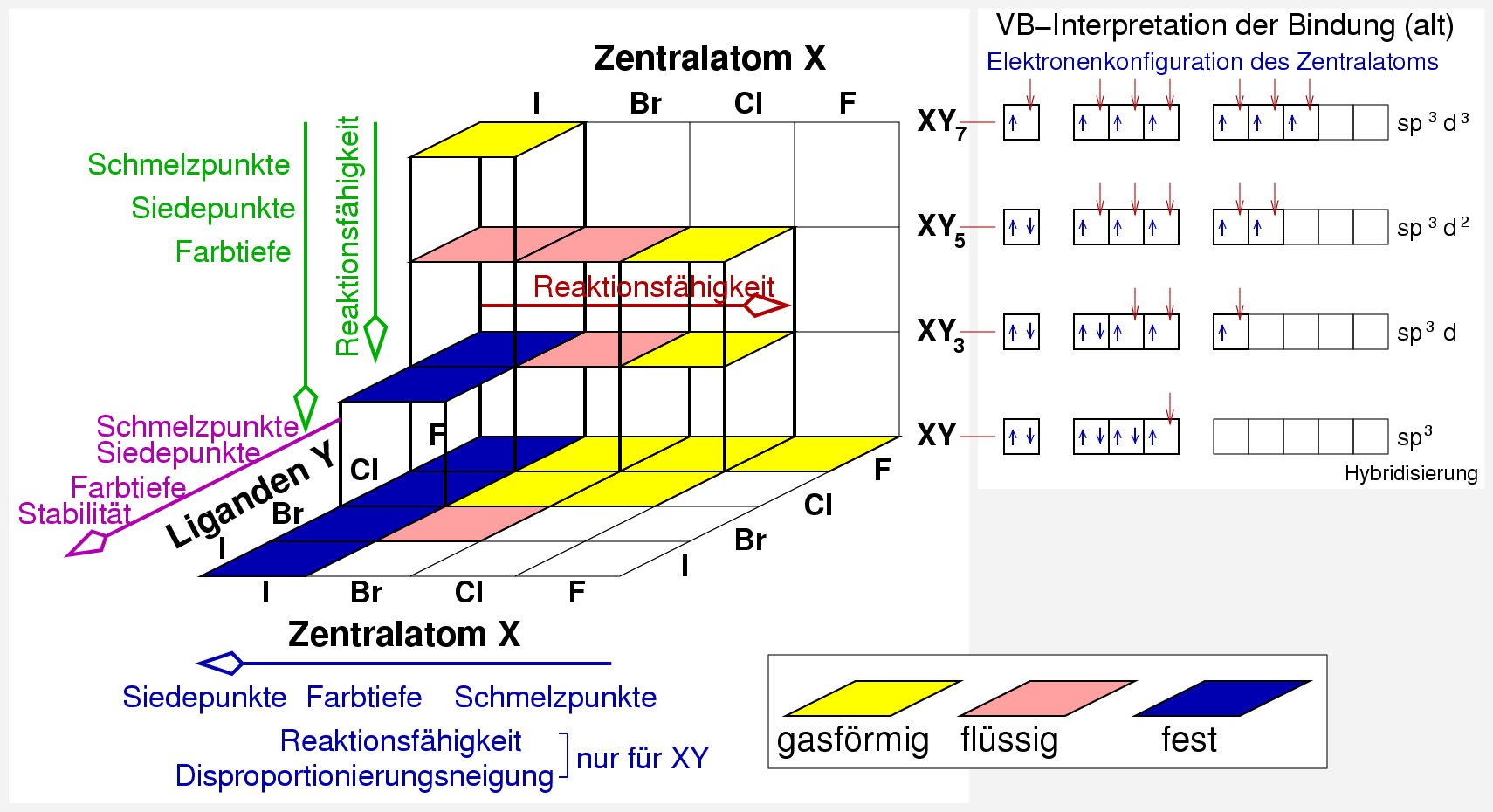
Die Übersicht in Abbildung 4.3.1. zeigt graphisch die bekannten Interhalogenverbindungen als farbige Quadrate.
In diesem Diagramm variiert
- nach Oben die Zusammensetzung,
- nach Vorne der Ligand (d.h. der elektronegativere Partner Y)
- und nach Rechts das Zentralatom (elektropositiverer Partner X).
 |
| Abb. 4.3.1. Übersicht über Interhalogenverbindungen
‣SVG |
In diesem Diagramm lassen sich allgemeine Tendenzen über Existenz, Stabilität und Reaktivität
feststellen und der prinzipieller Unterschied zwischen den einfachsten Interhalogenen XY und
den höheren Verbindungen XYn (n > 1) wird deutlich.
Einfache Interhalogene XY
Bei den einfachen Interhalogenverbindungen XY sind alle Kombinationen bekannt
(Grundfläche des Diagramms in Abb. 4.3.1).
Die Bindung in diesen einfachen Verbindungen entspricht der der Halogene selber,
sie ist jedoch polar und daher sind die Verbindungen im Allgemeinen reaktiver als die
einfachen Halogene.
Aus dem Diagramm Abb. 4.3.1. folgen für diese Verbindungen die vorhersagbare Tendenzen und Eigenschaften:
- In den Reihen
- IF, BrF, ClF, F2
- ICl, BrCl, Cl2
- IBr, Br2
fallen die Siede- und Schmelzpunkte, die Reaktionsfähigkeit steigt, die
Disproportionierungsneigung nimmt ab.
ClF ist ein farbloses, BrF ein hellrotes Gas. IF ist dagegen ein brauner Feststoff.
Auch IBr ist fest, wie Abbildung 4.3.2. zeigt.
 |
| 4.3.2. IBr |
Je weiter X und Y im Periodensystem auseinander stehen, umso reaktiver sind die einfachen
Interhalogene XY:
- ClF ist sehr stabil.
- BrF ist wenig stabil und neigt zur Disproportionierung in Br2 und BrF3.
- IF ist nur unterhalb von -14 oC stabil.
Oberhalb dieser Temperatur disproportioniert es in I2 und IF5.
Mit Wasser werden die elektronegativen Partner Y der Interhalogene zu Halogenid reduziert,
die elektropositiveren Partner X werden zu den Hypohalogeniten oxidiert:
XY + H2O ---> HY-I + HOX+I (Hypo-halogenit)
Höhere Interhalogene XYn (n>1)
Bei den höheren Interhalgenverbindungen (XYn (n>1)
handelt es sich bis auf ICl3 um Fluoride (hintere Wand des Diagramms Abb. 4.3.1).
Alle Verbindungen sind hydrolyseempfindlich und wirken als starke Fluorierungs- und Oxidationsmittel.
Mit steigendem Fluor-Gehalt zeigen sie erhöhte Flüchtigkeit.
Nur Iod bildet das Heptafluorid. Die Strukturen lassen sich mit Hilfe des VSEPR-Konzeptes
(Gillespie-Nyholm-Konzeption) erklären.
Für die einzelnen Gruppen ...
XY3
Unter den Verbindungen der allgemeinen Zusammensetzung XY3 sind
alle Fluoride sowie ICl3 bekannt.
Die Bindung kann nach der VB-Methode nur unter Annahme eines sp3d-Hybrids erklärt werden.
Es handelt sich um T-förmige Moleküle (trigonale Bipyramide, beide Lone-Pairs stehen äquatorial).
Eine Ausnahme bildet ICl3, das als Dimer (ICl3)2
vorliegt.
 |
 |
| 4.3.2. Molekülstruktur von I2Cl6
‣SVG und
‣VRML
|
Abb. 4.3.3. ICl3
|
Aufgrund einer geringen Eigendissoziation weisen die Substanzen elektrisches Leitvermögen auf:
2 BrF3 <---> BrF2+ + BrF4-
Die Verbindungen sind amphoter, gehen also Lewis-Säure-Base-Reaktionen ein.
Die Interhalogene (meist BrF3) können daher als Reaktionsmedien verwendet werden:
- Wirkung als Lewis-Säure:
KF + BrF3 ---> KBrF4 ( ---> K+ + BrF4-)
- Wirkung als Lewis-Base:
BrF3 + SnF4 ---> (BrF2)2SnF6
( ---> 2 BrF2+ + SnF62-)
- Neutralisationsreaktionen:
(BrF2)SbF6 + Ag(BrF4) ---> AgSbF6 + 2 BrF3
entsprechend der Reaktion von Wasser:
OH- + H+ ---> H2O
- Redoxreaktionen:
- Reduktion:
2 BrF2+ + 2 e- ---> BrF3 + BrF
entsprechend der Reaktion von Wasser:
H+ + e- ---> 1/2 H2
- Oxidation:
2 BrF4- ---> BrF3 + BrF5 + 2 e-
entsprechend der Reaktion von Wasser:
2 OH- ---> 1/2O2 + H2O + 2 e-
BrF3 kann daher zur Auflösung edler Metalle und Metallhalogenide unter Oxidation nach:
Ag ---> AgF ---> Ag+ + BrF4-
eingesetzt werden. Chlortrifluorid, ClF3, ist eine der reaktionsfähigsten
chemischen Substanzen überhaupt und reagiert mit fast allen Stoffen explosionsartig.
XY5
Alle Fluoride XF5 sind bekannt. Sie sind weniger reaktiv als die entsprechenden
XY3-Verbindungen. Zur Beschreibung der Bindung nach der Valence-Bond-Methode
muß ein sp3d2-Hybrid angenommen werden, die Molekülstruktur
kann als ψ-Oktaeder beschrieben werden. IF5 ist ein technisches Produkt,
das zur Fluorierung/Iodierung organischer Verbindungen für die Polymerherstellung eingesetzt wird.
XY7
Die einzige bekannte Verbindung dieses Typs ist IF7. Die chemische Bindung ist nach
der VB-Beschreibung über ein sp3d3-Hybrid zu beschreiben.
Damit wird auch deutlich, daß hier nur noch die Iod-Verbindung bekannt ist, da die
Promotionsenergie von Elektronen in d-Zustände bei den schwereren Elementen geringer ist.
Im Gas sind die F-Liganden in IF7 fluktuierend, im Festkörper bildet das
Molekül eine pentagonale Bipyramide (s. Abb. 4.3.4.).
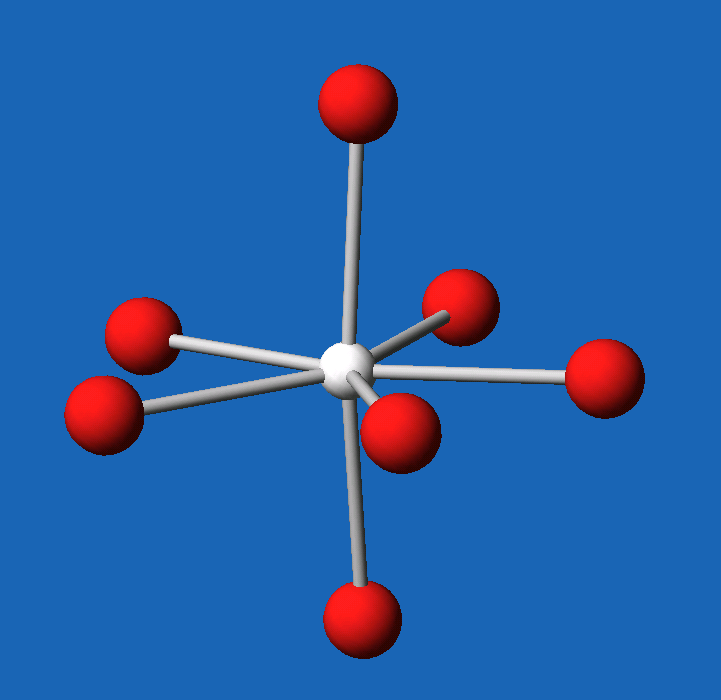 |
| Abb. 4.3.4. Molekülstruktur von IF7 im Festkörper
‣VRML |
Kationische und anionische Interhalogen-Spezies
Neben den neutralen Interhalogenverbindungen sind aufgrund der Lewis-Säure-Base-Eigenschaft
zusätzlich
- kationische Komplexe des Typ XY2+; XY4+, XY6+
wie z.B. [ICl2]+, [ClF4]+ oder [IF6]+ und
- anionische Komplexe des Typs XY-, XY4- und XY6-
wie z.B. [Br3]-, [ClF2]-,
[BrF4]- oder [BrF6]-
bekannt.
Die Strukturen lassen sich wie die der neutralen Interhalogene nach dem VSEPR-Konzept erklären:
- kationische Komplexe:
- XY2+ = 7 + 2 - 1 = 8 Außenelektronen = 4 Paare = Tetraeder
- XY4+ = 7 + 4 - 1 = 10 Außenelektronen = 5 Paare = trigonale Bipyramide
- XY6+ = 7 + 6 - 1 = 12 Außenelektronen = 6 Paare = Oktaeder
- anionische Komplexe:
- XY2- = 7 + 2 + 1 = 10 Außen-e- = 5 Paare = trigonale Bipyramide
- XY4- = 7 + 4 + 1 = 12 Außen-e- = 6 Paare = Oktaeder = planares Molekül
- XY6- = 7 + 6 + 1 = 14 Außen-e- = 7 Paare = KEIN!!! gestörtes Oktaeder
In den Polyiodiden und den Polyiod-Kationen (s. Abb. 4.3.5.) tritt Iod sowohl als Ligand als auch als Zentralatom auf, so daß
auch eine weitere Verknüpfung möglich ist.
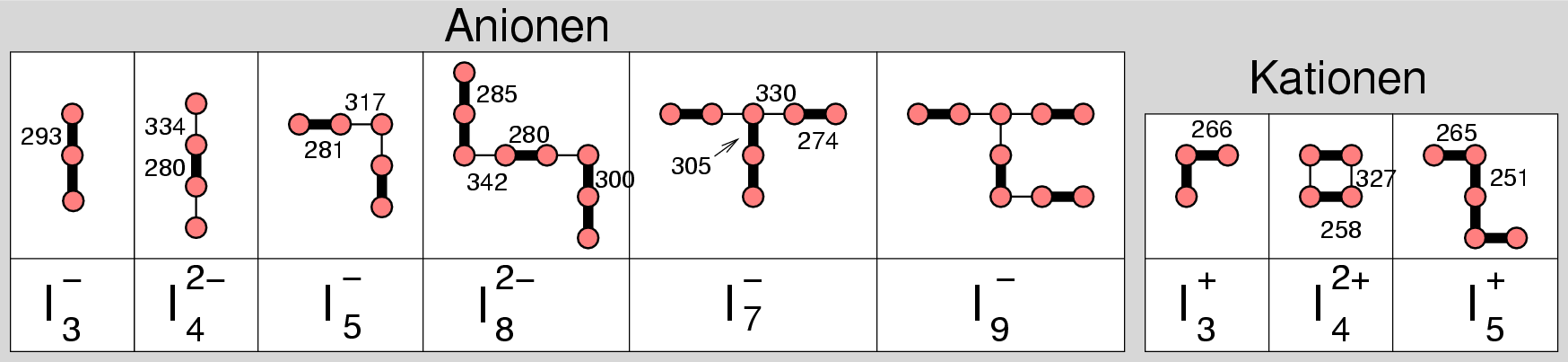 |
| Abb. 4.3.5. Übersicht über Poly-Iod-Anionen und -Kationen
‣SVG |
Im einzelnen sind
- Anionen, meist in Salzen mit Cs+ o.ä. als Gegenionen, wie z.B.
- [I3]-
(entsteht aus KI und I2; isoelektronisch zu XeF2, 24 e--System)
- [I4]2- (I2 mit zwei ankondensierten I-)
- [I5]- (verantwortlich für die Blaufärbung der Iod-Säure;
I- mit zwei ankondensierten I2)
- außerdem I82-, I7-, I9- bis I164- und
- Kationen, meist mit SbF6--Gegenion, wie z.B.
- [I3]+ (gewinkelt, isoelektronisch zu SCl2, 22 e--System)
- [I4]2+, I5+ .. bis I153+
bekannt.






