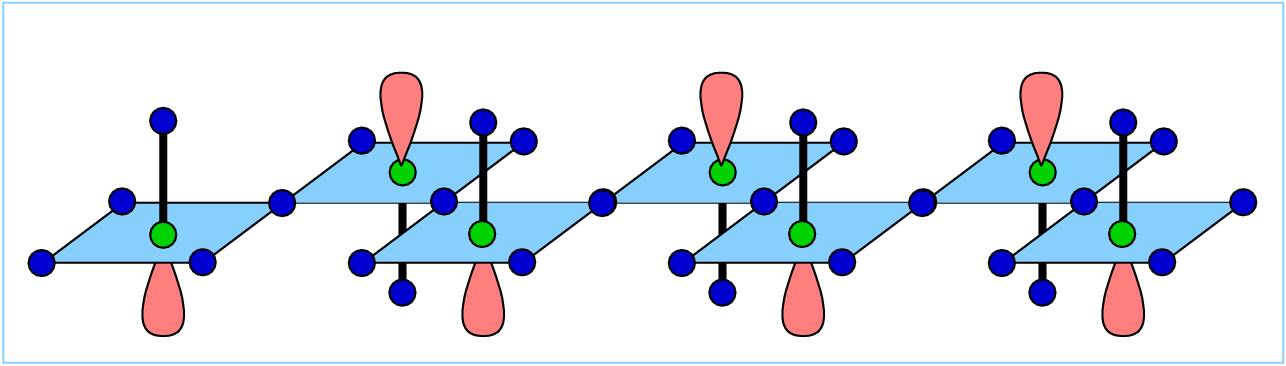
Und hier gibt es noch die Formen der besetzten Orbitale zum Anschauen (als VRML-Dateien) dazu.
Es handelt sich um die Kohn-Sham-Orbitale aus einer DFT-Orca-Rechnung mit BP86-Funktional
und def2-TZVPP Basis-Funktionen.
Die Orbitale sind nach steigender Energie geordnet, aber wegen der Beschränkung des Schemas oben
auf reine σ-Bindungen fehlen zwölf MOs in der Abbildung 5.3.2. Bei Berücksichtigung
aller S- (6) und aller F-p- (6*5) Valenzelektronen ergeben sich insgesamt 18 besetzte MOs:
- ein S-s/F-p-σ-bindendes
MO, bestehend aus S-3s und den sechs 2p-Orbitalen von Fluor entlang
der Bindungsrichtung; mit a1g-Symmetrie (s. Abb. 5.3.2.)
- drei entartete p-σ-antibindende MOs, die
aus den Orbitalen von S-p- und den auf den S-F-Bindungen liegenden
2p-Orbitalen von Fluor gebildet werden,
mit t1u-Symmetrie (s. Abb. 5.3.2.)
- drei entartete F-p-π-bindende -Vierer-Herzchen.
Diese bewirken damit einen p-π-Anteil in der S-F-Bindung. S-d-Anteile
spielen hier ebenfalls eine Rolle.
- zwei entartete (!), schwach p-σ-bindende MOs mit
eg-Symmetrie, bei denen ebenfalls eine nicht
vernachlässigbare S-d-Komponente sichtbar wird. Im Schema in Abbildung 5.3.2. ohne diese
S-d-Anteile sind diese MOs insgesamt nichtbindend.
- drei Sätze aus jeweils drei entarteten Kombinationen von nichtbindenden F-p-AOs (alle t1u-Symmetrie).
Diese bilden das HOMO des Moleküls. Von jedem Satz ist wieder nur ein Orbital gezeigt. Geordnet
sind die MOs wieder nach steigender Energie, die Energieunterschiede sind aber gering.
- F-Lone-Pair Kombination 1
- F-Lone-Pair Kombination 2
- F-Lone-Pair Kombination 3
|