| Abb. 5.4.1. Valenzstrichformeln von S-Oxiden ‣SVG |
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
Vorlesung Chemie der Nichtmetalle5. Chalkogene: O, S, Se, Te, Po5.4. Chalkogen-Oxide |
Von Schwefel, Selen und Tellur gibt es eine ganze Reihe von Oxiden mit den unterschiedlichsten Oxidationsstufen am Chalkogen. Die folgende Tabelle 5.4.1. gibt hierzu eine Übersicht:
| Oxidationsstufe | Schwefel | Selen | Tellur |
| < +1 | SnO (n=5-10) | - | - |
| S7O2 | - | - | |
| +1 | S2O | . | . |
| +2 | SO, S2O2 | . | . |
| +4 | SO2 | SeO2 | TeO2 |
| +4/+6 | - | Se2O5 | Te2O5 |
| +6 | SO3 | TeO3 | TeO3 |
| (SO3-4)n | . | . |
| Abb. 5.4.1. Valenzstrichformeln von S-Oxiden ‣SVG |
| gas | flüssig | 1 | 2 | 3 | ||||
| SO3 (gas) | -> 44oC -> | SO3 (fl.) | -> 17oC -> | γ-SO3 | H2O-Spuren | β-SO3 | nur direkt aus dem Gas, -80oC | α-SO3 |
| trig. planare SO3 Moleküle, | eisartig | asbestartig | Schicht, Mp: 62 oC | |||||
| im Gleichgewicht mit cyclischen Trimeren S3O9/ | 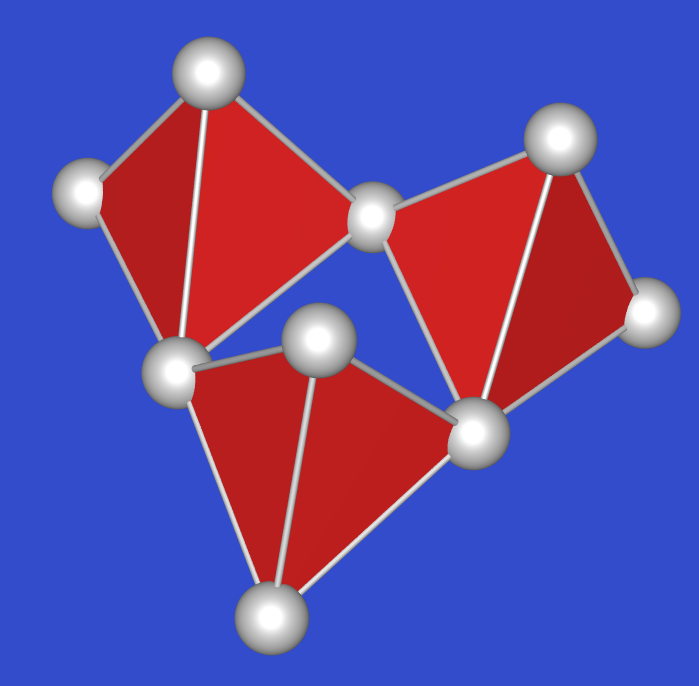 |
 |
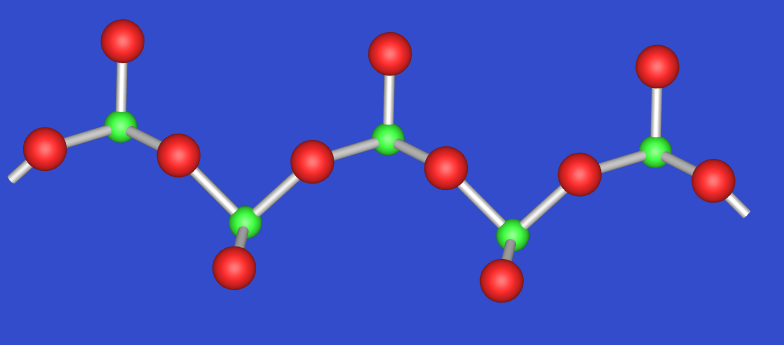
Ketten wie in der ß-Form, aber zu Schichten verknüpft; thermodynamisch stabil | |||||
| D3h | orthorhombisch | monoklin | ||||||
| S-O: 143 pm | S-O: 162 pm (im Ring); 137-143 pm (exo-O) | S-O: 162 pm (in der Kette); 141 pm (exo-O) | ||||||
Im Handel ist sowohl festes SO3, eine Mischung der β- und der α-Form (Schmelzpunkt: -40 oC) als auch die flüssige Form, die nur durch Zusatz von Borsäure stabilisiert ist.
| Abb. 5.4.2. Foto der Ampullenspitze unserer SO3-Ampulle mit der asbest-artigen Form |
| Abb. 5.4.3. Anlagenschema zur Schwefelsäureherstellung nach dem Doppelkontaktverfahren ‣SVG |
Selen bildet Oxide mit Selen in der Oxidationsstufe VI und IV sowie ein gemischtvalentes Oxid.
 |
 |
 |
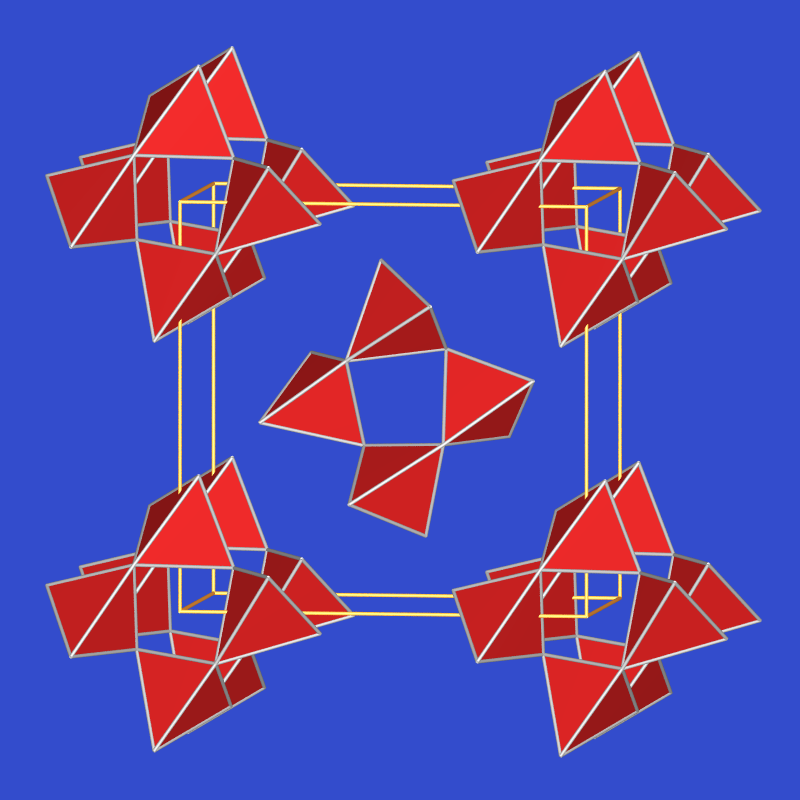
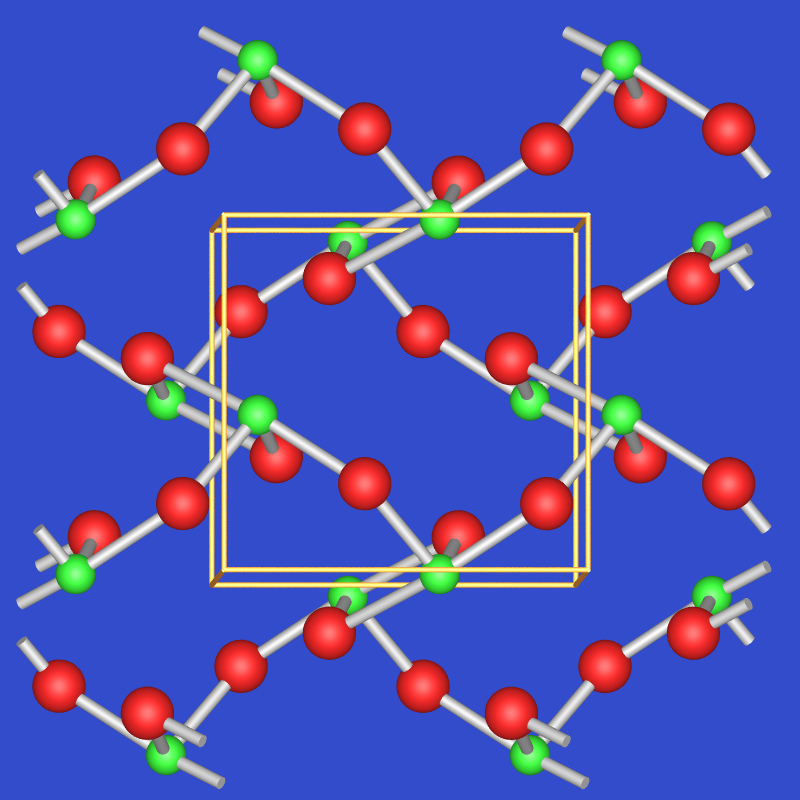
| 5.4.3. Struktur von SeO2 (Selenolit) ‣VRML | 5.4.4. Struktur von SeO3 ‣VRML | 5.4.5. Struktur von Se2O5 ‣VRML |
SeO2 (Mineralogisch: Downeyit; Struktur s. Abb. 5.4.3.) enthält SeIV, ist also das Anhydrid der selenigen Säure. Es bildet weiße Kristalle, die bei 340 oC schmelzen. Es kann entweder durch Entwässern von H2SeO3 oder auch direkt aus den Elementen dargestellt werden. Die Struktur weist unendliche Ketten flacher SeO3-Pyramiden auf (Se-O in der Kette: 178 pm, exo-Se-O: 173 pm).
Das dem SO2 entsprechende Molekül SeO2 ist nur in der Gasphase existent. Aus IR-Spektren ist auch das Dimere (ebenfalls in der Gasphase) bekannt.
SeVIO3, das Anhydrid der Selensäure, läßt sich aus K3SeO4 und SO3 darstellen, da es ein stärkeres Oxidationsmittel als SO3 ist. Aus der so entstehenden Mischung von SeO3 und SO3 kann SO3 abdestilliert werden. SeVIO3 bildet farblose hygroskopische Kristalle mit einem Schmelzpunkt von 118 oC. SeO3 ist hygroskopisch und wirkt stark oxidierend. Es zerfällt obehalb von 185 oC in SeO2 und O2. Die Struktur (Abb. 5.4.4.) zeigt Se4O12-Tetramere gemäß [SeO2O(2/2)]4.
Das gemischtvalente SeIV,VI-Oxid Se2O5 entsteht durch thermische Zersetzung von SeO3. Mit Wasser entstehen entsprechend Selen- und selenige Säure. Die Struktur (s. Abb. 5.4.5.) enthält Ketten, die alternierend aus flachen Pyramiden SeIVOO2/2 und Tetraedern SeVIO2O2/2 bestehen.
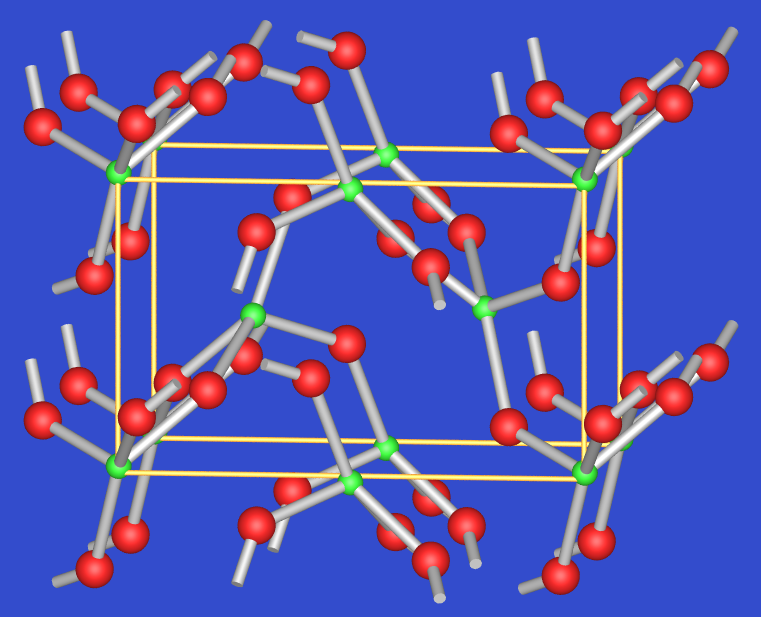
Das Dioxid TeIVO2 entsteht beim Verbrennen vom elementarem Tellur. Es ist das Anhydrid der tellurigen 'Säure', die amphoter ist:
 |
 |
 |
 |
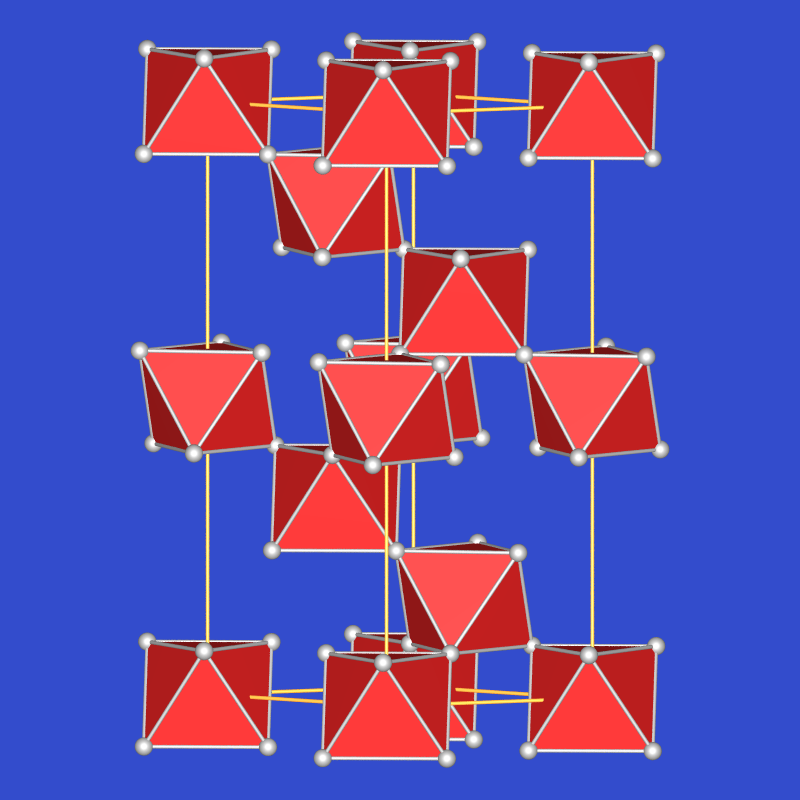
| 5.4.6. Schichtstruktur von TeO2 (Tellurit) ‣VRML | 5.4.7. Raumnetzstruktur von TeO2 (Paratellurit) ‣VRML | 5.4.8. Struktur von TeO3 ‣VRML | 5.4.9. Struktur von Te2O5 ‣VRML |
TeVIO3 kommt ebenfalls in zwei Modifikationen vor:
Ein weiteres gemischtvalentes Oxid ist Te4O9 (TeIV3TeVIO9) mit einer komplizierten Struktur aus TeIV Oktaederschichten und Ähnlichkeiten mit Te2O5.
| Inhalt | 1. Einleitung | 2. Wasserstoff | 3. Edelgase | 4. Halogene | 5. Chalkogene | 6. Pentele | 7. Tetrele | 8. Bor |
|
| cr_home | Metalle | Strukturchemie | Interm. Phasen | Oxide | FK-Chemie | Silicate | Strukturtypen |