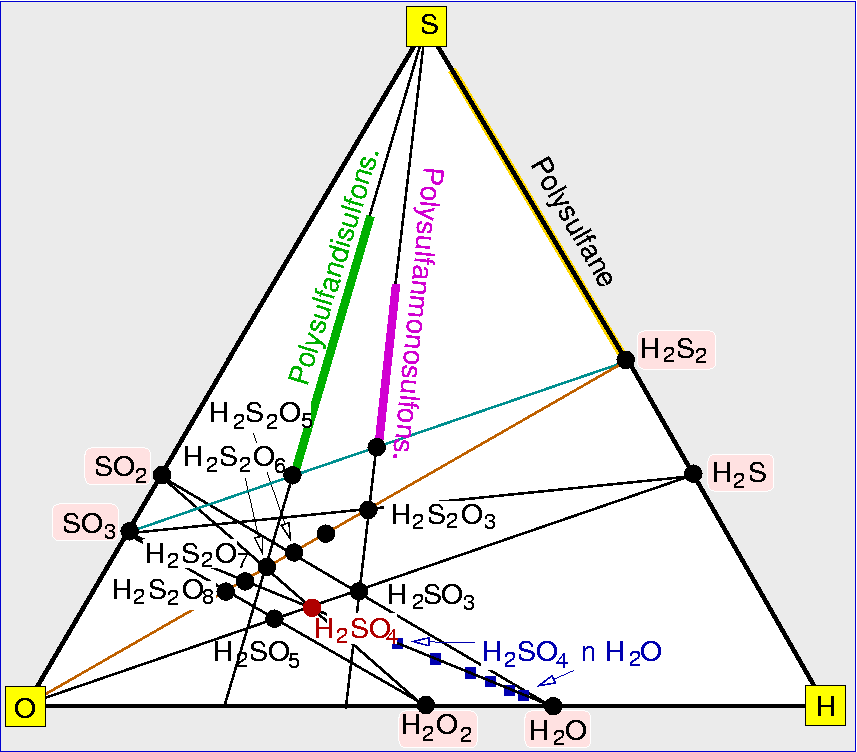
| Tab. 5.5.1. Die Sauerstoffsären des Schwefels der Gruppen
(1) und (2).
Unterstrichen sind die Säuren, die als reine Verbindungen isolierbar sind, das sind also
- H2SO4: Schwefelsäure
- H2S2O7: Dischwefelsäure
- H2SO5: Peroxoschwefelsäure
- H2S2O8: Peroxodischwefelsäure
- H2S2O3: Thioschwefelsäure
Alle anderen Säuren sind nur in wässriger Lösung oder als Salze bekannt.
Allgemeine Eigenschaften
- Es handelt sich um 2-basige Säuren (Ausnahme: Peroxoschwefelsäure H2SO5)
- Die Säurestärke wächst mit zunehmender O-Zahl oder Oxidationsstufe.
- Bei gleicher Oxidationstufe sind die DI-Schwefelsäuren stärkere Säuren
als die MONO-Schwefelsäuren.
- Wie immer, wenn H+/OH- an den Redoxchemie beteiligt sind, gilt, dass
- das Oxidationsvermögen in saurer Lösung größer ist.
- das Reduktionvermögen in alkalischer Lösung stärker ist.
- Danach ist:
- Peroxodisulfat das stärkste Oxidationsmittel.
- Dithionit (S2O42-) (dann Sulfit) das stärkste Reduktionsmittel.
- Weitere Details der Redoxchemie sind dem Voltäquivalentdiagramm (auch Frost-Diagramme) zu entnehmen.
Unter dem Voltäquivalent versteht man das mit Produkt aus Standardpotential und Oxidationsstufe:
VE = E0 . OS
Trägt man also diese Voltäquivalente gegen die die Oxidationsstufen an, dann
entspricht die Steigung der Kurve dem Normalpotential E0.
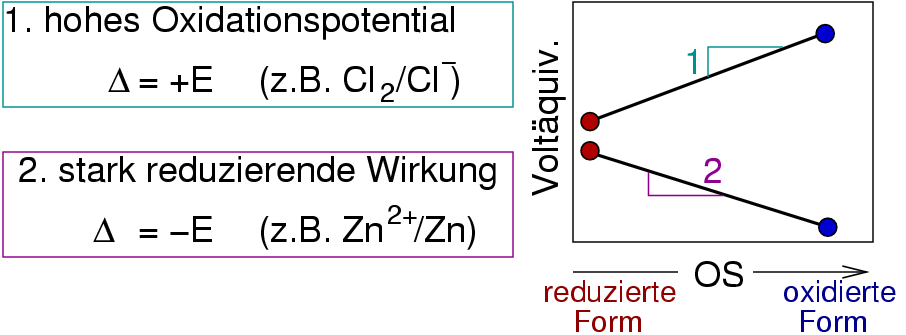 |
| Abb. 5.5.2. Prinzip der Voltäquivalent-Diagramme
‣SVG
|
Am Kurvenverlauf kann man nicht nur reduzierende und oxidierende Redoxsysteme unterscheiden,
sondern sofort die Steigungen zwischen allen Oxidationsstufen bestimmen. Auf diese Weise läßt sich
wegen der Normierung auf n in ΔG = -n E F allein aus der Steigung auch sofort bestimmen, ob eine
Redoxreaktion abläuft. Für Elemente mit vielen Oxidationsstufen (wie z.B. dem Schwefel) läßt
sich aus dem Voltäquivalent-Diagramm auch sofort bestimmen, welche der Spezies
im Vergleich zu anderen welche Redoxeigenschaften haben.
In Abbildung 5.5.3. ist hierzu als Beispiel das Voltäquivalent-Diagramm der Sauerstoffsäuren
des Schwefels (in saurer Lösung bei pH=0) dargestellt, die sich aus den
Redoxpotentialen zwischen allen Spezies berechnen lässt.
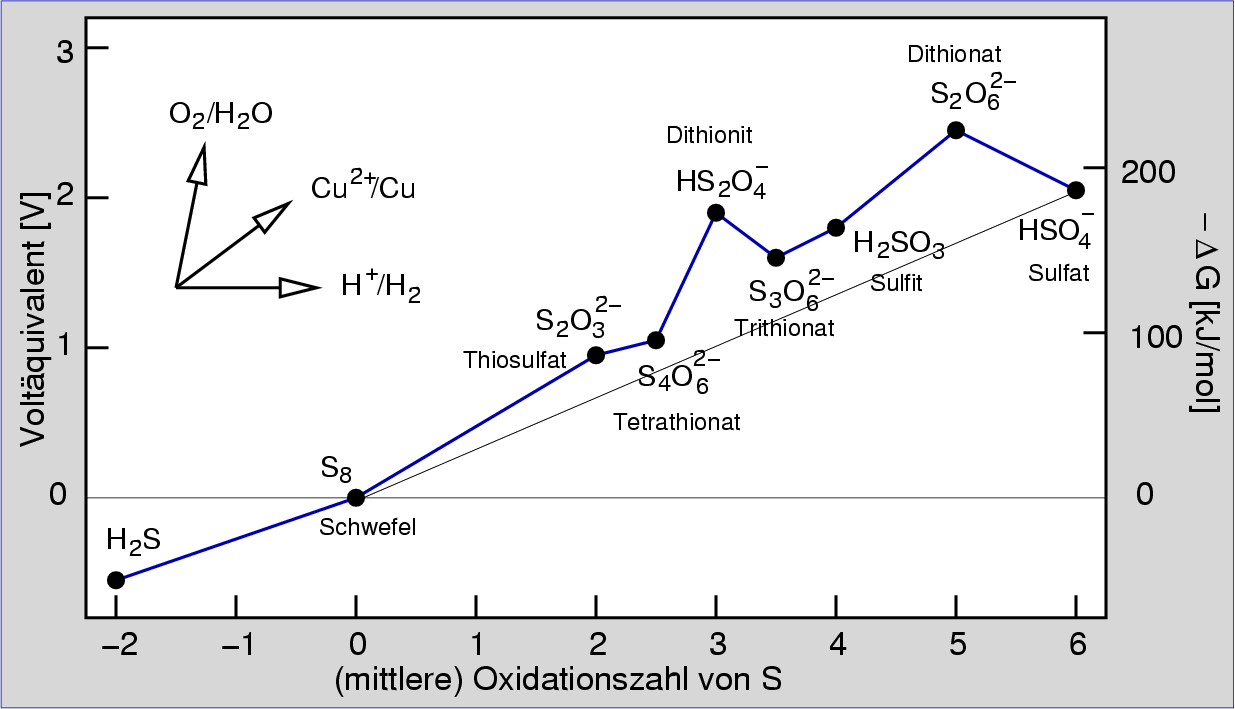 |
| Abb. 5.5.3. Voltäquivalent-Diagramm der Sauerstoffsäuren von Schwefel
‣SVG
|
Hieraus wird z.B. erkennbar:
- Da die Steigung zwischen H2S und S8 kleiner ist
als zwischen S8 und allen Anionen mit Schwefel in den höheren Oxidationsstufen,
kann H2S alle Oxosäuren zu elementarem Schwefel reduzieren.
- Da alle Oxosäuren oberhalb der Verbindungslinie S8 -- HSO4-
liegen, disproportionieren sie zu Schwefel und H2SO4.
Sie sind (außer H2SO4) mäßig starke Reduktionsmittel.
Technische Bedeutung
Von technischer Bedeutung sind:
- Schwefelsäure, H2SO4, ist mit der größten Tonage überhaupt
(2008: 205 106 t/a)
eine der wichtigsten chemischen Verbindungen.
- Thiosulfate, Sulfite, Disulfite und Dithionite sind als Reduktionsmittel sehr wichtig.
Die einzelnen Säuren
Im folgenden werden die Sauerstoffsäuren (nach Oxidationsstufen) im Einzelnen behandelt,
dabei werden Säuren, die durch Kondensation entstehen, immer gleich mit betrachtet:
S(+VI) (ohne Peroxo-Gruppe)
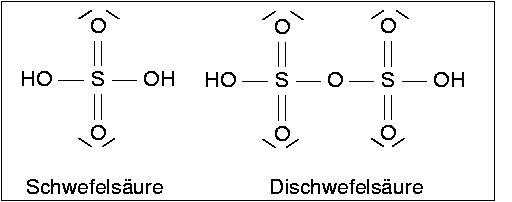 |
| Abb. 5.5.4. Valenzstrichformeln von
Schwefelsäure (H2SO4) und Dischwefelsäure (H2S2O7)
‣SVG
|
Schwefelsäure (H2SO4) (und
das Kondensationsprodukt Dischwefelsäure (H2S2O7)
sind extrem wichtige grosstechnische Produkte (Weltjahresproduktion 205 Mio. t/a im Jahr 2008).
- Zur Herstellung wird SO3 (s. dort)
in H2SO4 unter Bildung von H2S2O7 absorbiert. Diese
Dischwefelsäure wird anschließend hydrolysiert.
- Reine Schwefelsäure ist eine schwere (Dichte: 1.8 g/cm3), viskose Flüssigkeit
mit einem Schmelzpunkt von 10.4oC und einem Siedepunkt von ca. 300oC.
Das Azeotrop ist 99.8 %-ig.
Schwefelsäure hat eine hohe Dielektrizitätskonstante
und eine hohe spezifische elektrische Leitfähigkeit, die zustande kommt durch:
- Autoprotolyse (Eigendissoziation in Ionen):
2 H2SO4 ⟶ H3SO4+ + HSO4-
und
- Autodehydratisierung:
2 H2SO4 ⟶ H3O+ + HS2O7-
Dadurch stehen allein in Wasser-freier H2SO4 sieben Einzelspezies in komplexen Gleichgewichten
miteinander.
- Mit Wasser reagiert Schwefelsäure in exotherme Reaktion (!! Wasser zur Säure, gibt das Ungeheure!)
In unendlicher Verdünnung beträgt die Reaktionsenthalpie 880 kJ/mol (!)
- Schwefelsäure bildet die folgenden wohldefinierten Hydrate:
- H2SO4 . H2O entsprechend [H3O+][HSO4-]
mit einem Schmelzpunkt von 8.6oC.
- H2SO4 . 2 H2O entsprechend [H3O+]2[SO42-]
mit einem Schmelzpunkt von -39.5 oC.
- H2SO4 . 3 H2O entsprechend [H3O+][H5O2+][SO42-] mit einem
Schmelzpunkt von -36.4 oC
- H2SO4 . 4 H2O entsprechend [H5O2+]2[SO42-] mit einem
Schmelzpunkt von -28.3 oC.
- H2SO4 . 6 H2O entsprechend [H7O3+]2[SO42-] mit einem
Schmelzpunkt von -54 oC und
- H2SO4 . 8 H2O entsprechend [H9O4+]2[SO42-] mit einem
Schmelzpunkt von -62 oC.
- Organische Substanzen werden von Schwefelsäure durch H2O-Abspaltung verkohlt (s. Kittel).
- Die Struktur der reinen Schwefelsäure ist aus Mikrowellenspektren im Gas
bekannt. Die Moleküle haben C2-Symmetrie, der S=O-Abstand beträgt 142.2 pm,
der S-OH-Abstand entspricht dagegen mit 157.4 pm einer Einfachbindung S-O.
- Mit SO3 bildet H2SO4 wie oben beschrieben
Dischwefelsäure H2S2O7.
- Schwefelsäure ist eine starke, 2-basige Säure, die
viele gelöste Stoffe (Alkohole, Amine, HNO3) protoniert.
- Als Lösungsmittel wirkt sie gegen gegenüber den meisten gelösten Stoffe
als Säure, die HSO4--Konzentration wird erhöht.
Nur stärkere Säure wie z.B. HSO3F (Fluorsulfonsäure)
reagieren selber als Säuren, die H3SO4+-Konzentration wird erhöht:
HSO3F + H2SO4 ⟶ H3SO4+ + SO3F-
- Schwefelsäure findet vielfach Verwendung und dient
- zur Herstellung von Phosphat-Düngemitteln
(Aufschluß von schwerlöslichem Ca3(PO4)2),
- in der Petrochemie der Alkylierung von iso-Paraffinen mit Olefinen (Homogen/Heterogen-Katalyse),
- der Herstellung zahlreicher anderer anorganischer Chemikalien wie
z.B. HF, Chromsäure, Al-Sulfat und
- im Labor als Trockenmittel.
- Sie wird in der U-, Cu-Aufbereitung und (früher) zur Herstellung von TiO2-Pigmenten
verwendet.
- Bei der Herstellung sehr vieler organischer Produkte ist ebenfalls Schwefelsäure erforderlich
(Farbstoffe, Seifen, Sprengstoff, Detergentien, Kunststoffe, Fasern, Pharma...)
- Stahlbeize, Batterien (Akku)
- Als zweibasige Säure bildet H2SO4 als Salze
Sulfate SO42- und Hydrogensulfate HSO4-.
Diese sind häufig recht stabil und kommen in Form wichtiger Minerale (der elektropositiven Elemente)
auch natürlich vor.
Zur Darstellung der Salze können verschiedene Wege gewählt werden:
- Auflösen von Metallen in H2SO4:
M + H2SO4 ⟶ MSO4 + H2
- Neutralisation von wässr. H2SO4 mit Metalloxiden/Hydroxiden
H2SO4 + MO ⟶ MSO4 + H2O
- wässrige H2SO4 + Salze flüchtiger Säuren (z.B. Carbonate)
H2SO4 + MCO3 ⟶ MSO4 + CO2 + H2O
- Doppelte Umsetzung löslicher Sulfate mit löslichen Salzen
von Metallen (z.B. Bildung von schwerlöslichem BaSO4)
Na2SO4 + MCl2 ⟶ 2 NaCl + MSO4
- Oxidation von M-Sulfiden oder Sulfiten
MS + 2 O2 ⟶ MSO4
Das Sulfation ist ideal tetraedrisch aufgebaut, alle S-O-Bindungen sind gleichwertig, der S-O-Abstand
beträgt 149 pm. Sulfat kann als ein-, zwei- oder verbrückender Ligand in Komplexen fungieren.
Kondensierte Anionen sind das Disulfat
(S2O72-, Anion der Dischwefelsäure)
mit eckverknüpften Tetraedern und einem zentralen O-S-O-Bindungswinkel von 124o.
Disulfate entsteht
- aus SO3 und Sulfaten
- bei der Dehydratisierung der Hydrogensulfate nach
2 NaHSO4 ⟶ Na2S2O7
(vgl. die SO3-Freisetzung beim Sauren Aufschluß:
⟶ - SO3 ⟶ Na2SO4)
Darüberhinaus kennt man auch die höheren Kondensationsprodukte, das
Tri- (S3O102-) und das
Tetra- (S4O132-) Sulfat-Ion.
- Halogenderivate der H2SO4 enstehen bei Ersatz von -OH gegen Halogene (-X).
Die Wasserstoff-freien Verbindungen (Sulfurylhalogenide SO2X2) wurden
in Kap. 5.3. (S-Halogenide) mit besprochen.
Die wichtigsten echten Säuren sind:
- Die Chloroschwefelsäure = Chlorsulfonsäure
wird aus SO3 und HCl hergestellt. Mit H2O
erfolgt Hydrolyse nach
HSO3Cl + H2O ⟶ H2SO4 + HCl
Sie wird als Sulfonierungsmittel eingesetzt:
RH + HSO3Cl ⟶ HO-SO2-R + HCl
- Die Fluorsulfonsäure, HSO3F, kann analog aus SO3 und HF
erhalten werden. Sie findet als Fluorierungsmittel, als Katalysator für Alkylierungs-
und Polymerisations-Reaktionen und zum Polieren von Bleikristallglas Verwendung.
S(+VI), mit Peroxo-Gruppe
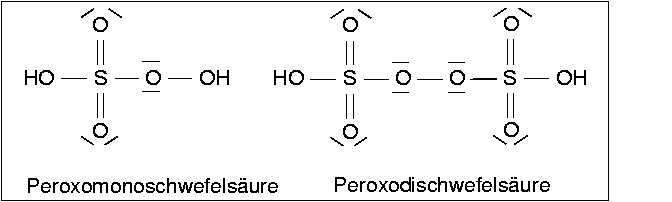 |
| Abb. 5.5.5. Valenzstrichformeln von
Peroxomonoschwefelsäure (H2SO5) und Peroxoddischwefelsäure (H2S2O8)
‣SVG
|
Peroxomonoschwefelsäure, H2SO5 (Carosche Säure)
und Peroxodischwefelsäure, H2S2O8
sind beide starke Oxidationsmittel. Sie enthalten, wie Abbildung 5.5.5 zeigt, die Peroxogruppe -O-O-.
- Die Mono-Säure (auch Caro'sche Säure)
ist ein farbloser Festkörper mit einem Schmelzpunkt von 45oC.
Zu ihrer Darstellung wird Chlorsulfonsäure mit H2O2 versetzt:
H2O2 + ClSO2(OH) ⟶ (HO)(HOO)SO2 + HCl
Die Struktur ist unbekannt. Caro'sche Säure
neigt zur spontanen Explosion, mit H2O erfolgt
Hydrolyse zu H2SO4 und H2O2
(s. das Peroxidverfahren zur H2O2-Herstellung).
- Die Peroxo-DI-Schwefelsäure ist ebenfalls fest, die farblosen Kristalle schmelzen bei 65oC,
Mit H2O erfolgt Hydrolyse zu H2SO5 und H2SO4.
Zur technischen Gewinnung wird die anodische Oxidation von konzentrierter H2SO4
mit hoher Stromdichte, bei Temperaturen unterhalb von 30oC an einer
Pt-Elektrode genutzt.
S(+V)
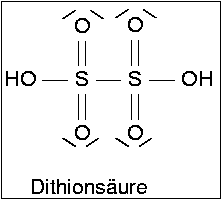 |
| Abb. 5.5.6. Valenzstrichformeln von
Dithionsäure (H2S2O6)
‣SVG
|
Dithionsäure, H2S2O6, enthält
Schwefel in der Oxidationsstufe +V. Zu ihrer Darstellung kann die Oxidation von
SO32- genutzt werden:
2 SIVO32- ⟶ S2O62- + 2 e-
Es handelt sich um eine starke Säure, die in freier Form unbekannt ist.
Ihre Salze disproportionieren leicht (vgl. das Maximum im Voltäquivalentdiagramm Abb. 5.5.3.):
SV2O62- + H2O ⟶ H2SVIO4 + SIVO32-
unter Bildung von S(IV)- und S(VI)-Spezies.
S(+IV)
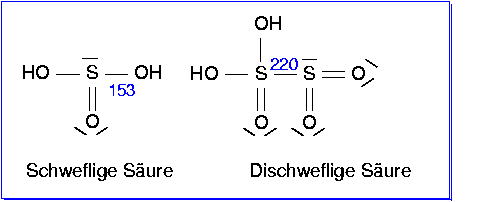 |
| Abb. 5.5.7. Valenzstrichformeln von
Schwefliger Säure (H2S2O6)
und Dischweflige Säure: H2S2O5
‣SVG
|
Schweflige Säure, H2SO3 und
Dischweflige Säure: H2S2O5
sind beide in freier Form unbekannt. Die Lösungen und Salze haben
reduzierende Eigenschaft:
H2SO3 ⟶ H2SO4
Im Alkalischen ist die Reduktionswirkung stärker
SO32- + 2 OH- ⟶ SO42- + 2 e-, -0.936 V
im Sauren schwächer:
SO2 + 2 H2O ⟶ SO42- + +4 H+ 2 e-, 0.158 V
daher: I2 + 2 e- ⟶ 2 I-
Fe3+ + e- ⟶ Fe2+
Als Anionen sind bekannt:
- Sulfite: SO32- (sekundäre Sulfite)
- Hydrogensulfite: HSO32- (Bisulfite, saure Sulfite)
- Disulfite: S2O52- (Pyrosulfite).
Diese können bei hoher Konzentration aus Hydrogensulfit durch
Dehydratisierung erhalten werden.
2 HSO3- ⟶ S2O52- + H2O
SIVO32- + SIVO2
⟶ SIV2O52-
Die Salze sind technisch wichtig, vor allem die Na-Salze und Ca(HSO3)2:
- Na2SO3 entsteht beim Einleiten von SO2 in Natronlauge.
Es wurde früher in der Fotografie und wird heute zum Aufschließen von Zellstoff
in der Papierindustrie, als Antichlor-Mittel in der Textil-Verarbeitung sowie in der
Lebensmittelindustrie zur Konversierung pflanzlicher Lebensmitteln, Getränke und Wein
eingesetzt. (Verbrauch: 216 000 t/a (USA, 1978).
- NaHSO3 entsteht beim Einleiten von Schwefeldioxid in Natronlauge:
SO2 + NaOH ⟶ Na2SO3
und wird zur Darstellung von Na2S2O5 verwendet.
- Na2S2O5
kann durch Einleiten von SO2 in eine alkalische, mit NaHSO3
gesättigte Lösung erhalten werden.
Es wirkt ebenfalls reduzierend und wird in der Foto-, Papier und Lederindustrie
sowie zur Abwasserbehandlung und im Korrsionsschutz eingesetzt.
Von der schwefligen Säure leiten sich wieder durch Ersatz von -OH gegen -X-Gruppen
die entsprechenden Halogen-Derivate ab:
OS(OH)2 ⟶ OS(OH)X (Sulfinsäuren) ⟶ OSX2 (Thionyl-Verbindungen)
S(+III)
 |
| Abb. 5.5.8. Valenzstrichformeln von
Dithioniger Säure, H2S2O4
‣SVG
|
Die dithionige Säure, H2S2O4
ist aufgrund der Oxidationsstufe von +3 am Schwefel ebenso wie die
zugehörgen Salze, die Dithionite, ein starkes Reduktionsmittel.
Die freie Säure ist nicht isolierbar,
da beim Ansäuern der Salze Disproportionierung erfolgt nach:
2 SIII2O42- + H2O ⟶
2 HSIVO3- + SII2O32-
Die Darstellung erfolgt auf dem Weg der Reduktion von schwefliger Säure oder
von Hydrogensulfiten z.B. mit Zn-Staub, Na-Amalgam, Na-Formiat oder Na-Borat;
- Zn-Staubverfahren:
Zn + SO2 ⟶ ZnS2O4
ZnS2O4 + 2 NaOH ⟶
Zn(OH)2 + Na2S2O4
- Formiatverfahren:
HCOONa + 2 SO2 ⟶ Na2S2O4 + CO2 + H2O
Technisch wird vor allem Na-Dithionit Na2S2O4
(Weltproduktion: 250-300 000 t hergestellt und wegen seiner reduzierender Eigenschaften
als Färbe- und Druckereihilfsmittel, zum Bleichen von Textilien und Papier
(z.B. Entfärben) eingesetzt.
S(+II)
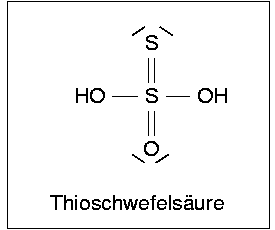 |
| Abb. 5.5.9. Valenzstrichformeln von
Thioschwefelsäure, H2S2O3
‣SVG
|
In der Thioschwefelsäure, H2S2O3
beträgt die Oxidationsstufe von Schwefel nur im Mittel +II, es liegt, wie Abb. 5.5.9 zeigt,
S+V neben S-I vor.
- Ausgehend von normaler Schwefelsäure ist ein O-Atom in H2SO4
durch Schwefel ersetzt (Bezeichung: Thio)
- Die freie Säure ist bei -80 oC als farblose ölige Flüssigkeit
frei isolierbar.
- Die wird aus Schwefeltrioxid und Schwefelwasserstoff erhalten werden:
SO3 +H2S ⟶ H2S2O3
- Die Salze heißen Thiosulfate und sind in Wasser beständig.
Zu ihrer Darstellung kann Schwefel mit Natriumsulfit umgesetzt werden:
Na2SO3 + 1/8 S8 ⟶ Na2S2O3
Alternativ kann auch von Natronlauge, Schwefeldioxid und elementarem Schwefel
ausgegangen werden:
2 NaOH + SO2 + S ⟶ Na2SO3 + H2O
Natrium-Thiosulfat kristallsiert dabei als
Pentahydrat, Na2S2O3 . 5 H2O, das
als Fixiersalz im Handel ist.
Bei dieser Herstellung werden S8-Ringe durch die Anlagerung von
Sulfit SO32- abgebaut, wobei ein nucleophiler Angriff
des freien Elektronenpaars am Sulfit-Schwefel.
s8+so3.ps
Beim Ansäuern wird Schwefel abgeschieden:
H2SO3 ⟶ H2O + SO2 +S
- 90% des Thiosulfates wurde früher als 'Fixiersalz' in der Fotografie genutzt, da es
Silberhalogenide unter Komplexbildung (Di-Thiosulfato-Argentat(I)-Komplexe)
auflöst:
2 S2O32- + AgBr ⟶
[Ag(S2O3)2]3- + Br-
In neuerer Zeit wird Schnellfiziersalz, NH4-Thiosulfat verwendet.
Bis heute wird Thiosulfat als sog. 'Antichlor' in Bleichereien und bei der Papierfabrikation
eingesetzt. Hierbei wird mit Hilfe von Thiosulfat Chlor aus dem gebleichten Gewebe bzw.
der Papiermasse entfernt:
S2O32- + 4 Cl2 + 15 H2O ⟶ 2 SO42- + 8 Cl- + 10 H3O+
- In der Analytik nutzt man bei der sog. Iodometrie die folgende quantitative Redox-Reaktion
von Thiosulftat zu Tetrathioniat:
2 SSO32- + I2 ⟶ -O3S-S-S-SO3- + 2 I-
- Thiosulfat wird als Gegenmittel bei Cyanidvergiftungen eingesetzt, da es mit
Cyaniden zu Thiocyanat SCN- abreagiert.
Se- und Te-Sauerstoffsäuren
Selen- und Tellur-Säuren sind in deutlich geringere Zahl bekannt und auch von
geringer praktischer Bedeutung.
Sie enthalten Se und Te nur in den Oxidationsstufen +IV und +VI
(vgl. auch die Anhydride). Zum Teil sind sie den S-Säuren sehr ähnlich.
Die Unterschiede gegenüber den Schwefelsäuren sind:
- Die Säuren mit Se/Te in der Oxidationsstufe +IV sind deutlich weniger
reduzierend als die S(IV)-Säuren. Sie sind zudem schwächere Säuren.
- Die Säuren mit Se/Te in der Oxidationsstufe +VI sind noch stärkere
Oxidationsmittel als die Schwefel(VI)-Säuren.
Se-Sauerstoffsäuren
- H2SeO4, die Selen(VI)-Säure,
wird durch Oxidaton von seleniger Säure mit starken Oxidationsmitteln
wie z.B. Cl2, KMnO4 oder elektrochemisch erhalten.
Wie H2SO4 handelt es sich um eine ölige Flüssigkeit.
- H2SeO3, die Selenige Säure oder Selen(IV)-Säure,
ist beständiger als die Schweflige Säure (vgl. den allgemeinen
Verlauf der Oxidationsstufen im Periodensystem).
Sie ist eine schwächere Säure als die Schweflige Säure.
Ihre Salze heissen Selenite und sind mit zahlreichen Gegenionen sehr gut bekannt.
- Von beiden Selen-Säuren sind auch Halogenderivate bekannt.
Te-Sauerstoffsäuren
- Die Tellursäure oder Orthotellursäure, H6TeO6
bzw. Te(OH)6,
bildet farblose Kristalle, die bei 136oC schmelzen.
Es handelt sich um eine sehr schwache 6-basige Säure.
Salzen dieser Säure sind bis hin zu solchen mit dem
ideal oktaedrischen TeO66--Anion bekannt.
- Die Struktur der tellurigen Säure H2TeO3 (Te(IV))
ist noch unbekannt. Es gibt bei den entsprechenden Salzen sowohl Tellurite
als auch Hydrogentellurite. Darüberhinaus gibt es
auch Polytellurite wie K2TeO5, K2Te4O9, usw.
|