Tab. 7.1.1. Elementeigenschaften von C und Si
Verbindungsbildung
- Sowohl Kohlenstoff als auch Silicium bilden mit elektronegativen Partnern
kovalente Verbindungen, bei denen die Oxidationsstufe 4 (oder weniger, vgl. OC) vorliegt
(z.B. CCl4 , SiCl4).
- Bei den Tetrelen bilden nur Silicium und Kohlenstoff miteinander
Verbindungen aus. SiC (Karborundum) hat eine Härte von 9.5 (nach Mohs) und
ist ein wichtiger Hochtemperatur-Halbleiter (z.B. für Heizrohre in Hochtemperaturöfen).
Auch mit anderen Nichtmetallen ähnlicher Elektronegativität
werden kovalente Verbindungen gebildet (z.B. Si3 N4 ,
B13C2).
- Mit elektropositiven Partnern (Alkali/Erdalkalimetalle) werden Carbide (z.B. CaC2)
und Silicide (CaSi2) gebildet.
Graphit-Intercalate wie LiC6 (KC8)
(s. Alkalimetalle, VL Metalle)
sind wichtige Elektronenmaterialien in modernen Li-Ionenakkus.
Fulleride wie K3C60 sind bei tiefen Temperaturen supraleitend.
- Ähnlich wie bei Stickstoff werden mit Übergangsmetallen metallische Carbide
(wie z.B. WC, TiC usw.) gebildet.
Vorkommen
- Kohlenstoff kommt sowohl elementar als auch gebunden in Carbonaten vor.
Elementar gibt es Vorkommen sowohl als Diamant als auch als Graphit (Kohle, Koks, usw.).
Die Hauptmenge liegt in der Natur in Form von Carbonaten
wie CaCO3 (Kalkstein, Marmor, Kreide), Ca/Mg-Carbonat (Dolomit) oder
MgCO3 (Magnesit) vor.
Kohlenstoff ist ein wichtiger Bestandteil im Pflanzen- und Tierreich.
Die normale Luft enthält 0.03% CO2, im Meerwasser sind dagegen nur 0.0005 %
enthalten.
- Silcium kommt ausschließlich in Oxiden, in
einer riesigen Zahl verschiedener Silicate vor allem der Alkali-, Erdalkali- und
als Aluminiumsilikate vor. Auch das Dioxid SiO2 (Quarz) ist
ein wichtiger Bestandteil der Lithosphäre. Silicium ist das
zweithäufigste Element (27.2 %) der Erdkruste nach Sauerstoff (45.5 %).
Strukturen
Nach der 8-N-Regel sind die Elemente der IV. Hauptgruppe in kovalenten Verbindungen 4-bindig. Aufgrund der
VSEPR-Regeln bzw. der Hybridisierung bilden sich Raumnetze (Diamant-Struktur).
Nur wenn, wie beim Kohlenstoff, zusätzlich Doppelbindungen ausgebildet werden können,
sind auch niederdimensionalere Bauverbände (Schichten wie im Graphit, Ketten wie in
den Nanorörchen oder Moleküle wie in den Fullerenen) als Strukturelemente möglich.
Kohlenstoff bildet verschiedene Modifikationen. Graphit ist dabei, wie das Phasendiagramm in Abbildung 7.1.1.
erkennbar, die bei Normalbedingungen stabile Form, Diamant ist die Hochdruckform,
allerdings bekanntermassen bei Raumtemperatur metastabil beständig.
Alle anderen Modifikationen sind bei allen Temperaturen und Drücken metastabil.
 |
| Abb. 7.1.1. p-T-Diagramm von Kohlenstoff
‣SVG
|
- C und Si:
Bei sp3-Hybridisierung (CN 4, Tetraeder) folgen Raumnetze (Diamant-Strukturen),
die sich durch die
unterschiedliche Stapelfolge gewellter Sechsringnetze (Sesselkonformation) beschreiben lassen.
Je nach Stapelfolge unterscheidet man:
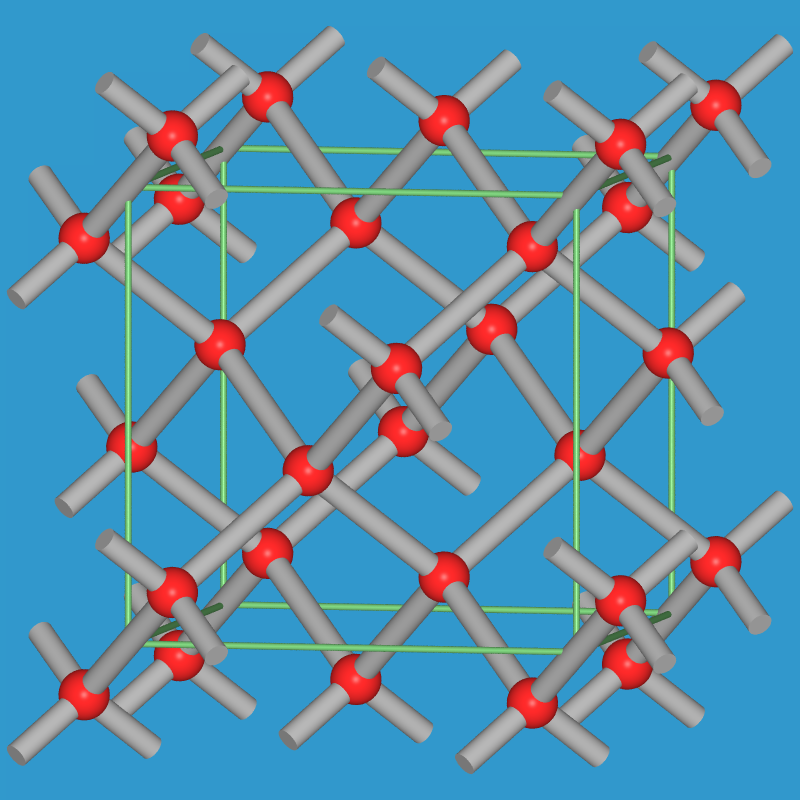
- Im kubischen oder normaler Diamant (A4-Typ)
sind die Netze nach ..ABC.. gestapelt. Auch zwischen den Schichten entstehen
ausschließlich Sechsringe mit Sesselkonformation. Die Zinkblende (ZnS) ist
eine Ordnungsvariante des Diamanten, in der die C-Atompostitionen alternierend
von Zn und S eingenommen werden.
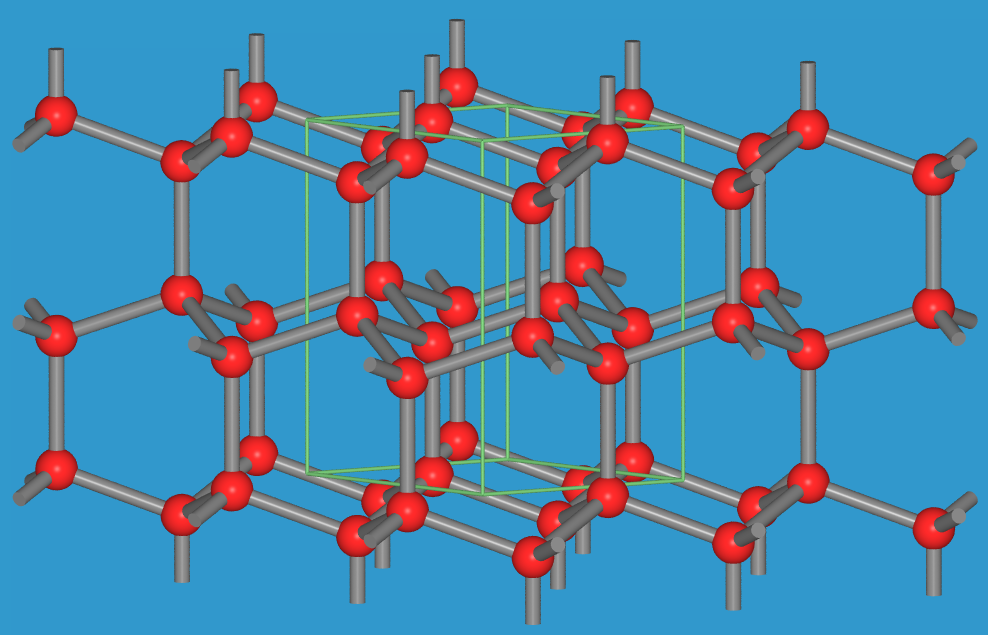
- Der hexagonale Diamant (sog. Lonsdaleit) entspricht analog der
Wurtzit-Modifikation von ZnS.
In der rein kovalenten Strukturbeschreibung folgen die gewellten Sechsecknetze
mit der Stapelfolge AB aufeinander. Zwischen den Schichten werden damit
Sechsecke in Wannenform ausgebildet und die Struktur enthält senkrecht zu den
Basisschichten relativ große Kanäle.
- Im Prinzip sind unendlich viele weitere Stapelvarianten möglich. Diese
werden z.B. als sogenannte Polytype bei den SiC-Modifikationen auch wirklich beobachtet.
Hier dazu ein Beispiel, der sog. Moissanit.
Der C-C-Abstand im Diamant beträgt 154 pm und entspricht damit einer normale Einfachbindung,
der Si-Si-Abstand ist 234 pm.
| Diamant |
kubisch |
hexagonal |
| . |
 |
 |
| VRMLs |
Diamantstruktur (s.a. ST-DB) |
hexagonaler Diamant
und hier mit anderem Ursprung
|
| ZnS |
Zinkblende |
Wurtzit |
| Sechsringe |
alle in Sessel-Konformation |
in der Schicht Sessel-, dazwischen Wannen-Konformation |
| Stapelfolge |
..ABC.. |
..AB.. |
| Zahl/Größe der Lücken |
1 pro 1 C-Atom ⟹ klein |
1 pro 2 C-Atome ⟹ groß |
| gestopfe Varianten |
NaTl |
CaGa2 |
Abb. 7.1.2. Kubischer und hexagonaler Diamant
- C: Durch sp2-Hybridisierung (CN 3, trigonale planare Koordination) können weitere Modifikationen
erklärt werden:
- Im Graphit liegen ebene Sechsecke aus trigonal planar koordinierten C-Atomen vor.
Es gibt auch hier unterschiedliche Stapelfolgen, ABAB
(hexagonaler Graphit) oder ABC (rhomboedrischer Graphit)
und daneben viele Polytype. Im Unterschied zum isoelektronischen BN (Bornitrid)
liegen die C-Atome der Folgeschicht immer über den Sechsecklücken!
Der C-C-Abstand beträgt 141.5 pm (1 1/3 fache Bindung) in bzw. 335.4 pm zwischen den Schichten.
Daraus resultiert die starke Anisotropie der physikalischen Eigenschaften.
Graphit ist die mit Abstand wichtigste Form von Kohlenstoff.
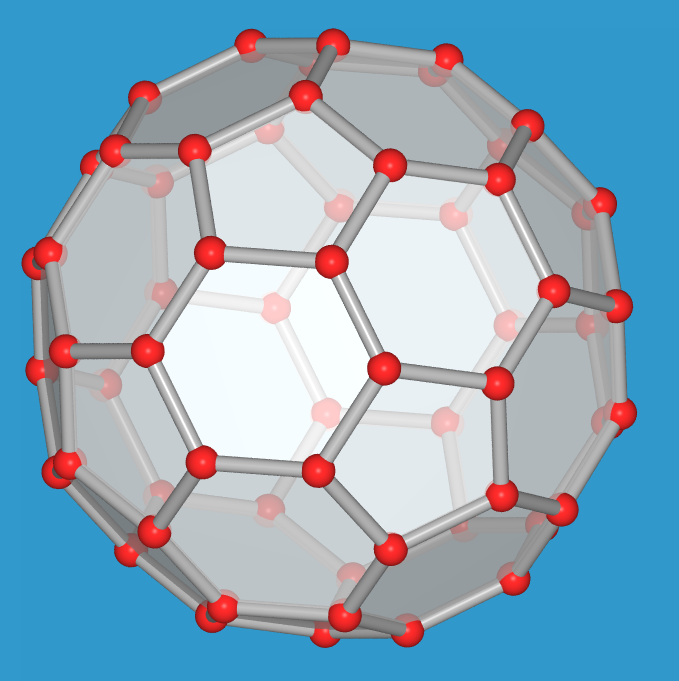
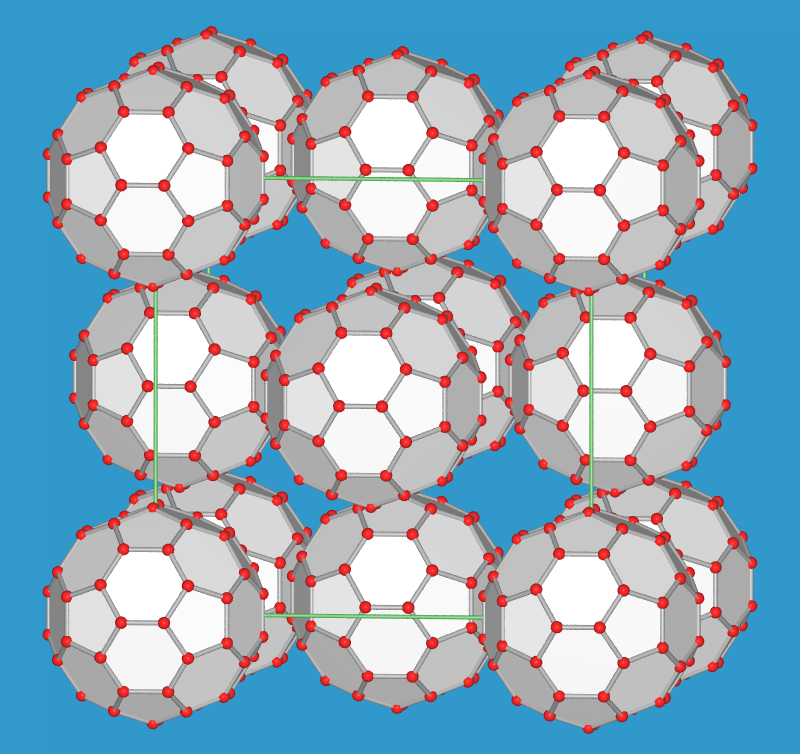
- Das bekannte Molekül aus der Reihe der Fullerene ist C60, der Fußball.
Das Molekül hat volle Ikosaedersymmetrie und besteht wie ein
Fussball aus 20 Fünfecken (weiss) und 12 Sechsecke (schwarz).
Die Doppelbindungen sind in den Sechsringen lokalisiert, der C-C-Abstand
beträgt 141 pm, der Kugelradius ca. 700 pm.
Weitere Fullerene sind C74, C76, C78, C82,
C84, C86, C88, C90 und C94.
Alle Fullerene sind bei allen Bedingungen metastabil. Die Herstellung
erfolgt durch Verdampfen von Graphit in He-Atmosphäre. Auch normaler Russ enthält
in geringen Mengen Fullerene.
Abb. 7.1.3. Graphit und C60: Modifikationen mit sp2
hybridisiertem Kohlenstoff
- Auch die sogenannten Nanoröhrchen (Neudeutsch: Carbon-Nanotubes, CNT, MWCNT, SWCNT)
bestehen aus Kohlenstoff in trigonal-planarer Koordination. Sie können quasi als aufgerollter Graphit
angesehen werden.
Einige Links hierzu:
Weitere Details zur Strukturchemie der Tetrele finden sich
im Kap. 2.2.5. der Vorlesung
Anorganische Strukturchemie.
Je nach Modifikation unterschiedlich:
Physikalische und chemische Eigenschaften
 |
| Abb. 7.1.3. Silicium-Zuchtkörper (Ende!)
|
- C
zeigt in der Graphit-Modifikation gute elektrische Leitfähigkeit, besonders
innerhalb der Schichten und wird daher als Elektrodenmaterial verwendet.
Ebenfalls aus der Struktur leicht erklärbar ist die Verwendung als Schmiermittel.
Die Raumnetzstruktur des Diamant-Gitters bewirkt die extreme Härte von 10 (Mohs-Skala).
Diamant ist ein elektrischer Isolator, leitet aber die Wämre sehr gut.
Diamanten gelten als besonders wertvoll, wenn die 4 C's (clarity, carat, cut, color)
gut sind.
- Si
ist bereits elektrisch etwas leitfähig und wird in grossen Mengen
für Halbleiter-Anwendungen hergestellt. Reinstes Silcium ist ein sog.
Eigenhalbleiter, in dem wenige angeregte Elektronen und Störstellen (Löcher, Defektelektronen)
für die Leitfähigkeit verantwortlich sind. Die Leitfähigkeit
steigt mit der Temperatur, die Bandlücke Eg beträgt 1.17 eV.
Um die Leitfähigkeit zu erhöhen und von der Temperatur unabhängig
zu machen, wird Silicium für die Halbleiteranwendungen dotiert (p-, n-Dotierung, s.u.).
Silicium ist wegen der Bildung einer SiO2-Schutzschicht in Säuren unlöslich, in Laugen
ist es dagegen gut löslich:
Si + 4 OH- ⟶ SiO44- + 2 H2
Darstellung
- C (Diamant) ist laut Phasendiagramm (s. Abb. 7.1.1.)
ab 3000 oC und 130 kbar thermodynamisch stabil.
Praktisch wird Diamant synthetisch mit Katalysatoren wie
metallischem Eisen oder Cobalt bei 1600oC und einem Druck von 70 kbar
hergestellt (20 t/a, d.h. 100 Millionen Karat, da 1 Karat = 0.2 g).
Zunehmende Bedeutung haben auch Isolatorschichten aus Diamant, deren Vorteile
die geringe thermische Ausdehnung, die große Härte,
die gute elektrische Isolatoreigenschaften sowie optische Transparenz
(vom UV bis ins IR) und chemisch Inertheit sind.
Zur Herstellung von Diamantschichten wird die
Mikrowellenplasma-CVD verwendet:
CH4 ⟶ CDiamant + 2 H2
- C (Graphit)
ist sehr wichtig und wird in verschiedenen Formen hergestellt:
- Elektrographit entsteht bei der Pyrolyse von C-Verbindungen bei hoher Temperatur.
Er findet für Elektroden, Tiegel, Wärmetauscher und als Moderator in Reaktoren
Verwendung.
- Graphitfolien
- Koks entsteht durch der Verkokung (starkes Erhitzen) von Steinkohle. Er enthät
damit keine wesentlichen Anteile mehr an H, N, S usw., enthalten sind aber
noch die Silicat- und Metalloxid-Anteile, die beim Verbrennen von Koks
als Asche zurückbleiben.
- Kohlenstoff-Fasern werden durch kontrollierte Pyrolyse organischer Fasern
hergestellt und meist im Verbund mit Kunststoffen im Flugzeugbau, für Skier oder
Tennisschläger verwendet.
- Glaskohlenstoff entsteht bei der Pyrolyse kompakter organischer Polymere und
ist spröde, sehr hart und Hochtemperaturbeständig.
- Pyrokohlenstoff
- Ruß entsteht bei der unvollständige Verbrennung von Kohlenwasserstoffen
(Furnace-Black). Er wird als Gummifüllstoff (Autoreifen) und
Schwarzpigment z.B. in Druckfarben und Lacken in grossen Mengen verwendet.
Hier noch zwei Links mit Abbildungen der Herstellungsverfahren dieses
wichtigsten Schwarzpigmentes:
Weitere Links in der Vorlesung Anorganische Pigmente.
- Aktivkohle entsteht beim Erhitzen von Torf und wird wegen
der große Oberfläche als Adsorbionsmittel eingesetzt.
- Silicium wird in großen Mengen als Reduktionsmittel
und für Halbleiterzwecke aus Quarz hergestellt.
Die Weltproduktion beträgt ca. 5.7 Mill. t (2008), davon werden
4/5 als Ferrosilicium hergestellt. Ca. 1.2 Mill. t werden für Halbleiterzwecke
verwendet. Die Darstellung von Halbleitersilicium für die Chip-Industrie erfolgt
mit den folgenden Schritten.
- Roh-Silizium kann auf verschiedenen Wegen erhalten werden. Allgemein muss
dabei die Reduktion von SiO2 zu Si0 oder Si4-
bewerkstelligt werden.
- Der heute überwiegend genutzte Weg ist die Reduktion
von Quarz mit Kohlenstoff im Lichtbogenofen bei 2000oC:
SiO2 + 2 C ⟶ Si + 2 CO
Dabei muss ein Überschuß an SiO2 eingesetzt werden um die SiC-Bildung
zu unterdrücken.
- Für Legierungs-Si/Reduktionsmittel erfolgt die Reduktion mit Eisen, wobei
Ferrosilicium entsteht.
- Alternative Wege zur Silicium-Gewinnung sind:
SiO2 + CaC2 ⟶ Si + 2 CO + Ca
- oder im Labor:
SiO2 + 2 Mg ⟶ Si + 2 MgO
- oder die aluminthermische Reduktion:
3 SiO2 + 4 Al ⟶ 3 Si + 2 Al2 O3
- Ein neueres Verfahren, das vor allem für Solar-Silcium entwickelt wurde
ist die Reduktion von Na2 SiF6, das als Nebenprodukt bei der
Phosphatdüngerherstellung aus Apatit anfällt, mit Natrium.
Diese Reduktion ist stark exotherm und ohne Energiezufuhr durchzuführen.
- Halbleitersilicium wird z.T. auch aus Elektronik-Schrott durch Chlorierung gewonnen
- oder direkt aus SiHCl3 (Nebenprodukt der Siliconindustrie) erhalten.
- Das erste Problem bei der Herstellung von Halbleitersilicium ist die geforderte
hohe Reinheit, chemische Verunreinigungen müssen unter 10-10 liegen.
Daher folgen der Herstellung von Roh-Silicium eine
Reihe von Reinigungsschritten:
- Die Herstellung flüchtiger Verbindungen (z.B. Silicochloroform):
Si + 3 HCl ⟶ SiHCl3 + H2
erlaubt die destillative Aufreinigung und
anschließende Zersetzung z.B. bei 300oC.
- Eine veraltete Methode (und Labor-Methode) ist die Reduktion mit
2 Mg + Si ⟶ Mg2Si
und die anschließende Silan-Abtrennung:
H+ + Mg2Si ⟶ H4Si
- Die Reinigung erfolgt durch fraktionierte Destillation von SiHCl3 (Silicochloroform),
SiCl4 (Tetrachlorsilan) oder SiH4 (Silan).
- Die Abscheidung erfolgt dann durch:
- thermische Zersetzung:
SiHCl3 + H2 ⟶ Si + 3 HCl
bzw. Silanpyrolyse (80 % der Produktion)
- oder Reduktion mit hochreinem Mg oder Zn.
- Weiter wichtig ist die Darstellung großer Einkristalle, die für eine rentable Chip-Herstellung
erforderlich ist.
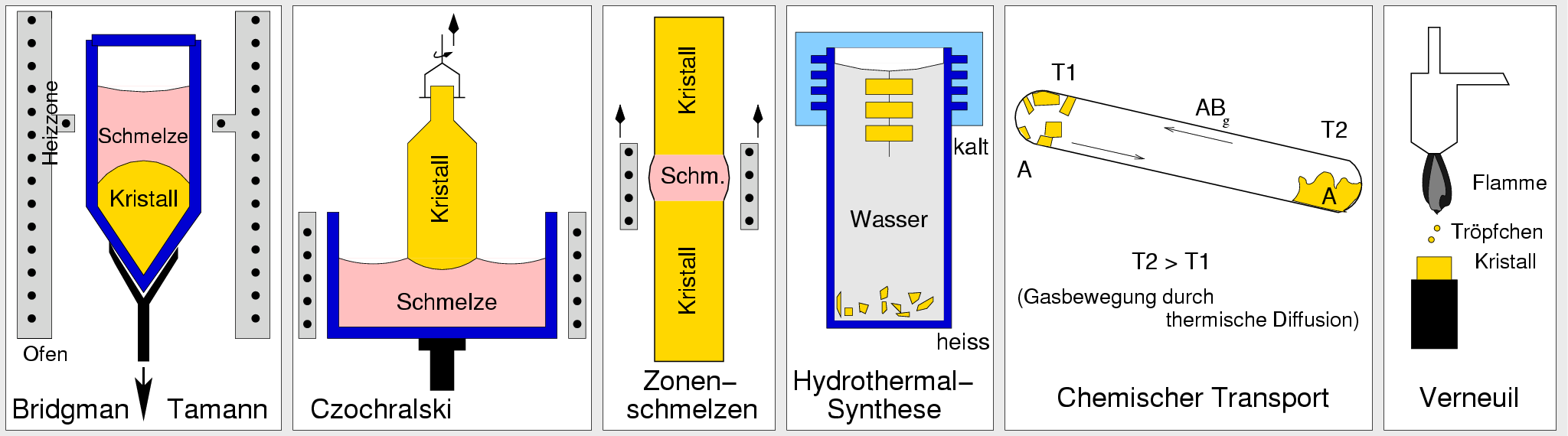 |
| Abb. 7.1.4. Verfahren zur Einkristallzüchtung
‣SVG
|
- Die Züchtung erfolgt i.A. per Czochralski-Verfahren nach (orientierter Keim) [100] oder [111].
Die Verunreinigungen lösen sich in der Schmelze.
Die Versetzungsdichte liegt unter 104 cm-2.
- Das Tiegel-freie Zonenschmelzen wird meist nur als Reinigungsverfahren
(i.A. mehrfach) angewandt. Dabei wird der Si-Stab von unten nach oben
geschmolzen (die Oberflächenspannung verhindert das Tropfen) und
die Verunreinigungen an den Kopf des Stabs transportiert.
- Die Einkristalle werden bereits entweder p- (positiv: B-, Al- oder Ga-dotiert) oder n-
dotiert (negativ: P, As oder Sb-dotiert) hergestellt.
- Aus dem Einkristall werden Wafer durch Zersägen der Zuchtkörper (Abfall, Diamantsägen)
hergestellt.
Bis zum fertigen Chip werden zunächst diverse Reinigungs-, Läpp- und Ätzschritte
angeschlossen.
- Polykristallines Silicum (vor allem für Solarzellen)
wird meist durch Blockgießen oder Bandziehen (d.h. möglichst ohne Sägen)
u.U. auch (partiell) orientiert durch div. Abkühlungsverfahren hergestellt.
- Preise: Roh-Si: 8.1 Euro/kg (2008); Einkristall-Si: 600,- DM/kg ??; Halbleiter: 1700.- DM/kg
- Einige Links zum Funktionsprinzip aus der Angewandten Festkörperchemie:
- Noch einige externe Links zum Thema:
Verwendung (Zusammenfassung)
- C: Reduktionsmittel, Brennstoff, Schwarzpigment, Hartstoff, Elektronenmaterial
- Si: DAS HL-Material, Reduktionsmittel, Legierungszusatz
VRMLs
|