| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
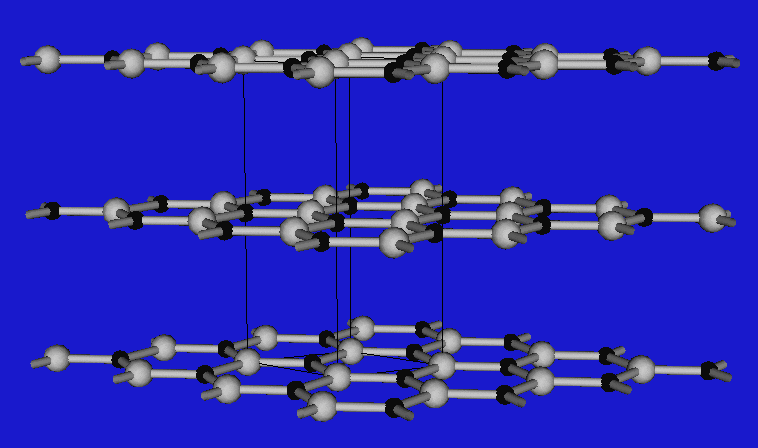
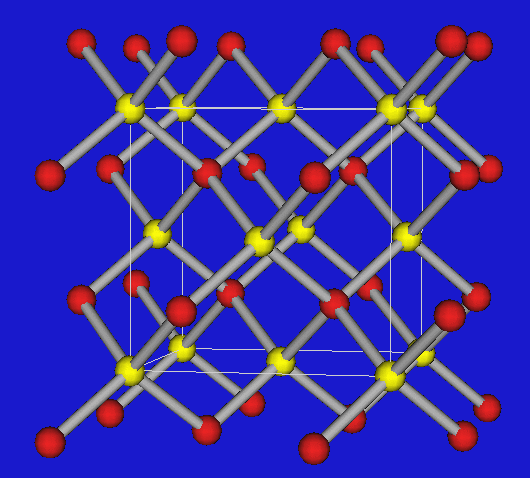
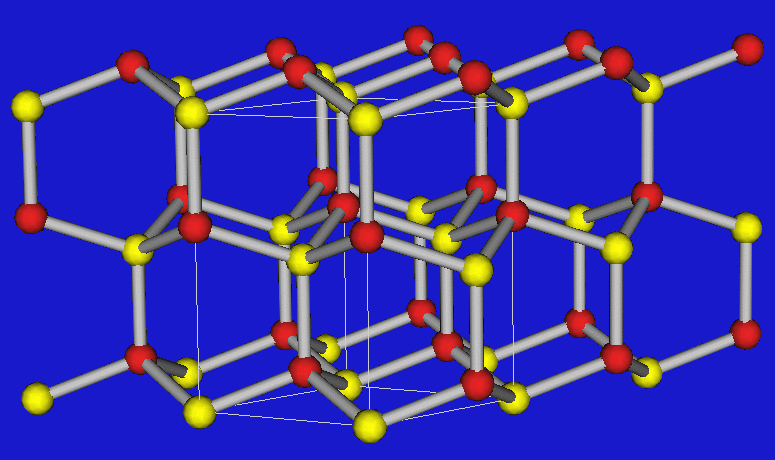
Wenn die Valenzelektronenkonzentration 4 beträgt, lassen sich die Verbindungen von den verschiedenen C-Modifikationen streng im Sinne von Ordnungsvarianten (I) ableiten, d.h. die folgenden drei wichtigen Strukturtypen treten auf:
| BN | Zinkblende (kub. Diamant) | Wurtzit (hex. Diamant) |
 |
 |
 |
Das Vorkommen der einzelnen Strukturtypen ist in Tabelle 2.3.2.1. durch Farben gekennzeichnet.
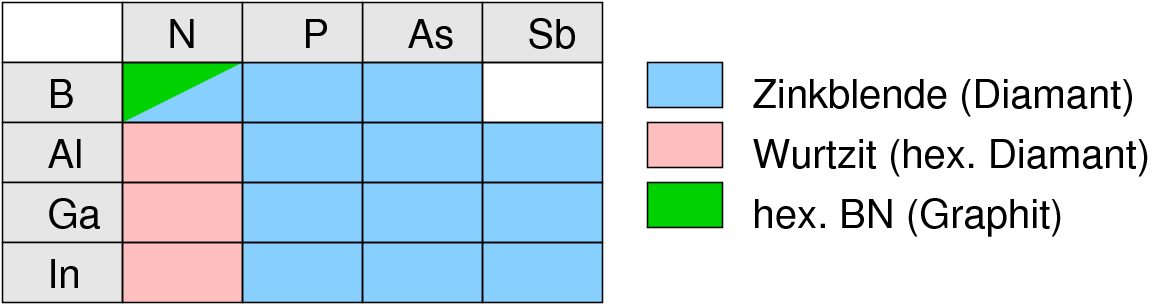 |
Den kubischen Diamanten findet man demnach bei BP, GaAs und InSb, Ordnungsvarianten der hexagonalen Diamantstruktur bei den Nitriden wie AlN, GaN und InN. BN stellt wie Graphit einen Sonderfall dar, in dem Doppelbindungen vorliegen. Im Unterschied zum Graphit findet man die Stapelfolge A-A', d.h. B-Atome kommen direkt über N-Atomen und N- über B-Atomen zu liegen. BN ist weiß und nicht leitfähig. Abbildung 2.3.2.3. zeigt einen Tiegel aus BN. Man kennt auch keine Alkalimetall-Einlagerungsverbindungen wie beim Graphit.
 |
Viele III-V-Verbindungen sind als Halbleiter technisch extrem wichtig. Abbildung 2.3.2.4. zeigt Kristalle einiger Vertreter binärer III-V-Halbleiter, der wichtigste ist GaAs.
 |
 |
 |
| GaAs: Trümmer eines Wafers | InP: Gesägter Einkristall und Bruchstück | InSb: sehr kleine Bandlücke |
Ihr Vorteil gegenüber Silicium als Halbleiter ist die Einstellbarkeit der Größe der Bandlücke durch Mischkristallbildung (Werte in eV):
| AlN: 4.26 | ... | InN: 1.35 |
| ... | ... | ... |
| AlSb: 1.50 | ... | InSb: 0.18 |
sowie die Tatsache, dass die meisten im Unterschied zu Silicium sogenannte direkte Bandlücken zeigen und damit als LED-Materialien verwendet werden können.
 |
In der Zinkblende-Struktur, d.h. als Variante des kubischen Diamanten, kristallisieren BeS, CdS und ZnSe. BeO, MgTe, ZnO und CdS bilden die Wurtzit-Struktur. Bei den Elementkombinationen, bei denen beide Strukturtypen beobachtet werden, ist meist die Wurtzit-Struktur die Hochtemperaturmodifikation. Abbildung 2.3.2.6. zeigt einen geschliffenen Einkristall von Sphalerit (kubisches ZnS).
 |
HgO und HgS bilden unter den II-VI-Verbindungen Ausnahmen, die durch durch den Einfluß der d-Elektronen und der Bevorzugung von Hg2+ für die lineare Koordination zustande kommen.
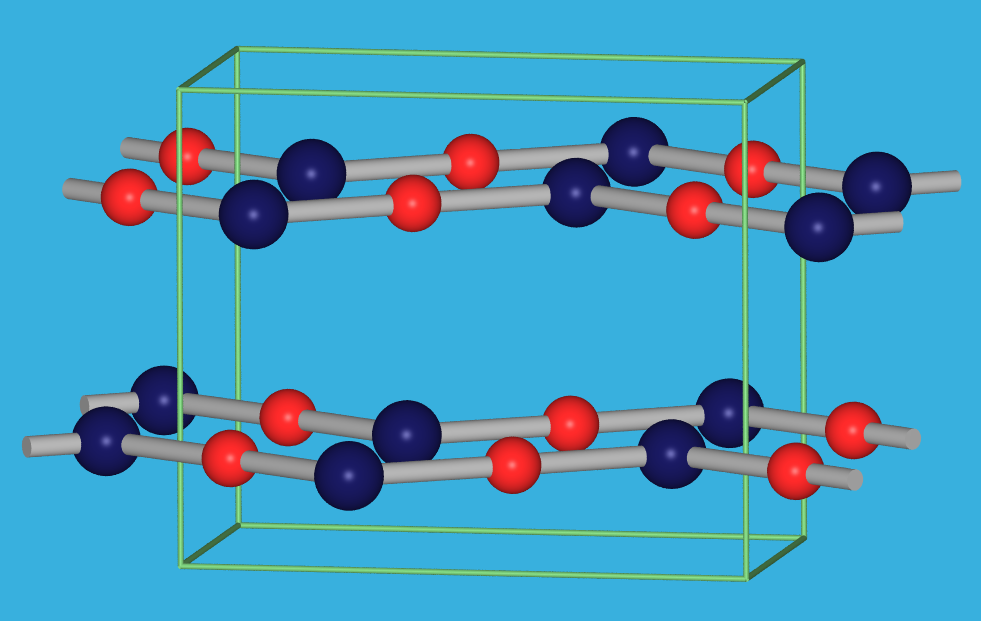 |
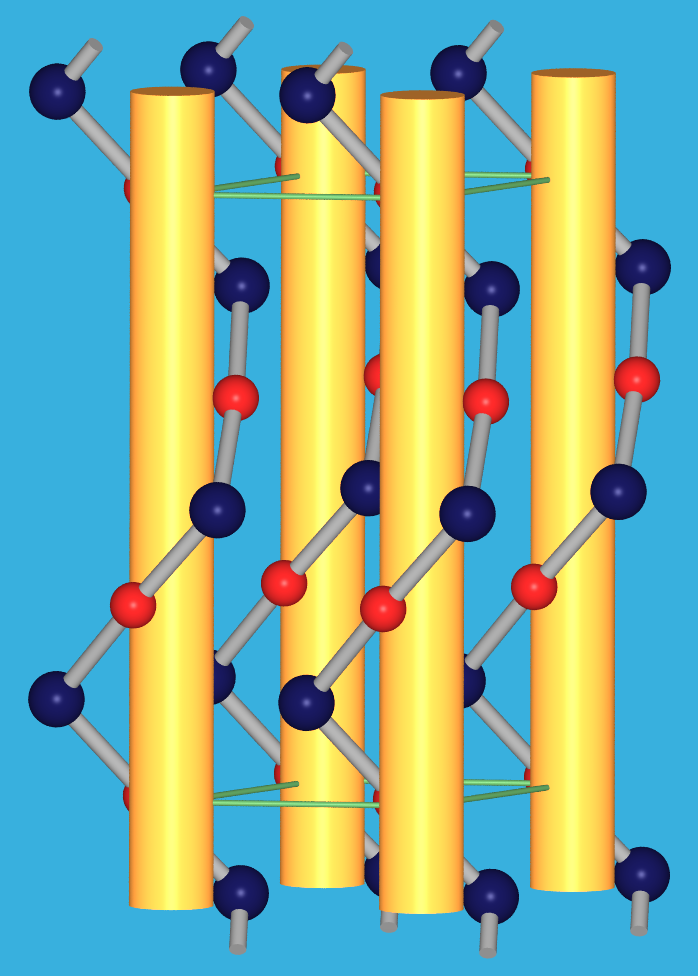 |
| rote Form ‣VRML | gelbe Form ‣VRML |
 |
... und weiter mit den Isosteren der V. Hauptgruppe in (Kap. 2.3.3.) ...
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |