| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
In kovalenten Verbindungen hängt die Zahl der ausgebildeten Bindungen von der Gesamtzahl der Außenelektronen ab (Isosterie). Wenn damit in binären Verbindungen die Zahl der Elektronen/Atom (bei intermetallischen Phasen spricht man von der Valenzelektronenkonzentration, VEC) gleich ist, dann wird die gleiche Zahl von Bindungen ausgebildet, es ergibt sich die gleiche Konstitution und meist gleiche Struktur (Grimm-Sommerfeld-Regel). Der einzige Unterschied zu den jeweiligen Elementen mit derselben VEC ist, dass jetzt polare Bindungen vorliegen und bei weiter erhöhter Polarität schließlich ein Übergang zu den Salzen erfolgt.
Diese Zusammenhänge (die im Kapitel 1.3. in der Abbildung 1.3.1. schon enthalten sind) werden in der sogenannten Grimm-Sommerfeld-Regel-Regel zusammengefaßt:
| Binäre Verbindungen von Elementen der (N-k)- und der (N+k)-ten Hauptgruppe besitzen die Eigenschaften der Verbindungen der N. Hauptgruppe. |
Im Prinzip dieselbe, nur etwas weiter verallgemeinerte Aussage, ist die Formulierung in der sogenannten als Mooser-Pearson-Beziehung:
| (ne + bA - bC)/(nA) = 8 |
Zur Verdeutlichung der Formel sei als Beispiel die binäre III-V-Verbindung GaAs betrachtet:
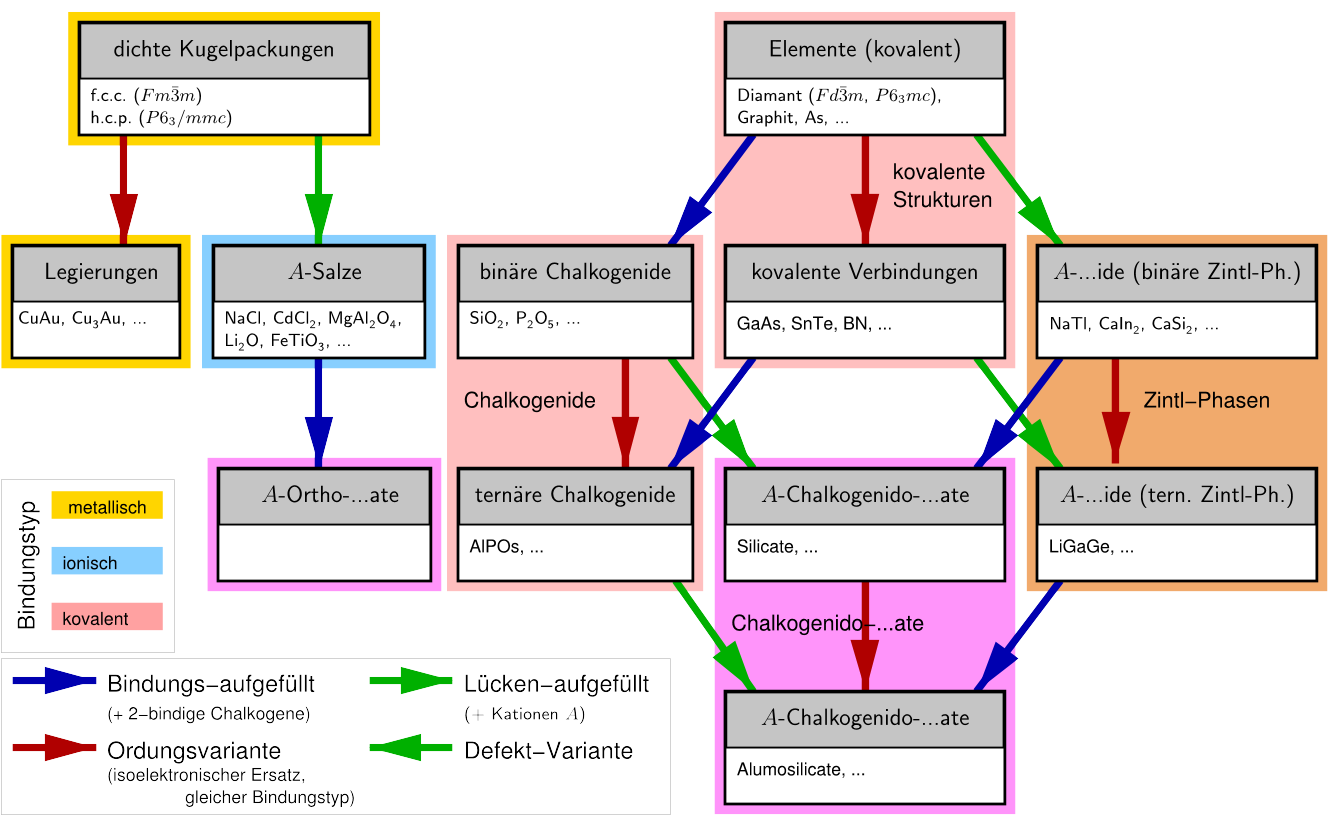
Komplexe kovalente Verbindungen/Ionen und die Analogien zu den Elementstrukturen (s. rechte Seite der Abb. 1.3.1.)
 |
Für alle Fälle sind die strukturelle Analogien umso stärker, je weniger Freiheitsgrade die Struktur hat, d.h. je höherdimensional die Grundstruktur ist. Die Tabelle 2.3.1.1. gibt einen Überblick über diese Art der Strukturzusammenhänge:
| VEC | Grundtyp (Element- Struktur) | Ordnungs- Variante (I) | Bindungsgefüllte Variante (II) | Lückengefüllte Variante (III) | II + III |
|---|---|---|---|---|---|
| 4 | kub. Diamant | Zinkblende | Cristobalit | NaTl | |
| hex. Diamant | Wurtzit | Tridymit | CaGa2 | ||
| Graphit | BN | - | AlB2 | ||
| 5 | P4 (weiß) | ? | P4O10 | KSn, Na2Tl | |
| P (schwarz) | GeS | O-P2O5 | |||
| As (grau) | SnTe | CaSi2 | Schichtsilicate | ||
| 6 | Se | ? | SO3 | LiAs, CaGe | Kettensilicate wie CaSiO3 |
| 7 | I2 | IBr | Cl2O7 | FeSe2 | Disilicate wie Cs6Si2O7 |
| 8 | Xe | XeO4 | NaCl, Na2S, K3Sb, Ba2Pb | Orthosilicate wie K4SiO4 |
Eine nochmalige Erweiterung bei aufgeweiteten Bauverbänden ist, dass sich zwei identische Bauverbände durchdringen (z.B. Cu2O: Cuprit-Struktur).
Im Folgenden sollen die wichtigsten Strukturen der Elementisosteren behandelt werden, wobei nur die IV. und V. Hauptgruppe mit der sehr direkten strukturellen Analogie betrachtet werden. Diese Konzepte funktionieren selbstverständlich nur dann, wenn die 8-N-Regel erfüllt ist. Daher werden im Anschluß noch elektronenreiche kovalente Verbindungen mit Oktettüberschreitung, solche mit Mehrfachbindungsanteilen sowie mit Elektronenmangel (Cluster) besprochen.
... und los gehts mit den Isosteren zu den Elementen der IV. HG (Kap. 2.3.2.) ...
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |