- bei Molekülverbindungen z.B.
- Edelgasverbindungen wie XeF2, XeF4 usw.
- aber auch tausende einfacher Anionen (z.B. Polytelluride wie I3-), Chlorat, Sulfat ...)
- bei Festkörperverbindungen ebenfalls Verbindungen der schwereren Elemente. Als
Beispiel hierfür sollen nur drei kovalente Verbindungen genannt werden (vgl. Abb. 2.3.5.2):
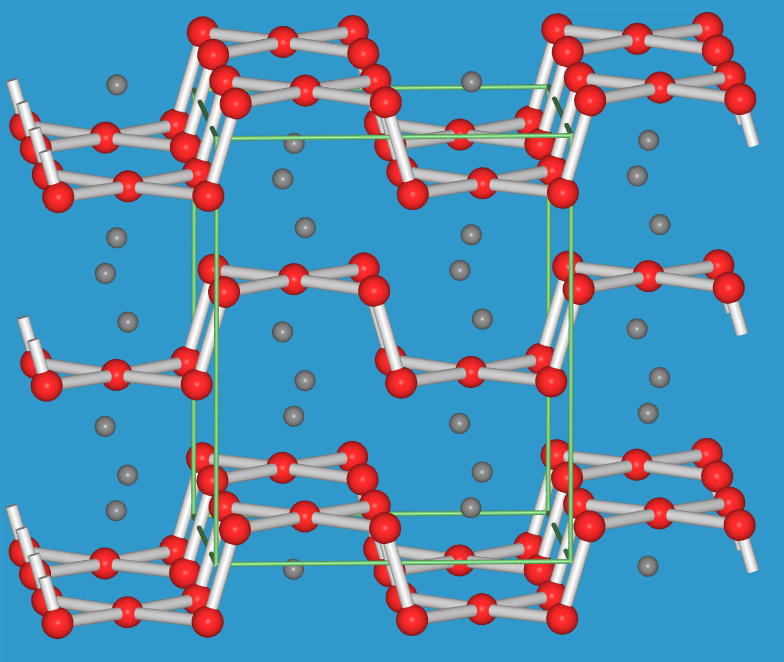
- Ein einfaches Beispiel kann das kettenförmige Anion Te52- in
Cs2Te5
betrachtet werden. Es besteht aus
- vier zweibindigen Te-Atomen (Te0).
- einem quadratisch-planar koordiniertem Te-Atome, für das sich aus der Ladung eine formale Ladung von Te2- ergibt. Die Koordination ist damit mit der eines Edelgasatoms z.B. von Xe (z.B. in XeF4) vergleichbar.
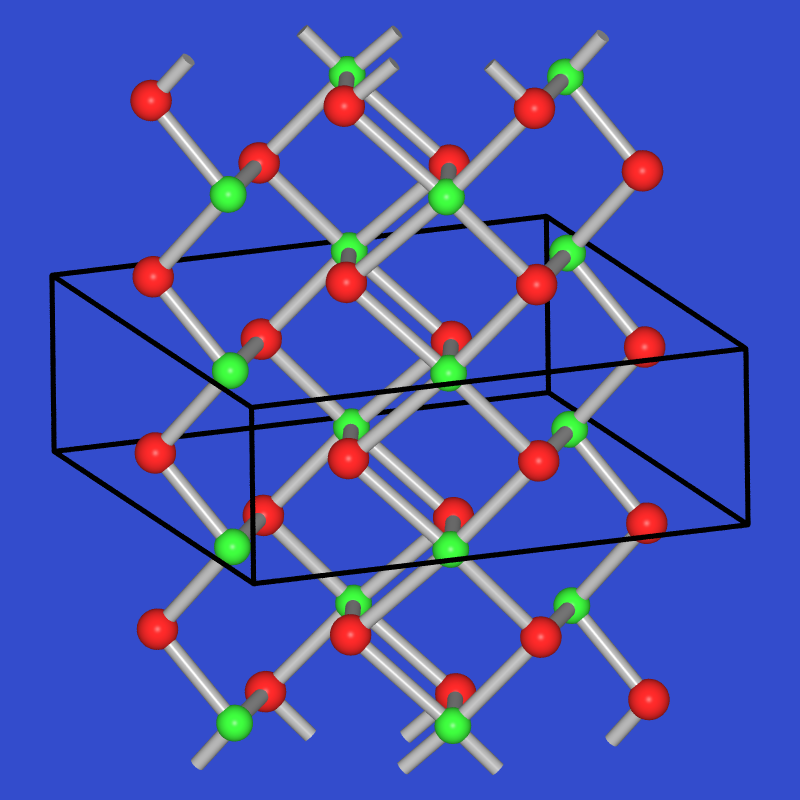
- Ein weiteres Beispiel einer Struktur mit Oktettüberschreitung ist
Sb2S3, auch als Stibnit, Antimonit oder Grauspiessglanz
bekannt. Der letztgenannte Name ergibt sich sofort aus der Form und Farbe des Minerals (s. Abb. 2.3.5.1.).
Abb. 2.3.5.1. Grauspiessglanz, Sb2S3
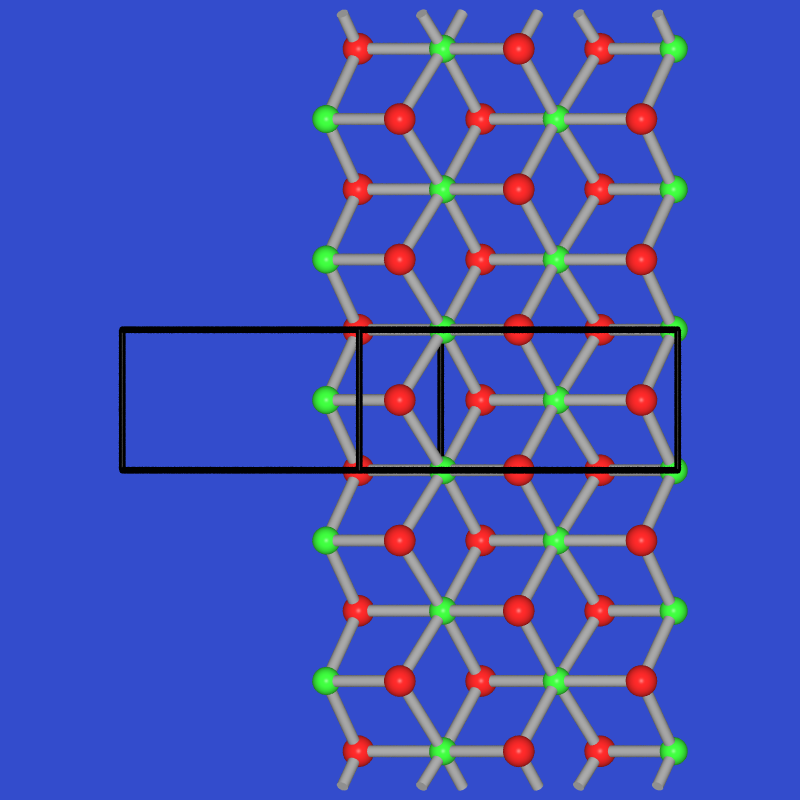
Die Struktur (Abb. 2.5.3.2. Mitte) besteht aus Bändern, diese wieder bestehen aus
- einem zweibindigen S-Atom (S0)
- zwei dreibindigen S-Atomen (S+)
- einem drei-bindigem Sb-Atome (Sb0)
- einem ψ-oktaederisch koordiniertem Sb-Atom, d.h. das 'Lone-Pair' ist hier stereochemisch aktiv, (formal Sb2- vgl. BrF5).
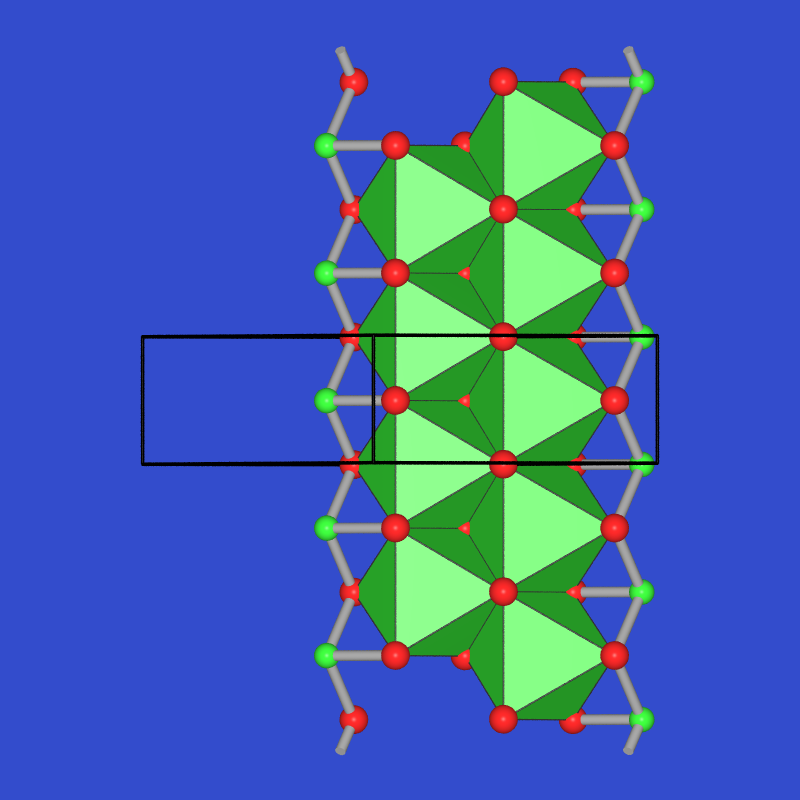
- Bei As2Te3
(Abb. 2.3.5.2. rechts) liegen die Verhältnisse ähnlich: Es liegt auch hier eine Bandstruktur vor, in der
- alle Te-Atome dreibindig (Te+),
- ein As-Atome ebenfalls dreibindig (As0)
- das andere aber oktaedrisch unter Oktettaufweitung (As3- = Xe z.B. in XeF6, aufgew. (?) Oktaeder) von Tellur koordiniert ist.
- Ein einfaches Beispiel kann das kettenförmige Anion Te52- in
Cs2Te5
betrachtet werden. Es besteht aus