| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
Die polyanionischen Verbindungen sind als aufgefüllte Varianten
im Sinne von Kationengefüllten kovalenten (Element-analogen) Netzen
(gestopfte Varianten, III) zu betrachten.
Im weitesten Sinne handelt es sich dabei um Zintl-Phasen.
Zintl-Phasen entstehen, wenn elektropositive Metalle der Gruppe A1 (ohne Beryllium)
mit elektronegativen B2-Elementen oder auch mit Zinn, Blei, Aluminium, Gallium, Indium oder Thallium
eine Verbindung eingehen.
Die eigentliche Trennlinie für das Auftreten von Zintl-Phasen verläuft
zwischen der 3. und 4. Hauptgruppe (sog. Zintl-Linie für die Ausbildung von Anionen).
Die elektropositiven Metalle der Gruppe A1 (ohne Be) bilden binäre
Verbindungen mit
den elektronegativen Elementen B2, die sich gemäß der hohen
Elektronegavitätsdifferenz nach ionischen Konzepten verstehen lassen:
Hierzu erfolgt die Zerlegung in A1-Kationen und (komplexe) (B2)x-Anionen.
Aufgrund der hohen Elektronegativität der Metalle B2 läßt sich
der so entstehende Anionenteilverband nach den Regeln für kovalente Verbindungen
(8-N-Regel) strukturell verstehen (sog. Zintl-Klemm-Busmann-Konzept).
Bezüglich ihrer physikalischen
Eigenschaften sind die Zintl-Phasen den Halbleitern zuzurechnen, wobei die
Bandlücke - wie auch bein den entsprechenden einfachen B2-Elementen - im
Periodensystem von links nach rechts zunimmt (links: Übergang zu den
echten intermetallischen Phasen/Metallen; rechts: Übergang zu den typischen Salzen).
| H | He | ||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
Viele Verbindungen mit Elementen an oder links der Zintl-Linie z.B. mit Sn, Pb, Al, Ga, In oder Tl sind typische Clusterverbindungen, die sich aber mit dem erweiterten Zintl-Klemm-Konzept unter Anwendung der Wade-Regeln für den Anionenverband ebenfalls strukturell verstehen lassen.
Das Prinzip der Bindung in den Zintl-Phasen ist, dass eine recht große Differenz der Elektronegatvitäten zwischen den beiden Bindungspartnern vorliegt und damit zunächst ionische Konzepte greifen. Es ist also für das Verständnis der Strukturen und Bindungsverhältnisse möglich, die Phasen formal in A1-Kationen und (meist komplexe) [B2]x-Anionen zu zerlegen. Der Anionenteilverband wird dann nach den Regeln für kovalente Verbindungen (8-N-Regel) strukturell verständlich, sog. Zintl-Klemm-Busmann-Konzept. Der Anionenverband muß in diesem verallgemeinerten Fall also nicht notwendigerweise elementanalog sein.
Von den physikalische Eigenschaften her sind die Zintlphasen Halbleiter. Die Bandlücke steigt, wenn der B2-Partner weiter rechts im Periodensystem steht; außerdem ist sie - wie auch bei den einfachen kovalenten Verbindungen - von der Dimensionalität des kovalenten Bauverbandes abhängig. Damit erhält man beim Gang von B2 nach links den Übergang zu den 'echten' metallischen Legierung, nach rechts den Übergang zu den typischen Salzen. Zintl-Phasen sind stöchiometrisch scharf. Sie schmelzen im Vergleich zu anderen Legierungen meist recht hoch. Die Reaktivität ist sehr unterschiedlich und reicht von extrem luftempfindlich bis sehr stabil. Sie sind als Halbleiter schlechtere elektrische Leiter als die Metalle, die Leitfähigkeit steigt mit der Temperatur. Technisch sind Zintl-Phasen ohne Bedeutung, einige Verbindungen werden aber als Thermoelektrika diskutiert.
CaGe ⟶ Ca2+ + Ge2- (Ge-Ketten ähnlich denen in Selen und Tellur, s. Abb. 2.4.2.)
Ca2Ge ⟶ 2 Ca2+ + Ge4- (isolierte Ge, Isosterie zu den Edelgasen, s. Abb. 2.4.3.)
 |
 |
 |
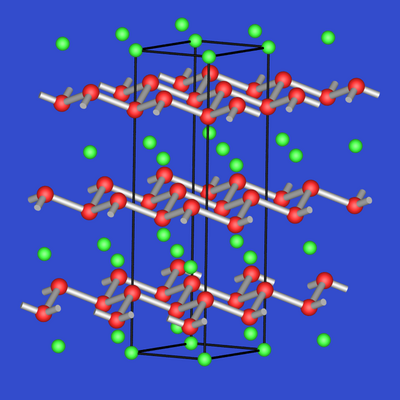
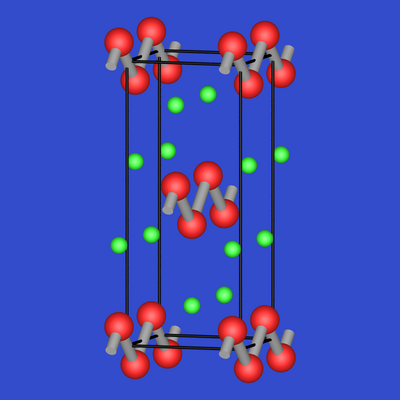
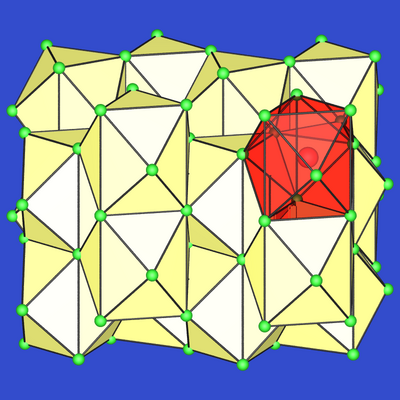
| Abb. 2.4.1. CaSi2 | Abb. 2.4.2. CaSi | Abb. 2.4.3. Ca2Si |
Es sind jedoch auch eine ganze Reihe binärer Zintl-Phasen bekannt, in denen das B2-Metall in unterschiedlichen Oxidationsstufen/Bindigkeiten vorkommt, so dass gebrochene mittlere Bindigkeiten resultieren (graue Spalten unten). Entweder liegen zwei verschiedene Anionen nebeneinander vor, oder die Metallatome unterschiedlicher Bindigkeit bilden gemeinsam ein komplexeres Anion. Z.B.
Ba3Ge4 ⟶ 3 Ba2+ + Ge46- ('Butterfly', Ge mit Bindungsordnung 2 und 3, s. Abb. 2.4.5.)
 |
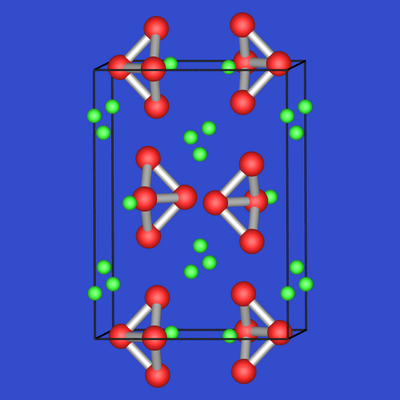 |
| Abb. 2.4.4. Ba5Si3 | Abb. 2.4.5. Ba3Si4 |
In der folgenden Tabelle sind die Strukturen einiger ausgewählter Beispiele von Zintl-Phasen zusammengefaßt. Alle können nach dem Zintl-Klemm-Konzept strukturell verstanden werden. Anklicken der Formel führt zur VRML-Darstellung (die B2-Element sind dabei als rote Kugeln dargestellt), (#) sind jeweils Links auf eine kurze Erklärung der strukturellen Details. Statische Bilder der wichtigsten Beispiele sind auf den Vorlagen 2.5. und 2.6. abgebildet.
Die Zintl-Linie zwischen der III. und IV. Hauptgruppe wird nur bei wenigen
Beispielen (z.B. NaTl, LiGa) durchbrochen. Die Verbindungen unten rechts bilden den Übergang zu
einfachen ionischen Verbindungen. Abschluß aller rosa Reihen (einheitliche
Bindigkeit) sind die Elemente, zu denen der Anionenteilverband der Zintl-Phasen isoelektronisch und
strukturell vergleichbar ist.
Analog wie in NaTl liegt auch in CaGa2
ein 4-bindiger Anionenteilverband vor:
Tab. 2.4.1. Strukturchemie von Zintl-Phasen (Beispiele nach Bindigkeit)
mittlere Bindigkeit
Bindigkeit
E(III)
B2=E(IV)
B2=E(V)
B2=E(VI)
B2=E(VII)
E(VIII)
4
4
NaTl (#) , CaGa2 (#)
Si
3.82
36*4, 8*3
K8Sn44 (#)
3
3
Na2Tl (#)
KSn (#)
P4
CaSi2 (#)
As
2.5
2*2, 2*3
Ba3Si4 (#)
2.333
2*2, 1*3
BaSb3 (#)
2
2
-
CaSi (#)
LiAs (#) , CaSb2 (#)
Se
1.667
4*2, 2*1
Sr2Sb3 (#)
1.5
2*2, 2*1
Sr(en)4Se4en (#)
1.25
1*2, 2*1
K2Te3 (#) , Ba(en)3Te3 (#)
1
1
-
?
?
CaTe2 (#)
I2
0.66
1*0, 2*1
Ca5Si3 (#)
0.5
2*0, 2*1
Ba5Sb4 (#)
0
0
-
Ba2Pb (#)
K3Sb (#)
BaTe (#)
BaI2
Xe
Nochmals extrem vielfältiger (aber noch nach der
Zintl-Klemm-Konzeption zu verstehen) werden die Beispiele für ternäre Zintlphasen
mit zwei unterschiedlichen B2-Metallen.
Nur ein paar Beispiele im Kapitel 6.3. der Vorlesung
Intermetallische Phasen.
Details zu den Strukturen der obigen Tabelle
Isostere zu den Elementen der IV.-Hauptgruppe (Bindigkeit 4)
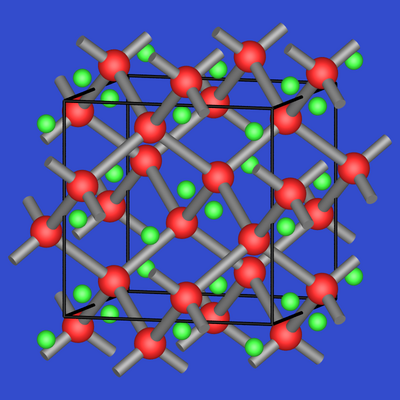
NaTl wird oft als Prototyp einer Zintl-Phase
genannt, obwohl Thallium als
Element der III. Hauptgruppe links von der Zintl-Linie liegt. Entsprechend der ionischen Zerlegung:
 |
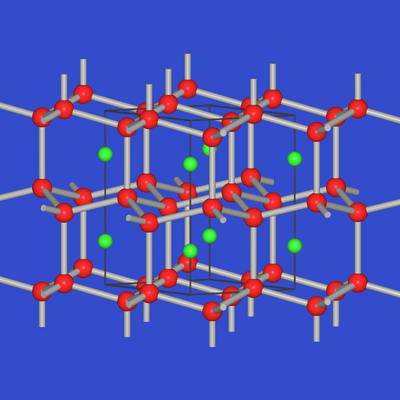 |
| Abb. 2.4.6. NaTl | Abb. 2.4.7. CaGa2 |
 |
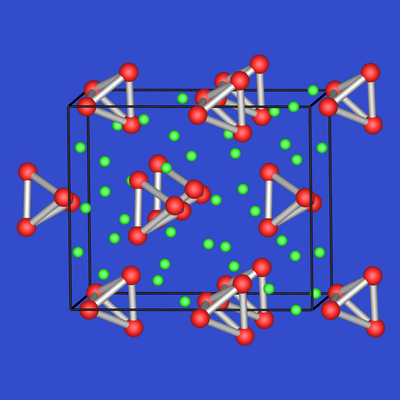
| Abb. 2.4.8. K8Si44 |
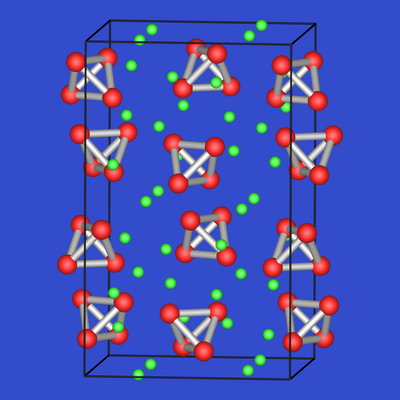
Der Anionenteilverband in Verbindungen wie KSn
entspricht gemäß:
In Verbindungen wie CaSi2
 |
 |
 |
| 2.4.9. Na2Tl | 2.4.10. KSn | 2.4.11. CaSi2 |
BaSb3
besteht nach:
 |
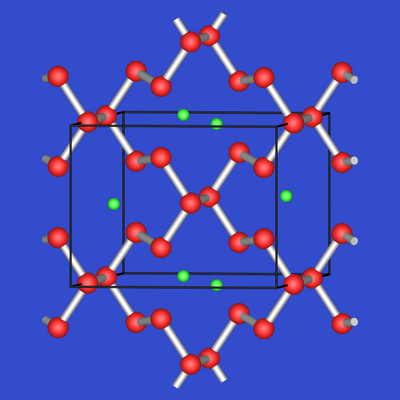 |
| 2.4.12. Ba3Si4 | 2.4.13. BaSb3 |
Auch in den Monopenteliden der Alkalimetalle wie z.B. in
LiAs ist der E(V)-Teilverband isoelektronisch zu den Chalkogenen:
Auch in den Dipenteliden der Erdalkaimetalle wie z.B. in
CaSb2 ist der E(V)-Teilverband isoelektronisch zu den Chalkogenen:
 |
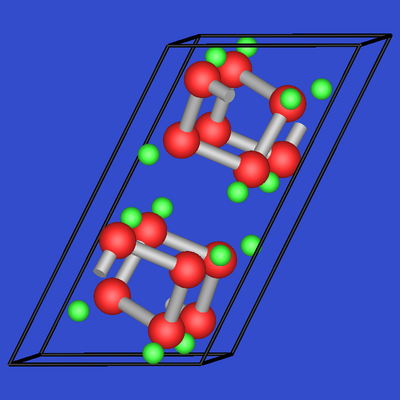 |
| 2.4.14. CaSi | 2.4.15. LiAs |
| ⇦ | Inhalt | Einleitung | Kovalente FK | Metalle | Ionenkristalle | Literatur | ⇨ |
| cr_home | Metalle | Nichtmetalle | FK-Chemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |