Vorlesung: Festkörperchemie
2. Reaktionen und Synthesen
2.3. Thermische Analyse
Vorlagen und Präsentationen
Bei der thermischen Analyse werden verschiedene Größen als
Funktion der Temperatur untersucht. Je nachdem, welche
Größe untersucht wird, unterscheidet man die folgenden
Methoden:
- Die Enthalpie (ΔH) kann in
drei unterschiedlichen Methoden gemessen werden:
- Thermoanalyse (TA) (nur T-Messung)
- Differentialthermoanalyse (DTA) (Messung ΔT gegen Referenz)
- Differential-Scanning-Kalorimetrie (DSC) (echte Wärmemengenbestimmung)
- Werden Gewichtänderungen (Δm) mit der Temperatur
gemessen, spricht man von Thermogravimetrie (TG).
- Bei der thermomechanische Analyse (TMA) (früher Dilatometrie)
werden Änderungen der Abmessungen, z.B. Längenänderungen Δl:
in Abhängigkeit von der Temperatur registriert.
- Darüberhinaus gibt es viele weitere Grössen,
deren Temperaturabhängige Vermessung relevant sein kann, wie
z.B. elektrische oder optische Eigenschaften.
Im folgenden werden nur die für die Festkörperchemie wichtigen
Methoden, die Bestimmung von ΔH und der Massenänderungen Δm
besprochen.
Die Messung von Δm dient dabei der Verfolgung von
Zersetzungreaktionen, Entwässerungen usw.
ΔH:-Messungen sind zur Ermittlung von Phasendiagrammen
(d.h. wiederum für die präparative Chemie) wichtig und
dienen der Untersuchung von Phasenübergängen und der Überprüfung auf
Probenreinheit.
2.3.1. Thermoanalyse: TA, DTA, DSC
Unter dem Begriff Thermoanalyse werden die
eigentliche Thermoanalyse (TA) (einfache Messung der
Probentemperatur in Abhängigkeit von der Temperatur),
die Differenzthermoanalyse (DTA) (Bestimmung der
Temperaturdifferenz der Probe relativ zu einer Referenz
und die Differenz-Scanning-Kalorimetrie (DSC)
(Temperaturabängige Änderung des Wärmeinhalts).
Beim Erwärmen von Stoffen/Stoffmischungen
können verschiedene Effekte wie z.B. Schmelzen,
Erstarren, Zersetzung, Phasenumwandlung, Reaktion usw.
auftreten. Grundsätzlich muss dabei weiter unterschieden
werden in
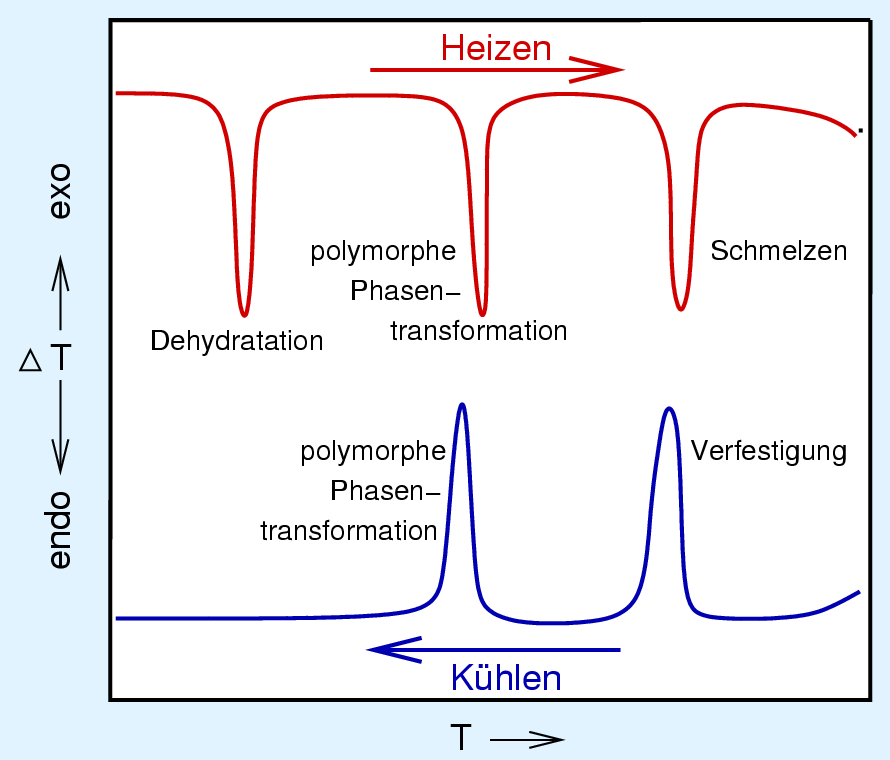
- Exotherme Effekte: Bei der Thermoanalyse (TA) eilt die
Temperatur der eingestellten Temperatur voraus,
bei der Differentialthermoanalyse (DTA) bleibt die Temperatur der Referenzprobe zurück
und bei der DSC muss die Probe gekühlt bzw. die Referenz geheizt
werden.
- Endotherme Effekt zeigen jeweils genau das umgekehrte
Verhalten.
Die Effekte beim Aufheizen sind in der Tabelle 2.3.1. zusammengestellt:
Tab. 2.3.1. Effekte beim Aufheizen
| Reaktion/Transformation | Effekt |
| Phasentransformation 1. Ordnung |
endo |
| Phasenübergang höherer Ordnung |
Schritt in der Basislinie |
| Verdampfung |
endo |
| Schmelzen |
endo |
| metastabil ---> stabil |
exo |
| Zersetzungsreaktion |
endo oder exo |
| flüssig-fest-Reaktion |
endo oder exo |
| fest-fest-Reaktion |
endo oder exo |
| Polymerisation |
exo |
| Chemisorption |
exo |
Die Effekte beim Abkühlen sind dann von den
Effekten/Enthalpien genau umgekehrt.
Effekte, die beim Abkühlen nicht wieder auftauchen
sind irreversibel wie z.B. Zersetzungen, Phasenumwandlungen
von metastabile in stabile Formen usw.
Als Hysterese bezeichnet man den Effekt, dass
die Umwandlungen beim Abkühlen 'später', d.h. erst bei
geringeren Temperaturen auftreten.
Als Beispiel ist in Abbildung 2.3.1. die
DTA-Kurve einer wasserhaltigen Substanz gezeigt.
|
| Abb. 2.3.1. DTA-Kurve einer wasserhaltigen Substanz
‣ SVG
|
Experimentelles:
Bei allen thermoanalytischen Methoden
wird die Probe in einem geeigneten inerten
Tiegel mit einem konstanten Gradienten aufgeheizt
(typische Heizraten sind ca. 1-50 K/min).
Als Probenmenge verwendet man nur ca. 10 bis 20 mg,
damit der Wärmeübergang gut ist und innerhalb der
Probe kein Temperaturgradient bestehen bleibt.
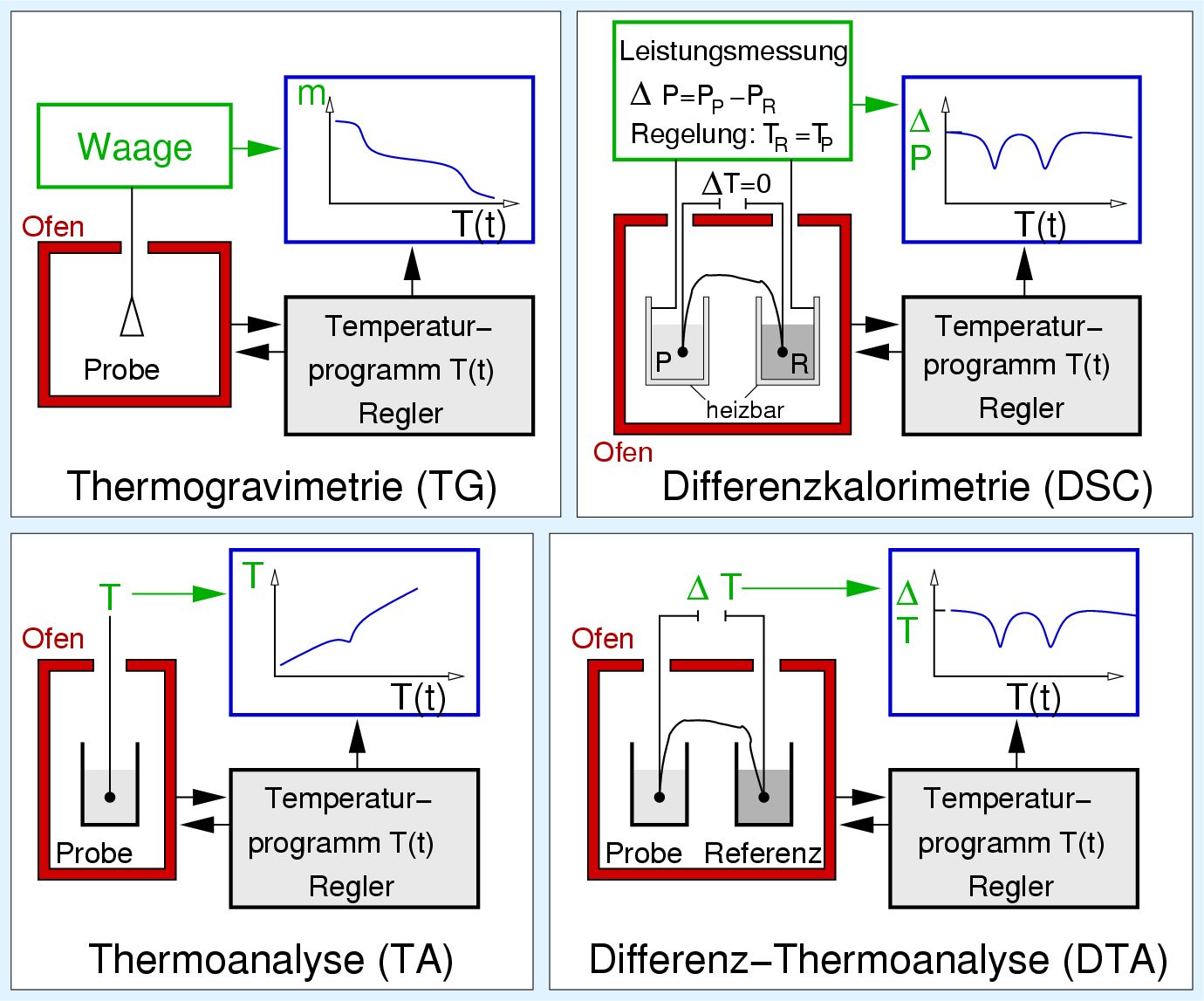
Abbildung 2.3.2. zeigt schematisch den Aufbau
der einzelnen Methoden.
|
| Abb. 2.3.2. DTA und Phasendiagramm
‣ SVG
|
- Bei der sehr einfachen, aber veralteten
Thermoanalyse (Abb. 2.3.2. unten links) wird die Probentemperatur mit einem Thermoelement
aufgezeichnet. Bei endothermen Effekt bleibt die
Probentemperatur TP unter der Geraden Linie zurück
Die Umwandlungstemperaturen können mit dieser Methode
nur vergleichweise ungenau bestimmt werden.
- Ein DTA-Gerät (Abb. 2.3.2. unten rechts) besteht aus zwei Tiegeln, der Probe (P)
und der Referenz (R), die
synchron aufgeheizt und abgekühlt werden.
Die Referenzprobe darf im untersuchten Temperaturbereich
keinerlei Effekte zeigen und sollte möglichst die gleiche
Wärmekapazität haben wie die Probensubstanz.
Wie bei der TA werden Probe und Referenz mit
konstantem Gradienten aufgeheizt.
Bei endothermern Effekt hat die Referenz eine höhere Temperatur,
in der Kurve ΔT = TP - TR gegen T ergibt sich
ein Peak Richtung 'endo'.
Zur Auswertung wird meist der sog. Onset verwendet,
obwohl der Peakbeginn, der aber meist nur ungenau bestimmt werden kann,
die wirkliche Umwandlungstemperatur beschreibt.
Da die Wärmemenge i.A. nicht bestimmt wird, muss die
verwendete Probenmenge nicht exakt ermittelt werden.
Die Umwandlungswärme ist bei bekannter Probenmenge
aus der Peakfläche abschätzbar.
Kommerzielle Geräte im Temperaturbereich von -150 bis 2000 oC
sind verfügbar, ebenso verschiedene Tiegel, auch aus
verschiedenen Materialien.
Sehr wichtig bei der DTA ist der absolut symmetrische Aufbau
des Ofens, da Probe und Referenz exakt gleich aufgeheizt werden
müssen.
- Der Aufbau einer DSC (Abb. 2.3.3. oben rechts) ist dem der DTA sehr ähnlich.
Hier erfolgt jedoch eine genaue Bestimmung der Wärmemengen.
Dazu sind Proben- und Referenz-Tiegel heizbar.
Während der Messung werden Referenz bzw. Probe
so geheizt, dass ΔT immer gleich 0 ist. Dazu ist
eine genaue Einwaage wichtig.
Abbildung 2.3.3. zeigt die Bestimmung von Phasendiagrammen
mittels DTA für die vier typischen Formen von Phasendiagrammen:
- einfach eutektisch
- mit Verbindungsbildung
- mit inkongruent schmelzende Verbindung
- mit vollst¨ndiger Löslichkeit

|
| Abb. 2.3.3. DTA und Phasendiagramme
‣ SVG
|
2.3.2. Thermogravimetrie
Als Erweiterung unter 2.3.1. beschriebenen Methoden wird
oft eine Kopplung der DTA mit der Thermogravimetrie (DTA/TG, Abb. 2.3.3. oben links)
verwendet. Dann läßt sich zusützlich zu den Umwandlungstemperaturen
auch der Masseverlust Δm als Funktion der Temperatur
bestimmen. Hierbei werde einige mg Probe mit Raten von
1 bis 20 K/min auf einer sehr empfindlichen Waage aufgeheizen.
Der Masseverlust Δm: ist bei Kenntnis der Gesamtmasse
der Probe bestimmbar und auswertbar.
Bei allen thermoanalytischen Methoden ist zu beachten, dass die
Anfangs- und die Endtemperatur der Umwandlung
von der Heizrate, der Partikelgröße und der
Atmosphäre über der Probe abhängen.
Beispielsweise erfolgt der CO2-Verlustschritt
bei CaCO3 im Vakuum bei 500oC,
in Luft bei 650oC und in
CO2-Atmosphäre: über 900 oC.
Als weiteres Beispiel sind die DTA- und TG/DTG-Kurven von
Calciumoxalat-Hydrat CaC2O2.H2O
in Abbildung 2.3.4. angegeben.
dta_tg_tex.eps



