|
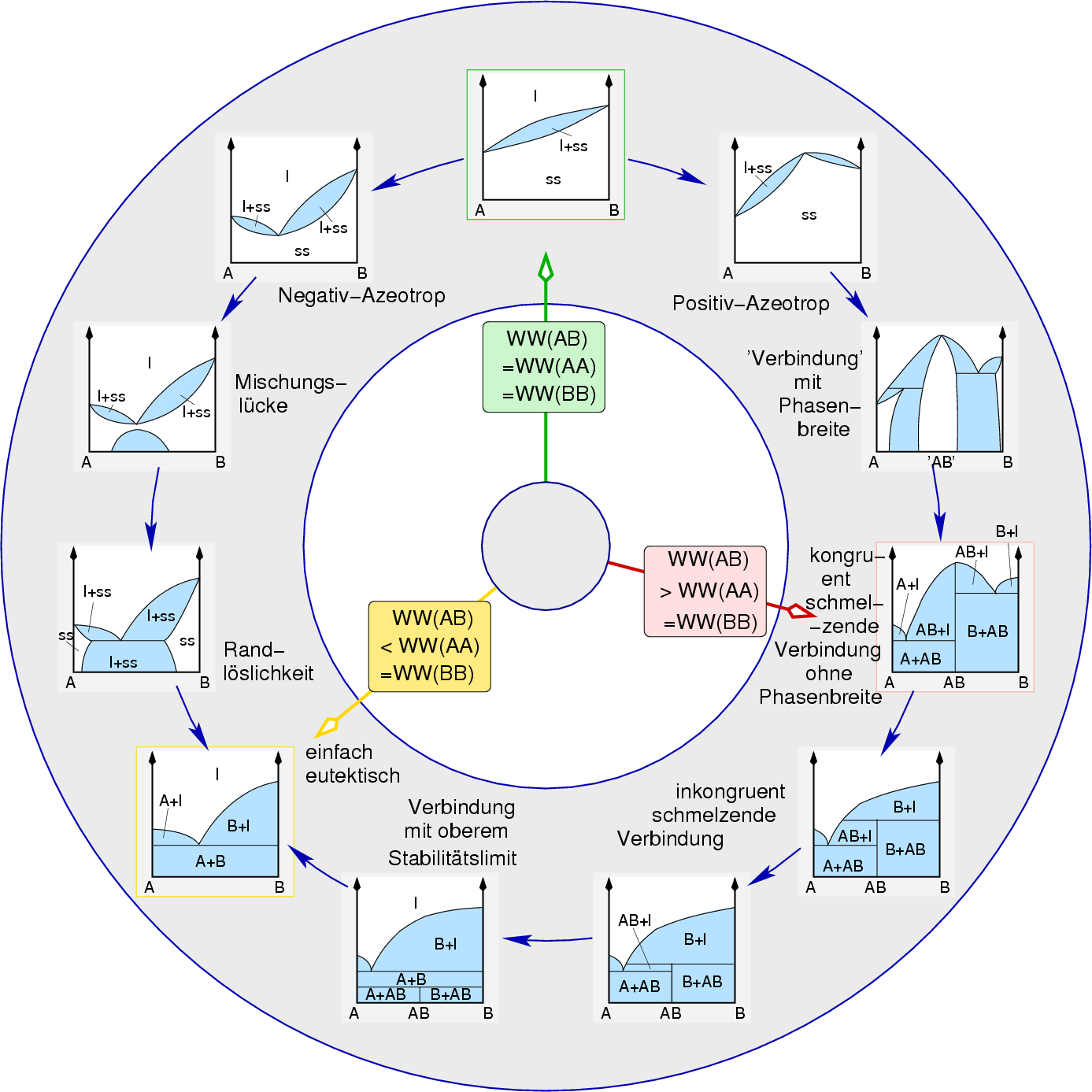
| Abb. 2.1.1. Phasendiagramme zweikomponentiger Systeme ‣ SVG und Erklärung, aus dem Sn-Vortrag der AC-III-Vorlesung |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
Vorlagen und Präsentationen

|
| Abb. 2.1.1. Phasendiagramme zweikomponentiger Systeme ‣ SVG und Erklärung, aus dem Sn-Vortrag der AC-III-Vorlesung |
| ← | Inhalt | 1. Bau + Strukturen | 2. Reaktionen + Synthesen | 3. Eigenschaften + Anwendungen | → |
| cr_home | Metalle | Nichtmetalle | Strukturchemie | Methoden | Interm. Phasen | Oxide | Silicate | Strukturtypen |