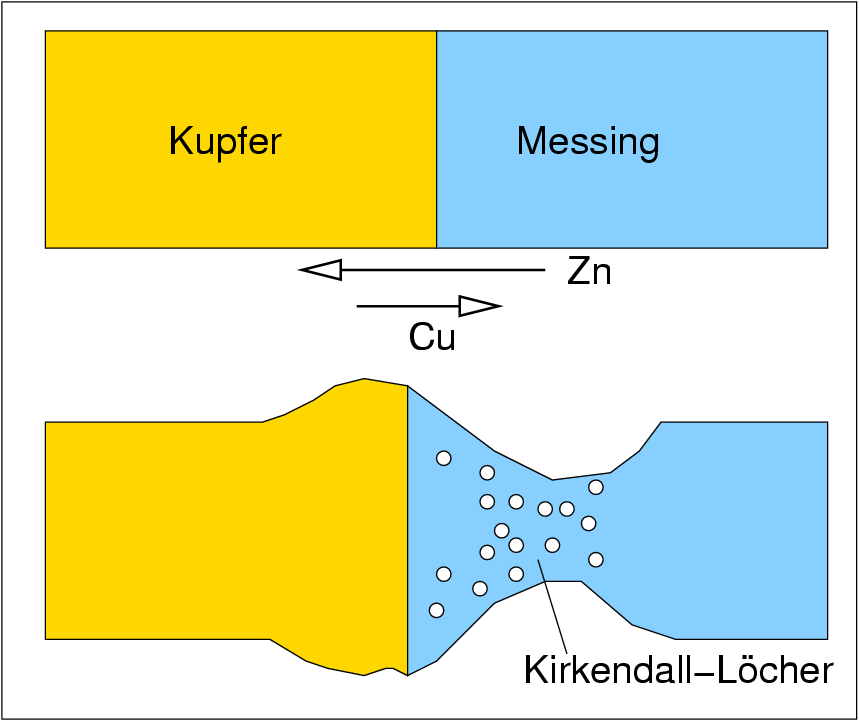
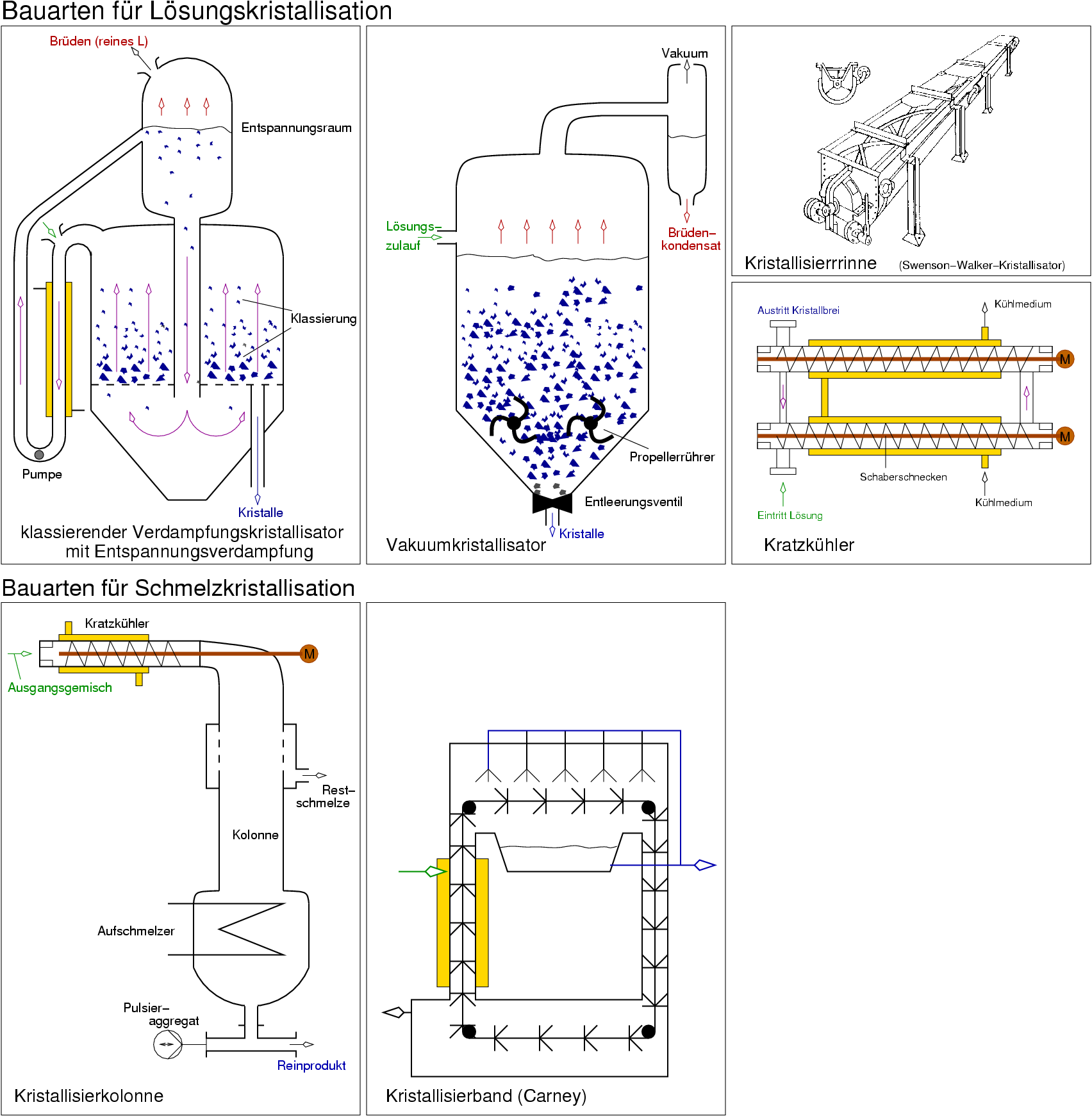
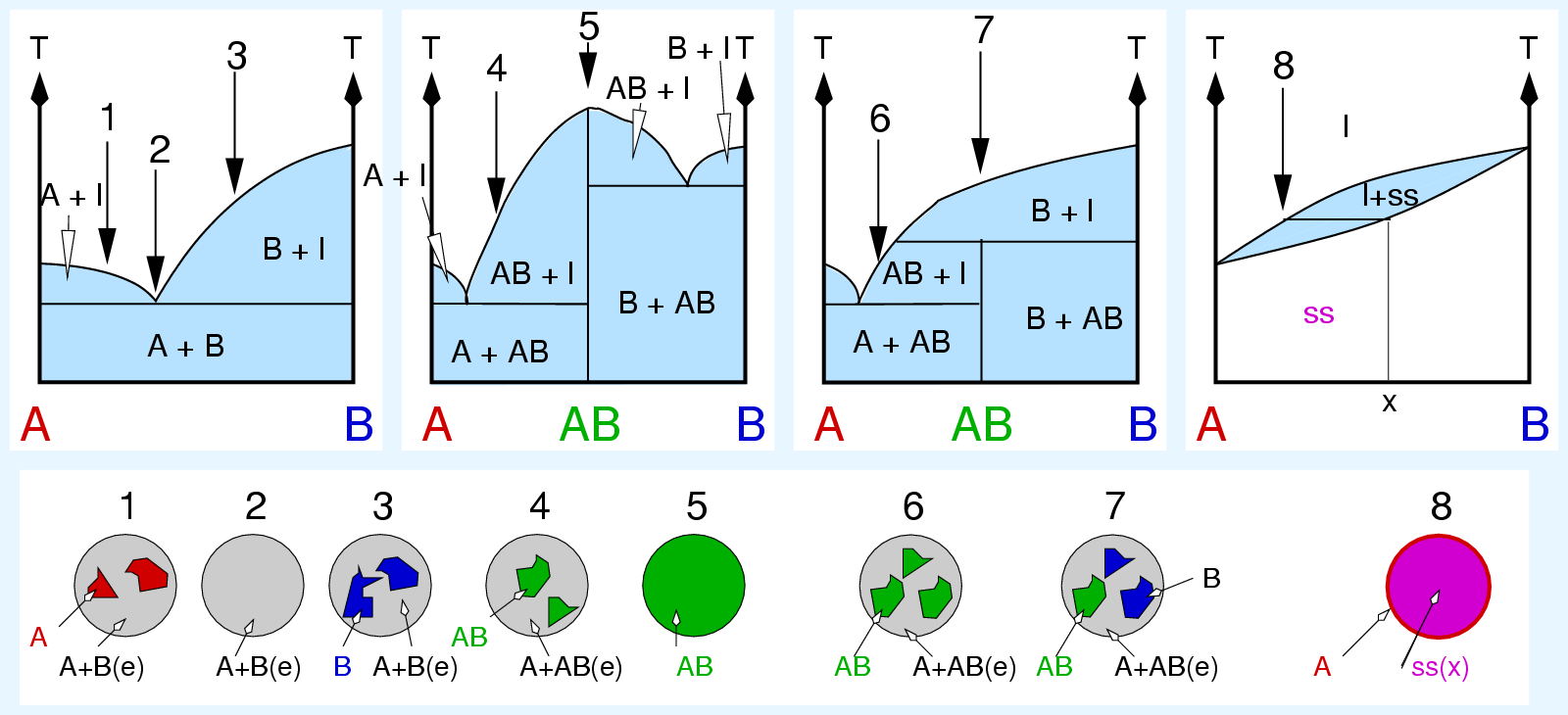
| L ⟶ S |
Gefrieren, Erstarren |
H2O (l) ⟶ H2O (s) (bei T = 0o) |
| V ⟶ S |
Resublimation |
I2 (g) ⟶ I2 (s) |
| S1 ⟶ S2 |
Phasenumwandlung |
α-Sn ⟶ β-Sn (T = 13.2 oC; Zinnpest) |
| Rekristallisation |
Entglasung bei Quarzampullen, Samorph ⟶ Skristallin |
| S1 + S2 ⟶ S3 |
Festkörperreaktion |
MgO + Al2O3 ⟶ 1500oC ⟶ MgAl2O4 |
| S1 ⟶ S2 + Σ Vi |
Zersetzungsreaktion |
CaCO3 ⟶ 908oCoC ⟶ CaO + CO2 |
| S1 + Σ Vi ⟶ S2 |
Bildungsreaktion |
CaO + CO2 ⟶ 908 oC ⟶ CaCO3 |
| 2 Cu + O2 ⟶ 1000 oC ⟶ 2 CuO (z.B. Passivierung) |
| S1 + Σ Vi ⟶ S2 + Σ Vj |
Austauschreaktion |
MnO2 + CO ⟶1000oC⟶ MnO + CO2 |
| S1 + S2 ⟶ S3 + Σ Vi |
Festkörperreaktion |
Fe2((COO)2)3 + Zn(COO)2 ⟶1000oC⟶
ZnFe2O4 + CO + 4 CO2 Oxalate, niedrigere T als direkt |
| ΣVi ⟶ S |
Abscheidung (CVD) |
HCl + NH3 ⟶ NH4Cl (Labornebel) |
| ΣVi ⟶ ΣVj + S |
Chemischer Transport |
CrI2 ⟶ Cr + I2(g); Reinigung von Metallen (van Arkel) |
| S1 ⟶ S2 + Σ Li |
Zersetzung |
mit L ähnliche Rkt. wie mit V |
| S1 + Σ Li ⟶ S2 |
Bildung |
2 Hg(l) + K(s) ⟶ KHg2 |
| S1 + L1 ⟶ S2 + L2 |
Austauschreaktion |
|
| ΣLi ⟶ S |
|
Molekülchemie, Interhalogene |
| Σ Li + Σ Vi ⟶ S |
|
8 Cl2 + 46 H2O ⟶0 oC⟶ 8Cl2. 46H2O |
| S1(l) ⟶ S1 |
Lösungskristallisation |
Umkristallisieren von Molekülkristallen |
| S1(l) + S2(l) ⟶ S3 |
Lösungskristallisation |
NaAl(OH)4(aq) + Na2SiO3(aq) + NaOH(aq)
⟶ l200oC⟶ Nax(AlO2)x
(SiO2)y . z H2O (div. Zeolithe) |