Vorlesung Intermetallische Phasen
2. Elementare Metalle, metallischer Zustand
2.3 Strukturchemie I: Einfache Strukturtypen (Cu-, Mg-, W-Typ)
Die echten Metalle kristallisieren fast alle in nur drei verschiedenen Strukturtypen.
Zunächst soll an dieser Stelle eine kurze Wiederholung der
Strukturchemie der drei einfachen Metallpackungen gegeben werden:
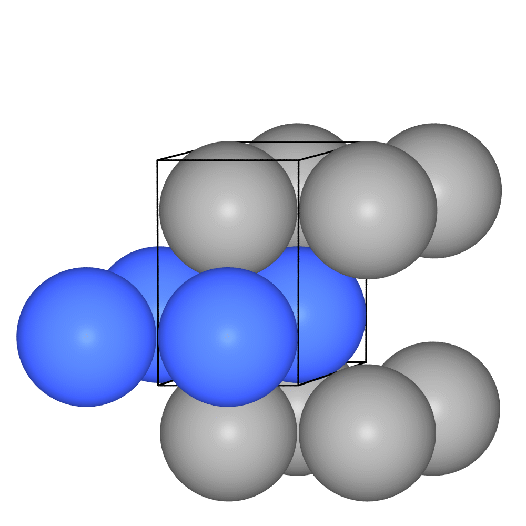
- b.c.c. oder kubisch innenzentriert oder W-Typ:
Basis der kubisch innenzentrieten Metallpackung sind quadratische Schichten,
die in der Folge A-B-A gestapelt sind.
Die Kugeln berühren sich innerhalb der Schichten nicht, die Kontakte der Kugeln
verlaufen vielmehr auf den Würfeldiagonalen.
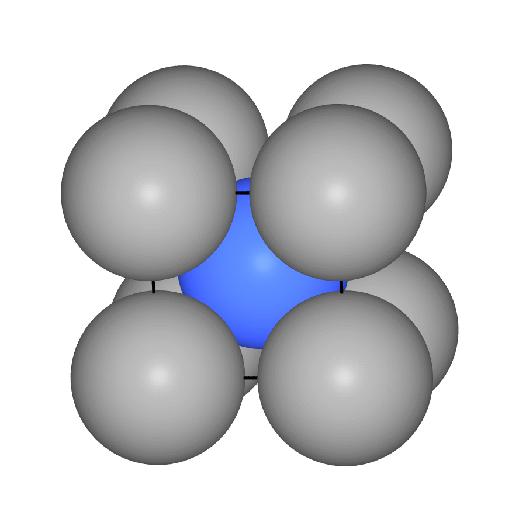
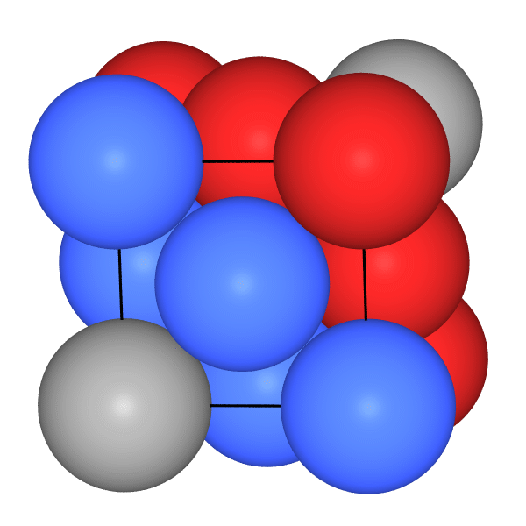
Das Koordinationspolyeder um die Atome ist ein Würfel (CN 8, Atomabstand
0.866*Gitterkonstante a) und in etwas weiterer Entfernung (Atomabstand 1*a) ein weiteres
Oktaeder, so daß insgesamt die Koordinationszahl 8+6 folgt. Die Raumerfüllung
einer solchen Anordnung von Kugeln beträgt 68.02 %.
Die folgenden VRMLs zeigen einen Ausschnitt
aus der Gesamtstruktur, ein zusammengesetztes
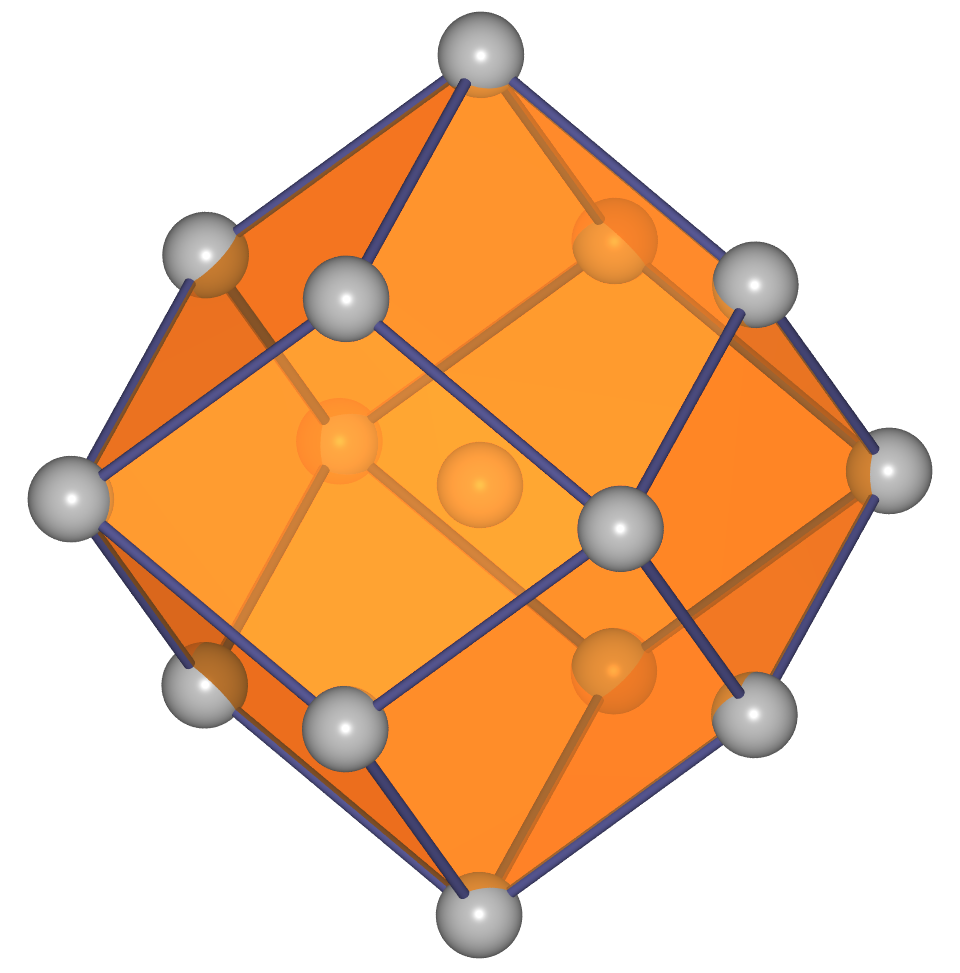
Koordinationspolyeder (CN: 8 (Würfel, rot) + 6 (Oktaeder, grau) in
der Darstellung mit Kugeln
bzw. in der Polyederdarstellung
und ein VRML2 des Übergangs von der
Kugel- zur Polyederdarstellung.
- Die beiden die nächsten Metallstrukturen, die hexagonal und die
kubisch dichte Packungen, sind echte dichteste Kugelpackungen
im Raum. (Der Beweis hiervon gelang den Mathematikern erst kürzlich!),
d.h. es handelt sich um diejenigen Anordnungen identischer Kugeln mit der
maximalen Dichte und der maximalen Raumerfüllung von 74.05 %.
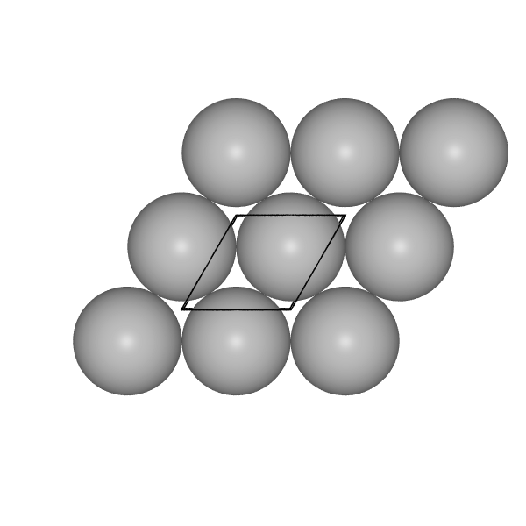
Basis der beiden Strukturen (und vieler Varianten) ist die
Packung von Kugeln in einer dichten Schicht in der Ebene.
Diese Schichten sind im Prinzip in beliebigiber Stapelfolgen denkbar.
Am wichtigsten sind:
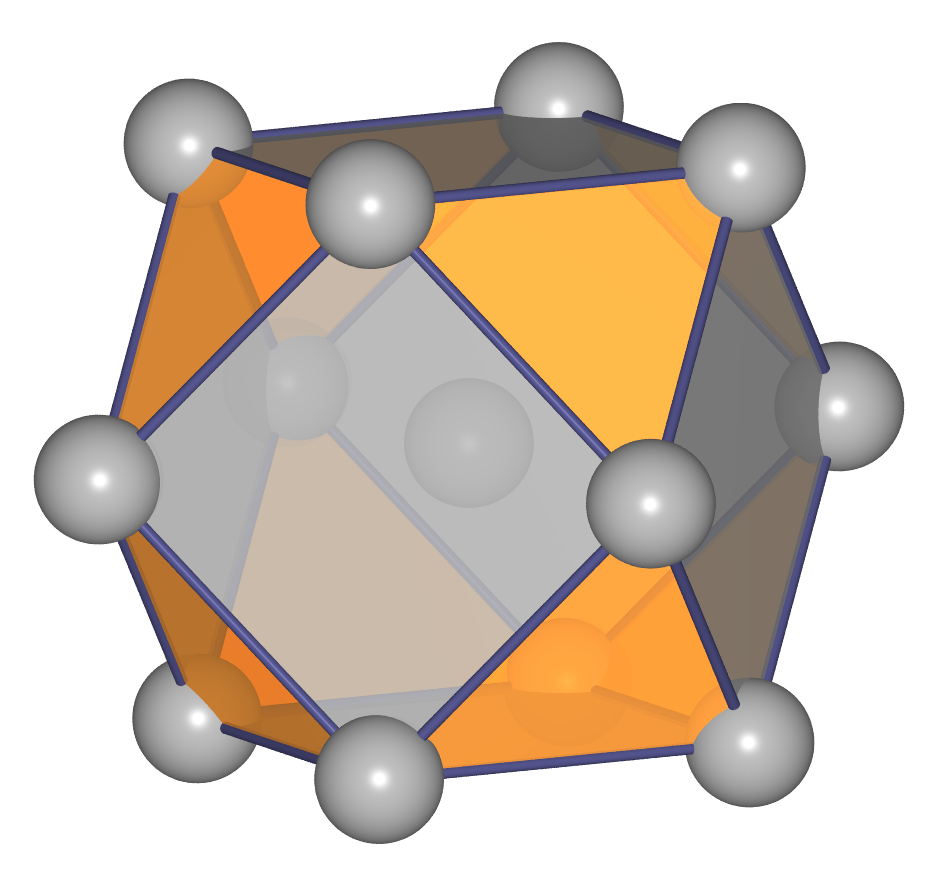
- f.c.c. oder kubisch flächenzentriert
oder kubisch dichteste Kugelpackung oder Cu-Typ:
Die Stapelfolge der Schichten ist |:A-B-C-:|. Die dichtesten Schichten
verlaufen senkrecht zu allen Raumdiagonalen. Als Koordinationspolyeder
ergibt sich ein Kuboktaeder (CN 12). Hierzu einige Bilderserien:
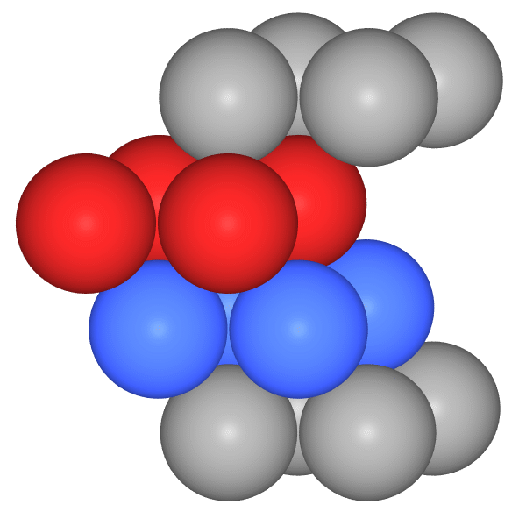
- Aufbau der Gesamtpackung:
In Abbildung 1 eine
dichteste Kugelschicht in der Ebene (rot) und die ersten Atome der folgenden
Schicht B (gelb). In 2
kommt die 3. Schicht (C, in blau), die (senkrecht zur Schichtebene)
weder genau über A noch genau über B liegt.
Die vierte Schicht (eine Kugel und
komplette Schicht)
ist wieder identisch mit der ersten (A-B-C-A-Stapelung).
Diese Stapelfolge liegt senkrecht zu allen Raumdiagonalen der Zelle vor
( hier zum Probieren).
- Ausschnitte aus der Gesamtstruktur und das Koordinationspolyeder:
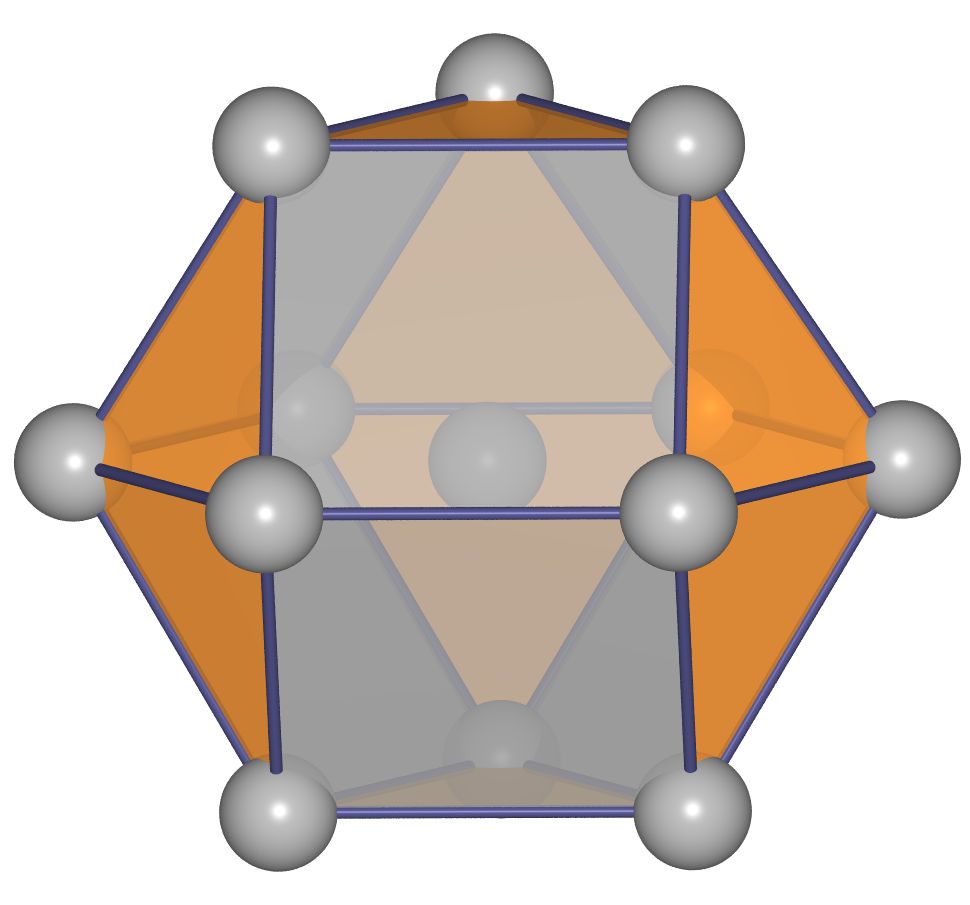
- h.c.p. oder hexagonal dichteste Kugelpackung oder Mg-Typ:
Hier sind die dichten Schichten in der Stapelfolge |:A-B-:| angeordnet, das
Koordinationspolyeder (CN 12) ist ein Antikuboktaeder. Auch hierzu eine Bilderserie:
Die folgenden Tabelle 2.3.1 enthält neben den Angaben zu den Kristallstrukturen
auch Informationen über die elektronischen Strukturen:
Tab. 2.3.1. Strukturen und elektronische Strukturen einfacher Metalle
↪
VL 2.4.
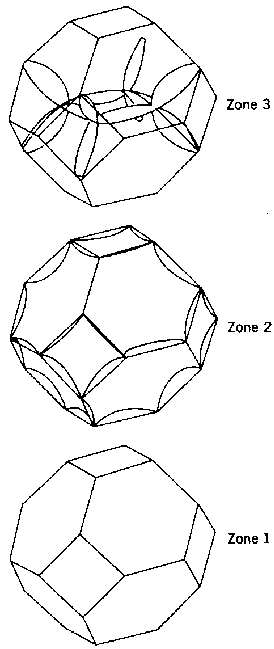 Für die elektronischen Strukturen der drei Metallpackungen sind in
obiger Tabelle zu den drei Strukturtypen jeweils die Brillouin-Zonen
(Konstruktion siehe 2-dim. Fall) und in der asymmetrischen Einheit des
k-Raums die speziellen Punkte angegeben.
Für die elektronischen Strukturen der drei Metallpackungen sind in
obiger Tabelle zu den drei Strukturtypen jeweils die Brillouin-Zonen
(Konstruktion siehe 2-dim. Fall) und in der asymmetrischen Einheit des
k-Raums die speziellen Punkte angegeben.
Bei einfachen 'echten' Metallen (A1, A2 und z.T. auch B1)
zeigen die Valenzelektronen die Charakteristika freier Elektronen, d.h. die
Fermifläche ist eine Kugel bzw. es liegen nur geringe Abweichungen von freiem
Verlauf (gestrichelt) vor. Als Beispiel ist
die Bandstruktur von Al angegeben (EF = 0.9 Rydberg = 12 eV).
Wichtig für alle physikalischen Eigenschaften ist vor allem die
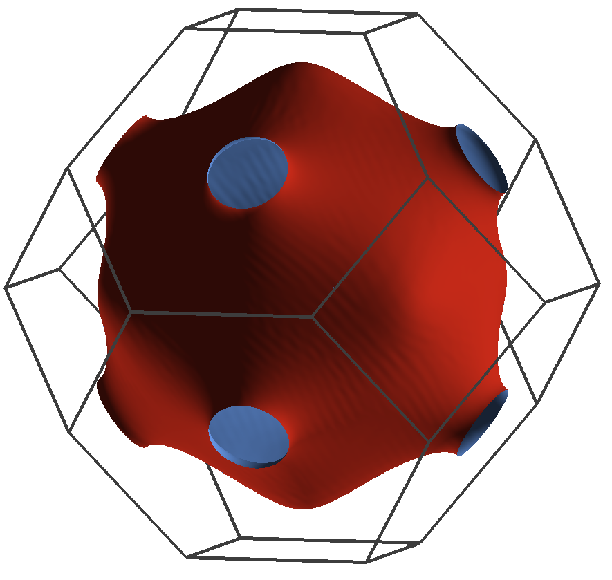
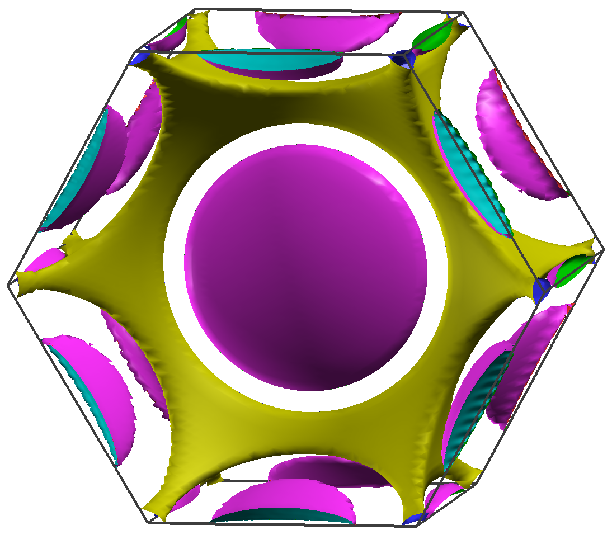
Form der Fermifläche. Diese ist oben als Projektion für f.c.c.-Strukturen
am Beispiel von Cu (1 Valenzelektron, links) bzw. Al (3 Valenzelektronen, rechts)
gezeigt.
im Einzelnen:
- Cu: Die Fermifläche liegt hier komplett in der 1. BZ.
und ist damit fast kugelförmig. Bei L dingt die Fermifläche schwach in die 2. BZ ein.
- Al: Da Aluminium drei Valenzelektronen besitzt, ist die
Fermikugel entsprechend größer und reicht bis in die 3.
Brillouin-Zone. Die Fermiflächen in den einzelnen Brillouin-Zonen sind
entsprechend komplex:
- Die 1. BZ ist vollständig besetzt.
- In der 2. BZ sind nur die blau markierten Bereiche 2 ('Einbuchtungen' in die 1.BZ) besetzt.
- In der 3. BZ sind nur schmale Zigarren besetzt.
In der unteren Tabellenspalte sind die totalen Zustandsdichten
für die drei Metallstrukturtypen für ausgewählte Elemente
gezeigt:
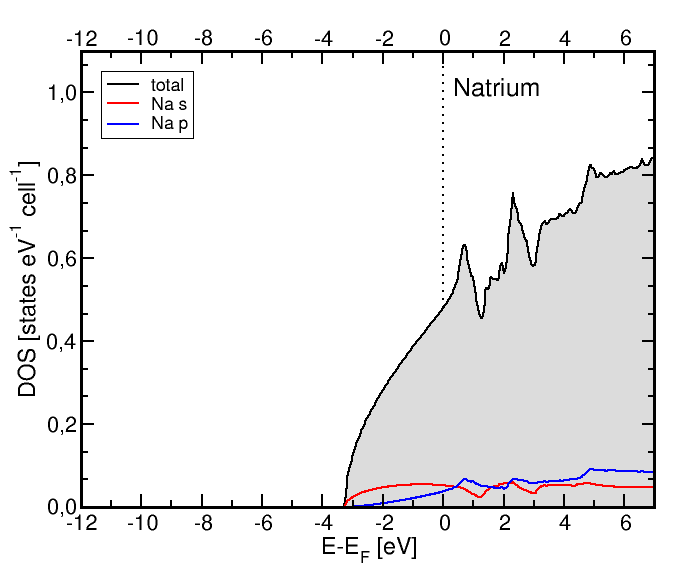
- Links die DOS von Na (bcc): Die Fermifläche ist eine Kugel, die
DOS ist die Parabel der freien Elektronen.
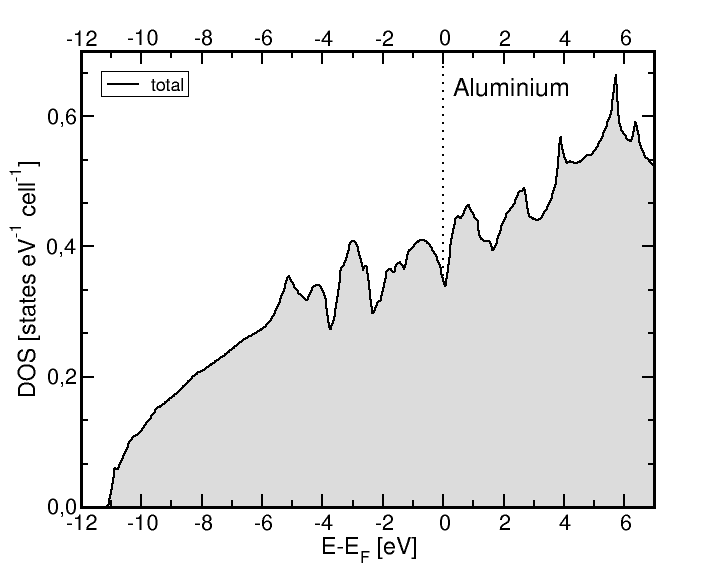
- Mitte: Die DOS von Al (fcc) ist unterhalb der Fermikante kompliziert,
insgesamt aber recht nahe am Fall freier Elektronen.
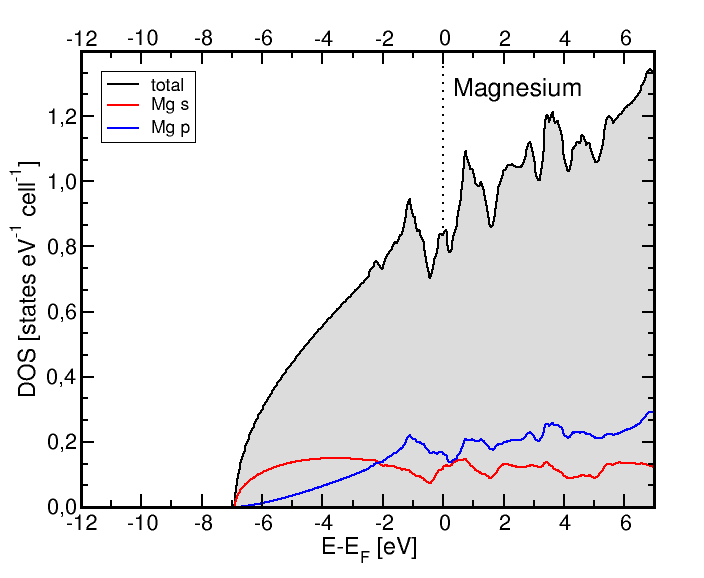
- Rechts: die DOS von Mg (hcp).
Aus den Zustandsdichten ist zu erkennen, dass die minimalen Bragg-Reflexion
an den Kanten der Brillouin-Zonen strukturbestimmend sind.
Allgemein ist eine jeweils voll besetzte Brillouin-Zone immer energetisch
günstig.
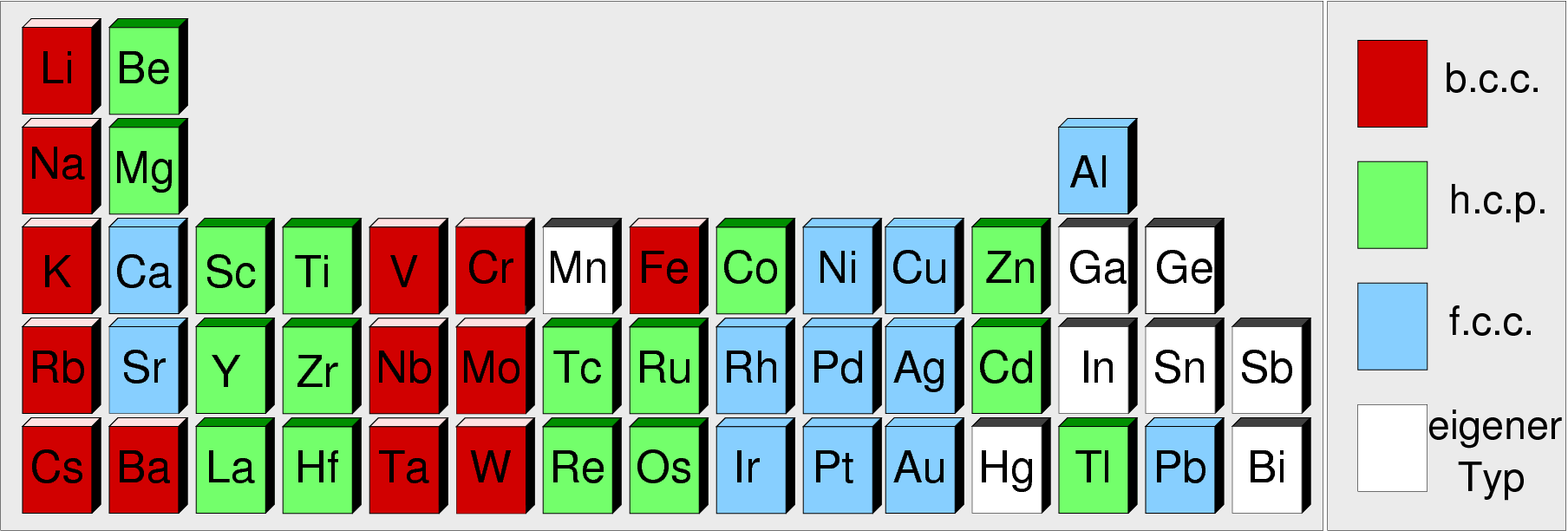
Die Verteilung der Strukturtypen im Periodensystem ist der folgenden Übersicht
(Abb. 2.3.1.) zu entnehmen:
Aus dem Vergleich der berechneten Energien für die unterschiedlichen Strukturtypen
- in Abbildung 2.3.2. relativ zur f.c.c.-Struktur (rote Linie) aufgetragen - ergibt sich die
im Periodensystem grob beobachtete Phasenfolge:
b.c.c. (Na) ⟶ f.c.c. (Ca) ⟶ h.c.p. (Sc, Ti) ⟶ bcc (V, Cr) ⟶ f.c.c. (Ni, Cu)
Ausnahmen von dieser Folge finden sich bei den magnetischen Elementen Fe und Co, die im
b.c.c.-Typ kristallisieren.
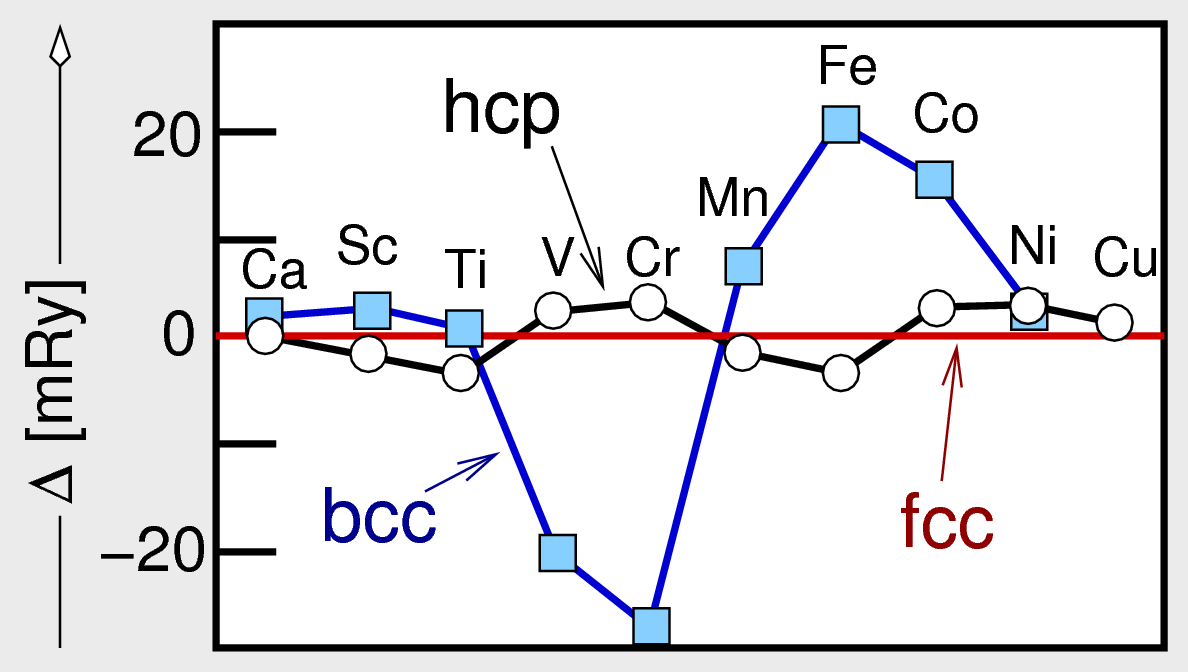 |
| Abb. 2.3.2. Energien der Metalle in den drei Metallpackungen
‣SVG
|
Der Strukturtyp eines Metalls bestimmt auch entscheidend die mechanischen Eigenschaften
der Metalle: Metalle und Legierungen mit kubisch dichtester Kugelpackung (f.c.c.) haben die meisten
sog. 'Gleitsysteme', d.h. die Verscheibung der Schichten gegeneinander ist in vielen
Richtungen relativ einfach möglich. Diese Metalle sind daher duktil und damit
mechanisch einfach zu verarbeiten (z.B. Cu).
Weitere Betrachtung zu elektronischen Strukturen
werden bei der Besprechung der Elementhalbleiter
und für einige ausgewählte intermetallische Phasen
angeschlossen.
An dieser Stelle aber zuerst zu einfachen Varianten dieser drei
Metallstrukturtypen.



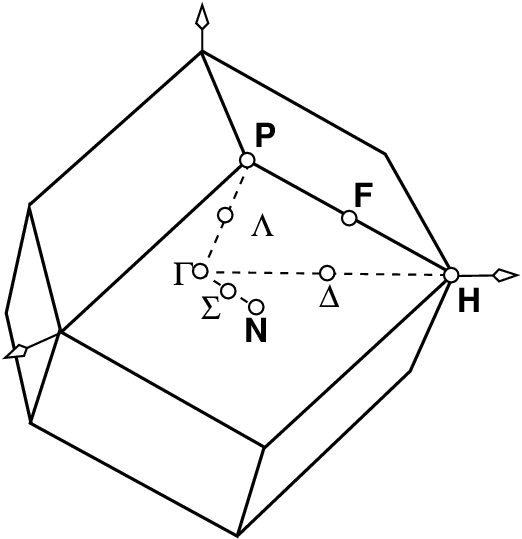


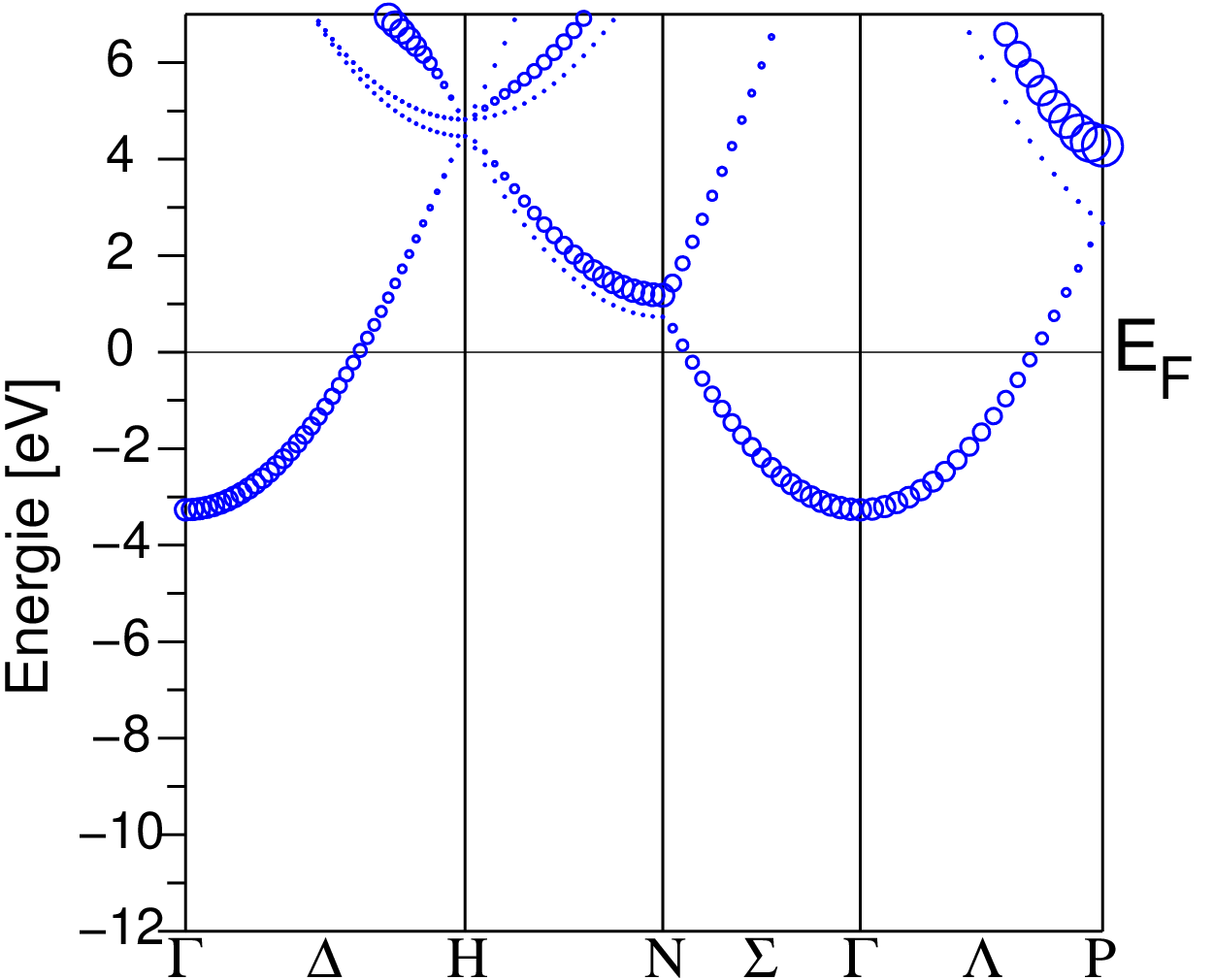

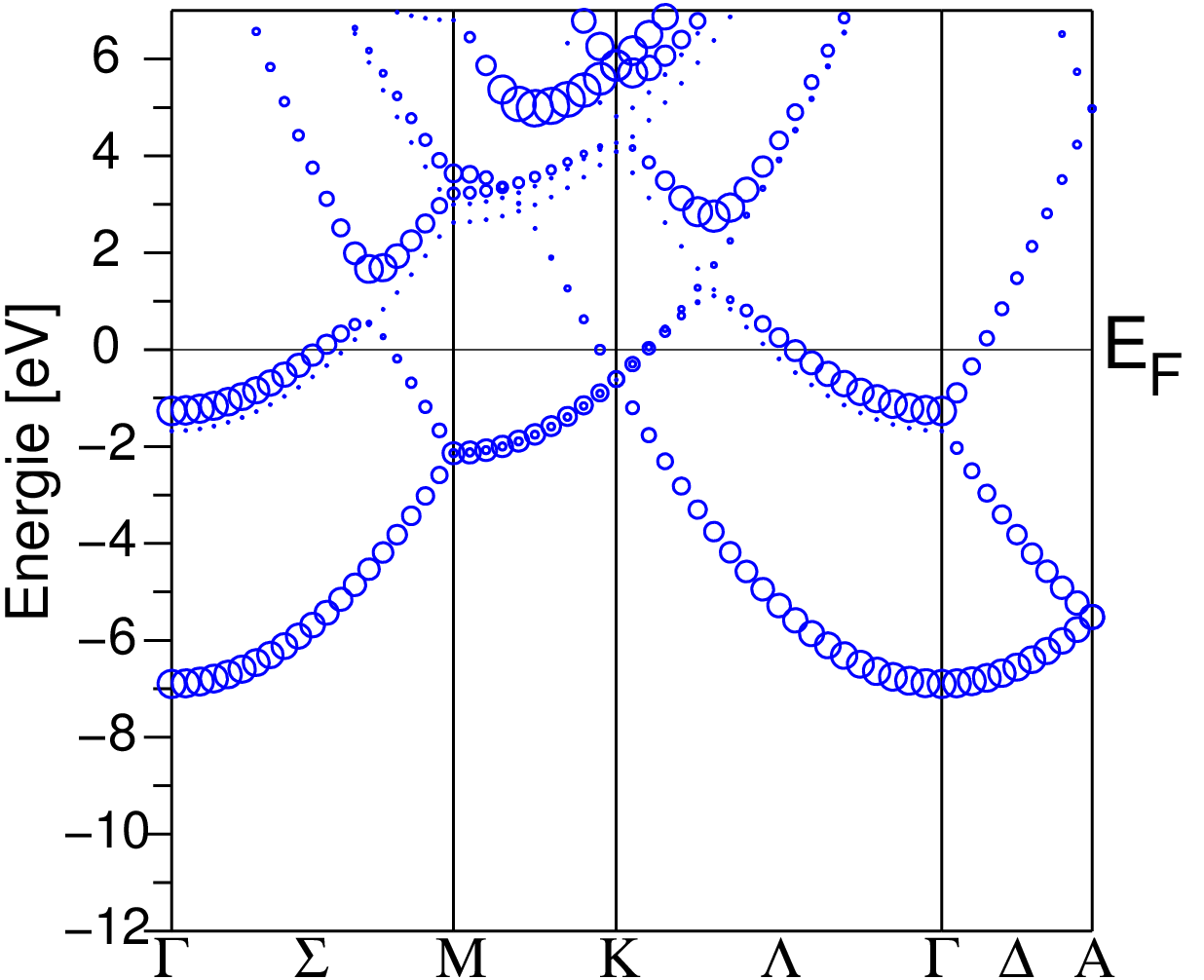
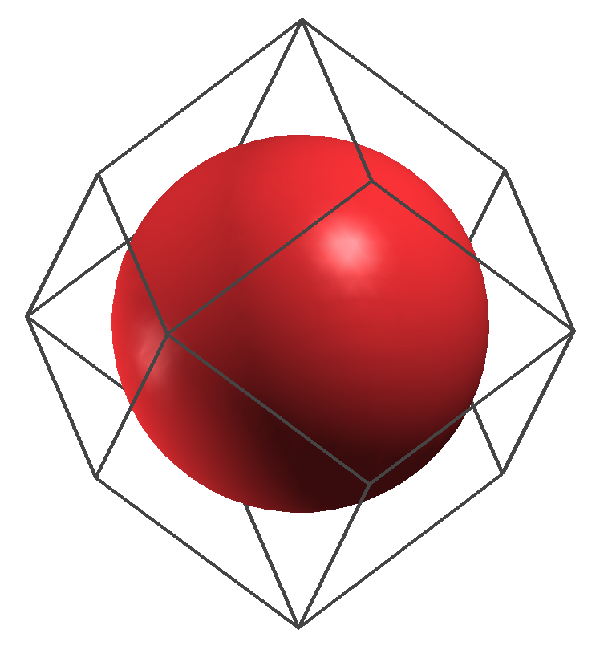
























 Für die elektronischen Strukturen der drei Metallpackungen sind in
obiger Tabelle zu den drei Strukturtypen jeweils die Brillouin-Zonen
(Konstruktion siehe 2-dim. Fall) und in der asymmetrischen Einheit des
k-Raums die speziellen Punkte angegeben.
Für die elektronischen Strukturen der drei Metallpackungen sind in
obiger Tabelle zu den drei Strukturtypen jeweils die Brillouin-Zonen
(Konstruktion siehe 2-dim. Fall) und in der asymmetrischen Einheit des
k-Raums die speziellen Punkte angegeben.