Vorlesung Chemie der Metalle
5.Tetrele (4. Hauptgruppe, Kohlenstoff-Gruppe: Si, Ge, Sn, Pb)
5.2. Elementare Metalle
Vorkommen und Entdeckung der Elemente
Silicium kommt ausschließlich in Form von Oxiden, Germanium, Zinn und Blei dagegen überwiegend in Sulfiden vor.
Die wichtigsten Minerale sind:
- Silicium kommt in einer extrem großen Zahl verschiedener Silicate vor.
Besonders häufig sind Alkali- bzw. Erdalkalimetall-Silicate und -Aluminiumsilicate.
Auch als reines SiO2 (Quarz-Modifikation) kommt Silicium in der Natur vor.
Silicium ist nach Sauerstoff (45.5 %) mit 27.2 % das zweithäufigstes Element der Erdkruste.
- Germanium kommt wie das Nachbarelement Gallium in der Natur nur
sehr weit verteilt vor.
Es wurde daher auch erst 1886 von dem Deutschen C. A. Winkler entdeckt.
Seine Eigenschaften (als Eka-Silicium) konnten von Mendelejew bereits aus der Stellung im Periodensystem
sehr genau vorausgesagt werden.
Typische Minerale sind z.B. Thiogermanate wie Germanit Cu6FeFe2S8 (ein Cu-Fe-Sulfid).
- Zinn ist ein bereits sehr lange bekanntes Metall,
weil es leicht (z.B. mit Kohlenstoff) reduziert werden kann.
Seit 3000 v.Chr. kennt man die Legierung Bronze, eine Legierung aus Kupfer mit 10-15% Sn.
Als Zinnstein (s. Abb. 5.2.1) oder Kassiterit bezeichnet man das Dioxid SnO2.
 |
| Abb. 5.2.1. Zinnstein |
- Blei
ist ein ebenfalls sehr lange bekanntes Metall und wurde 6000 v.Chr. bereits als Glasur eingesetzt.
Später fertigten Römer Wasserrohre u.ä. aus dem Element. Es kommt in der Natur
entweder gediegen oder als Sulfid (PbS: Bleiglanz), Carbonat oder Chromat vor.
Fotos der Elemente
 |
 |
 |
| Abb. 5.2.2. Silicium |
Abb. 5.2.3. Germanium |
Abb. 5.2.4. Zinn |
 |
| Abb. 5.2.5. Blei |
Strukturen
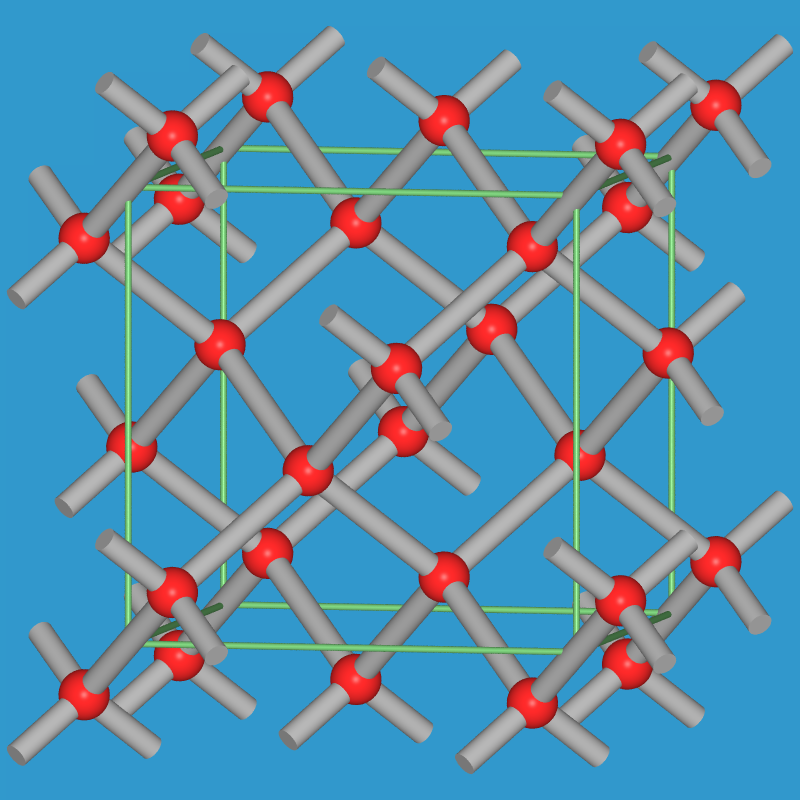
Silicium, Germanium und die α-Form von Zinn kristallisieren in der
kubischen Diamant-Struktur (dSi-Si 234 pm, Abb. 5.2.6.).
Zinn ist dimorph und kristallisiert in zwei allotropen Formen:
α-Sn (graue Form, Diamant-Struktur) geht bei einer Temperatur von 13.2 oC in die
β-Form (metallische Form) über.
Dabei wird ausgehende von der Diamantstruktur mit der Koordinationszahl 4
die Koordination auf sechs erweitert, so daß eine tetragonale, metallische
Struktur mit einer um 26 % höheren Dichte entsteht (Abb. 5.2.7.).
Die Phasenumwandlung führt umgekehrt zur unerwünschten Bildung von grauem Sn (α-Form)
aus dem metallischen Zinn (sog. Zinnpest).
 |
 |
| Abb. 5.2.6. Diamant-Struktur
‣VRML |
Abb. 5.2.7. Struktur von β-Zinn
‣VRML |
Blei ist ein typisches Metall und kristallisiert in der kubisch flächenzentrierten Packung
(f.c.c., Cu-Typ)
Physikalische Eigenschaften
Silicium und Germanium sind elektrisch leitfähige Halbleiter (Eigenhalbleiter),
d.h. Störstellen- (Löcher) und Elektronen-Wanderung bewirken die Leitfähigkeit.
Die Leitfähigkeit steigt - wie bei allen Halbleitern - mit der Temperatur.
β-Zinn und Blei zeigen metallische Leitfähigkeit.
Die Schmelzpunkte der Elemente fallen von Si (1420oC) zum Blei (327 oC)
haben jedoch, wie die Elemente der 3. Hauptruppe, ein Minimum in der 5. Periode
(hier bei Zinn mit 232 oC).
Blei ist mit einer Dichte von 11.3 g/cm3 ein typisches Schwermetall.
Blei ist giftig und wird auch durch die Haut resorbiert. Silicium, Germanium und Zinn
sind dagegen ungiftig.
Chemische Eigenschaften
Die leichten Elemente der IV. Hauptgruppe bilden mit elektronegativen Partnern
meist typische kovalente Verbindungen mit der Oxidationsstufe +4 wie z.B. SiCl4.
Mit den schwereren Elementen entstehen salzartige Verbindungen mit zweiwertigen Metallionen
wie z.B. PbCl2.
Mit elektropositiven Partnern werden Silicide (z.B. CaSi2), Germanide oder
Plumbide gebildet.
Die Elemente bilden untereinander -
mit der technisch wichtigen Ausnahme von SiC (Karborundum, Härte 9.5, Verwendung als
Hochtemperatur-Halbleiter) - keine Verbindungen.
- Elementares Silicium ist wegen der Bildung einer SiO2-Schutzschicht
in Säure unlöslich, in Laugen dagegen gemäß
Si + 4 OH- ⟶ SiO44- + 2 H2
unter Wasserstoffentwicklung gut löslich.
- Germanium ist als GeII relativ unbeständig,
stabil dagegen ist GeIV.
- Die beiden Modifikationen von Zinn
unterscheiden sich an in ihrer Reaktivität. In nichtoxidierenden Säuren
löst sich α-Zinn unter Bildung von Sn(IV), β-Sn dagegen unter Bildung
von Sn(II). Oxidierende Säuren bewirken die Oxidation zu unlöslichem Zinnstein:
Sn + 2 HNO3 (konz.) ⟶ SnIVO2 + NO + NO2 + H2O
SnII wirkt reduzierend.
- Blei kommt überwiegend als PbII in Verbindungen vor.
Das Element bildet an feuchter Luft Pb(OH)2.
Mit Wasser und Kohlendioxid entsteht auf der Oberfläche eine Schutzschicht aus PbCO3.
Mit verdünnter Schwefelsäure bildet sich entsprechend schwerlösliches PbSO4
beständig gegen konz. H2SO4).
HNO3 löst Blei zu Pb(NO3)2 (d.h. Oxidation).
Unter dem sogenannten 'Bleibaum' versteht man die Abscheidung von Blei auf Zink:
Zn + Pb2+ ⟶ Zn2+ + Pb
Darstellung der Elemente
- Silicium (s. Kap. 7.1. der Vorlesung
Chemie der Nichtmetalle).
- Die Herstellung und Kristallzüchtung von Germanium
ist der von Silicium sehr ähnlich.
Zunächst wird Germanit Cu6FeFe2S8 oder der Germanium-haltige Flugstaub von Zn-Schmelzöfen
in Säuren gelöst und als GeO2 gefällt.
Die Reduktion des Oxides erfolgt bei 530 oC mit Wasserstoff oder Kohlenstoff
als Reduktionsmittel. Zonenschmelzen und Czochralski-Züchtung können wie bei
Silicium angeschlossen werden. Heute werden ca. 100 000 t/a (etwas fallende Tendenz)
hergestellt.
- Zur Gewinnung von Zinn wird aus dem natürlich vorkommenden
Kassiterit (SnO2) zunächst durch Rösten Arsen und Schwefel entfernen.
Anschließend kann das Metall zur Reduktion mit Kohlenstoff bei 1200 oC in einem
Flammofen gewonnen werden.
- Elementares Blei kann nach zwei verschiedenen Verfahren hergestellt
werden, wobei beiden eine Schaumflotation zur Anreicherung von PbS vorausgeht:
- Röstreduktionsverfahren:
PbS + 3/2 O2 ⟶ PbO + SO2
PbO + CO ⟶ Pb + CO2
- Röstreaktionsverfahren:
3 PbS + 3 O2 ⟶ PbS + 2 PbO + 2 SO2
PbS + 2 PbO ⟶ 3 Pb + SO2
Verwendung
- Germanium findet wie Silicium als Halbleitermaterial Verwendung. Der Verbrauch ist allerdings
stark fallend, da heute überwiegend Silicium für diese Zwecke eingesetzt wird.
- Zinn wurde als sog. echtes Stanniol in Folien als Verpackungsmaterial verwendet.
Als Weißblech bezeichnet man Eisen, das mit einem ca 1 μm dicken Sn-Überzug
versehen ist. Bronzen sind Cu/Sn-Legierungen. Für Weichlote werden
Sn/Pb-Legierungen eingesetzt.
- Die Hauptverwendung von Blei ist in Pb-Akkus. Darüberhinaus
werden Blei-haltige Bleche, Folien und Lötmetalle verwendet.
Der Pb-Anteil in Pigmenten (z.B. PbCrO4) ist wegen der Toxizität stark fallend.
Im den folgenden Kapiteln werden die wichtigsten Verbindungen der Elemente der IV. Hauptgruppe (14. Gruppe)
besprochen.







