Vorlesung Chemie der Metalle
5.Tetrele (4. Hauptgruppe, Kohlenstoff-Gruppe: Si, Ge, Sn, Pb)
5.7. Intermetallische Verbindungen
Die Tetrele bilden viele z.T. technisch extrem wichtige Legierungen mit den Übergangsmetallen
(z.B. Ferrosilicium). Diese sind meist nicht stöchiometrisch scharf.
Weitere Informationen besonders zur Strukturchemie gibt es in der Vorlesung
Intermetallische Phasen.
Dagegen werden mit den elektropositiven Hauptgruppenelementen
(Alkalimetalle, Erdalkalimetalle und Lanthanoide)
stöchiometrisch scharfe Silicide, Germanide, Stannide und Plumbide gebildet.
Deren Strukturchemie
(s. auch Kap.
6.,
6.1. und
6.2. der Vorlesung
Intermetallische Phasen)
ist nach einem ionischen/kovalenten Konzept erklärbar (Zintl-Konzept),
die Bindigkeit im M-Anionenverband folgt der 8-N-Regel (vgl. auch schwerere Pnicogene und Chalkogene).
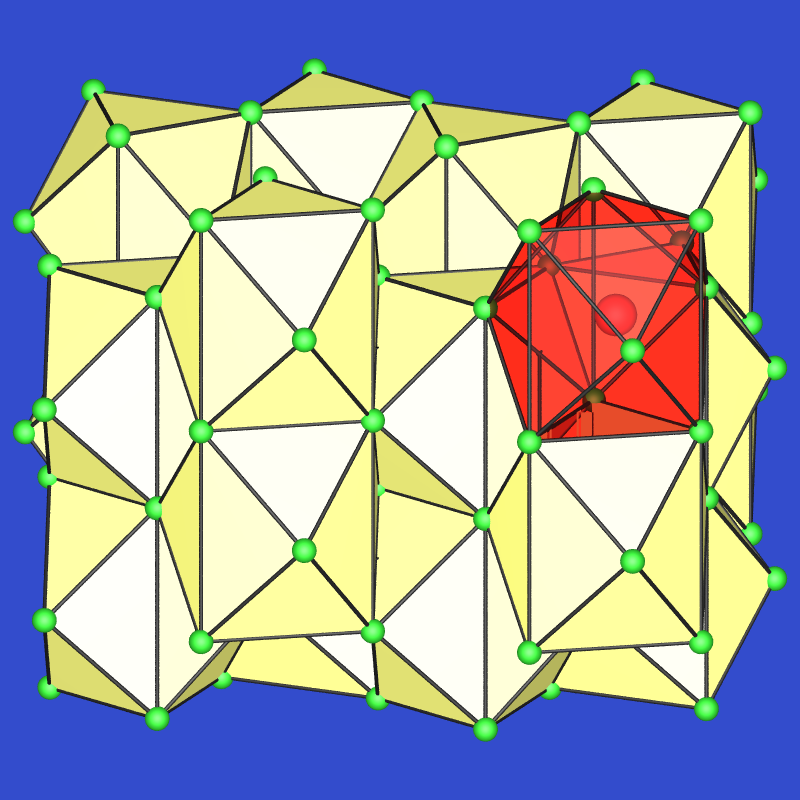
Z.B. folgt für die Phasen im System Ca-Si:
- Ca2Si: Es liegen edelgasanaloge, d.h. isolierte, nur von
Calicum-Kationen koordinierte Si4--Ionen vor.
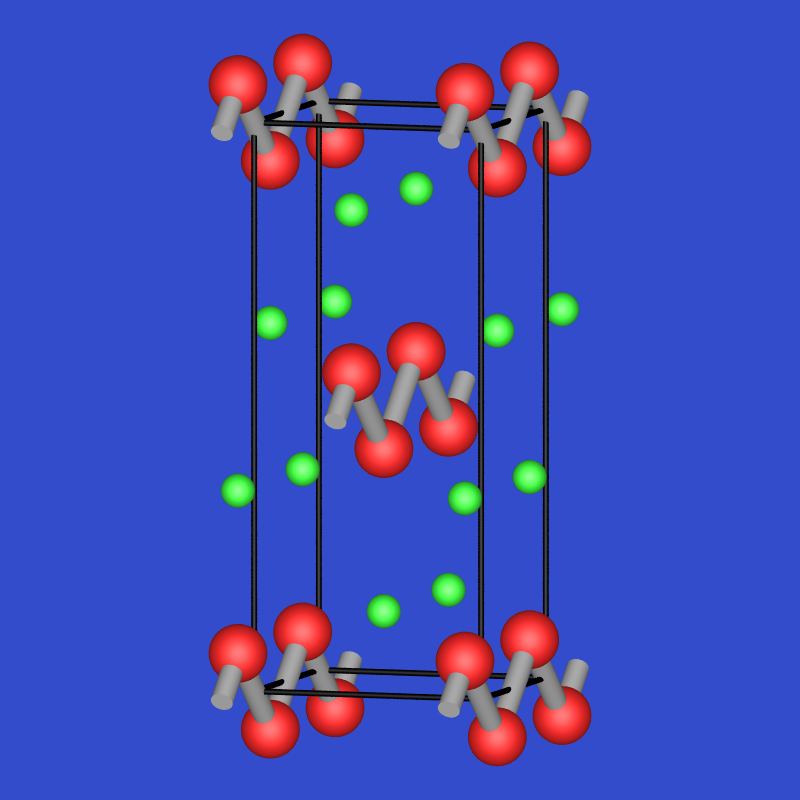
- CaSi: Der Si-Teilverband besteht aus gewinkelten Ketten und ist damit isoelektronisch
zu den Elementen der 6. Hauptgruppe wie z.B. Selen.
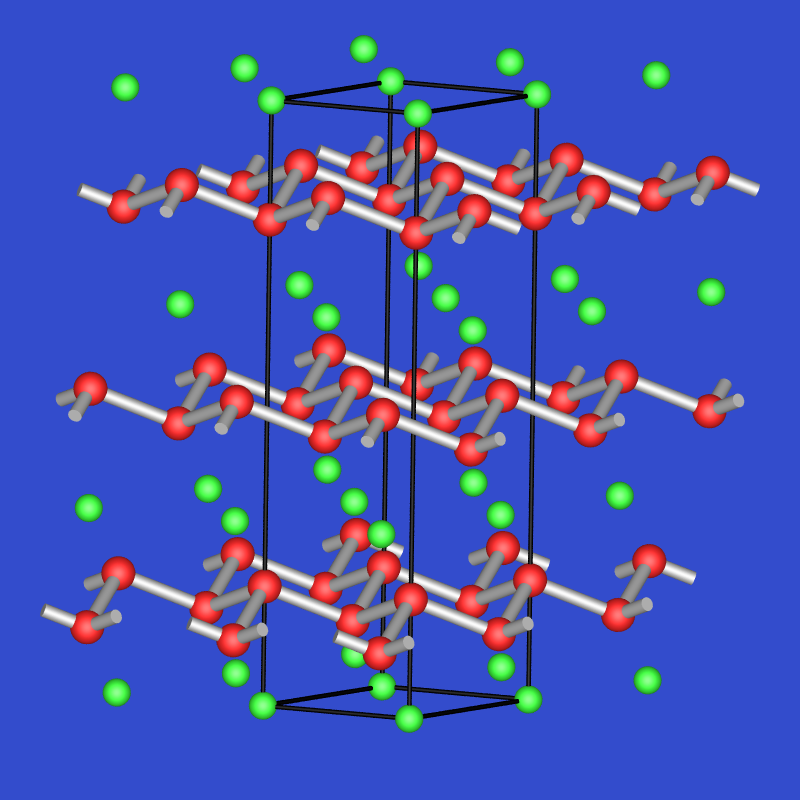
- In CaSi2 liegt eine Si-Blattstruktur vor, die der des grauen Arsens
entspricht.
- Ca5Si3 enthält gemäß
der ionischen Zerlegung in Si4-, Si26- und 5 Ca2+
isolierte Si-Atome und Si2-Hanteln.
- In KSi finden sich Si44--Anionen, die dem weißen
Phosphor entsprechen (isoelektronische Tetraeder).
 |
 |
 |
 |
 |
| Abb. 5.7.1. Ca2Si |
Abb. 5.7.2. CaSi |
Abb. 5.7.3. CaSi2 |
Abb. 5.7.4. Ca5Si3 |
Abb. 5.7.5. KSn |
Abhängig vom Anionenbauverband entstehen bei der Hydrolyse unterschiedliche Produkte:
Ca2Si ⟶ SiH4 + Ca(OH)2
CaSi ⟶ Silane + polymeres SiH2
Silicide können damit als Ausgangsstoffe zur Gewinnung von Silan eingesetzt werden:
Mg2Si + 4 HCl ⟶ SiH4 + 2 MgCl2
Daneben entstehen auch höhere Silane wie z.B. Si2H6 oder
Si3H8 (selbstentzündliche Gase).









