Vorlesung Chemie der Metalle
8. Übergangsmetalle
8.5. Chalkogenide (bes. Oxide)
Die folgende Tabelle gibt eine schematische Übersicht über die Oxide aller
Übergangsmetalle:
| OS |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
| I |
|
? |
|
77 |
|
| II |
68 |
79 |
73 |
67 |
61 |
65 |
68 |
73 |
74 |
| III |
75 |
67 |
64 |
62 |
58 |
55 |
|
|
| IV |
|
61 |
58 |
55 |
53 |
|
|
| V |
|
54 |
53 |
|
|
| VI |
|
44 |
|
|
| VII |
|
46 |
|
|
Tab. 8.5.1. Ionenradien der Übergangsmetall-Ionen
Die folgende Übersicht zeigt die wichtigsten Strukturtypen von Übergangsmetalloxiden
mit den Metallionen in einer einzigen definierten Oxidationsstufe.
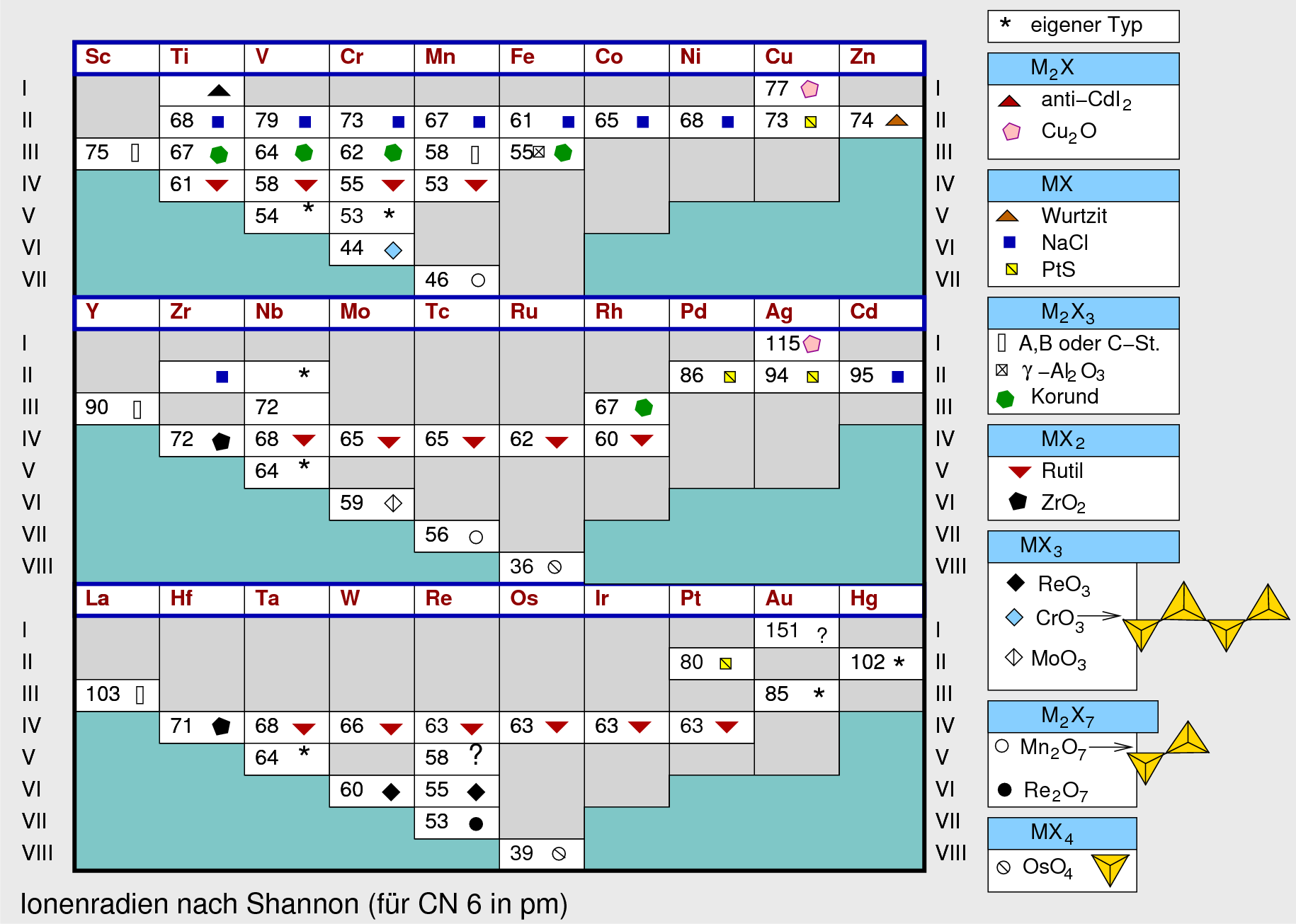 |
| Abb. 8.5.1. Übersicht Übergangsmetall-Oxide
‣SVG |
Die in den Kästchen angegebenen Zahlen bedeuten die Ionenradien nach Shannon für
die Koordinationszahl 6.
Die Nachteile dieses Schemas, die aus der Einteilung nach Oxidationszahlen
folgen, sind, daß keine gemischtvalenten und keine nichtstöchiometrischen Verbindungen
aufgenommen werden können. Beide Verbindungstypen sind aber gerade bei den
Übergangsmetalloxiden sehr wichtig und häufig.
Allgemeines
- In der 3d-Metallreihe bilden alle zwei-wertigen Metallionen Oxide MO, die
im Kochsalz-Typ kristallisieren.
- Bei den frühen 3d-Übergangsmetallen wird die maximale Oxidationsstufe
erreicht, die Verbindungen sind aber z.T. recht starke Oxidationsmittel.
In dieser Gruppen werden in Oxiden allgemeine viele Oxidationsstufen
realisiert. Zusätzlich gibt es auch viele gemischtvalente Verbindungen.
- In der 4d- und 5d-Reihe steigt die Stabilität der maximalen
Oxidationsstufe. Entsprechend bilden die meisten Metalle Oxide
MO2, die im Rutil-Typ kristallisieren.
Die 'frühen' Metalle erreichen in den Oxiden die maximalen Oxidationsstufen
der jeweiligen Gruppen.
- Für die Koordinationszahl gegen Sauerstoff, die bei den
Übergangsmetallen von 4 über 6 bis 9 (bei Zr und La) reicht, ist
das Verhältnis der Ionenradien primär bestimmend (Ionenradius von O2- = 140
pm). Bei davon abweichenden Geometrien und Koordinationszahlen (z.B. bei Cu, Au oder Hg)
sind meist Kristallfeldeffekte strukturbestimmend.
- Wie bei den Halogeniden gibt es vor allem Abweichungen bei den
(schweren) späten Übergangsmetallen (d8 und d9) und
bei Elementen wie Nb, Ta und Mo, die bei formal niedrigeren Oxidationsstufen
Clusterverbindungen bilden.
- Zu den strukturbestimmenden Faktoren in Übergangsmetalloxiden s.a.
Kap. 3.3. der Vorlesung Strukturchemie der Oxide.
Im folgenden werden die wichtigsten Verbindungen inklusive der
häufigsten Strukturtypen nach Zusammensetzung besprochen:
- M2O: Es treten zwei Strukturtypen auf, von denen
der erste (als Antityp) von den Hauptgruppenmetallen bekannt ist:
- Ti2O kristallisiert wie Cs2O im
anti-CdI2-Typ (CNO=6, rote Oktaeder; CNTi=3).
- Der bei den Hauptgruppenmetallverbindungen unbekannte Cuprit-Typ (Cu2O)
(Cu: graue Kugeln, O: rote Kugeln)
tritt in Cu2O und Ag2O auf.
Die Kupferionen (grau) sind linear (CNCu=2) von Oxidionen (rot), die Oxidionen tetraedrisch (CNO=4) von Cu-Ionen koordiniert.
Interessant ist die Struktur insofern, als hier zwei nicht aneinander gebundene, jeweils dem Cristobalith (SiO2) analoge
Teilverbände (grün und gelb markiert) ineinandergeschachtelt vorliegen.
Cu2O (Cuprit) ist tiefrot (Foto hier),
schwerlöslich und zeigt halbleitende Eigenschaften.
Die Verbindung kann durch thermische Zersetzung von CuO hergestellt werden.
Zur Mineralogie von Cuprit (Cu2O)
siehe hier.
Die entsprechende Ag-Verbindung Ag2O ist dunkelbraun, schwerlöslich und zersetzt sich
oberhalb von 200oC in Ag und O2.
- MO: Bei den Oxiden der zweiwertigen Metalle treten neben den von den Hauptgruppen bekannten
Strukturen (Kochsalz- und Wurtzit-Typ) bei den späten/schwereren Übergangsmetallen
Strukturen auf, bei denen die Geometrie am Metallion durch Kristallfeldeffekte wesentlich
beeinflußt wird:
- Der von den Alkalimetall-Halogeniden und Erdalkalimetall-Oxiden
bekannte NaCl-Typ ist auch bei den Übergangsmetalloxiden
(z.B. NiO, MnO, CoO, TiO, CdO) sehr häufig.
Wegen der oktaedrischen Koordination sowohl von M als auch von O,
tritt dieser Strukturtyp bei allen Metallionen auf, die i.a. oktaedrische Komplexe bilden.
Neben der Idealstruktur gibt es viele Defekt- und Verzerrungs-Varianten.
Die Verbindungen im einzelnen:
- NiO
- MnO: grün, antiferromagnetisch
- FeO (sog. Wüstit) ist als Hochtemperaturphase nur oberhalb von 560oC stabil.
Es handelt sich gemäß FexO (x=0.95-0.88) um eine nichtstöchiometrische Verbindung mit
Defekten im Kationenteilgitter.
- VO zeigt Defekte in beiden Teilgittern.
- NbO bildet einen speziellen Typ aus, in dem Cluster durch geordnete Defekte auftreten:
Durch Einbau von Fehlstellen im NaCl-Typ (Anionen bei 0,0,0 und Kationen bei 1/2,1/2,1/2 fehlen, d.h.
die Formel ist als Nb0.75O0.75 zu schreiben)
entstehen Nb6-Oktaeder-Cluster mit Sauerstoffatomen über den Kantenmitten.
(zu Clusterverbindungen siehe auch hier).
- CoO: olivgrün
- TiO
- CdO
- ZnO ist das einzige Übergangsmetalloxid, daß im Wurtzit-Typ kristallisiert.
Sowohl Zn (rote Tetraeder) als auch O sind tetraedrisch koordiniert (CNZn=CNO=4)
ZnO geht oberhalb von 425oC eine reversible Farbänderung nach gelb ein, die auf die Bildung von Defekten
zurückgeführt werden kann.
- Der PtS-Typ, der bei PtO, PdO, CuO und AgO vorliegt, zeigt
den Einfluß von Ligandenfeldeffekten auf die Festkörperstruktur:
Wegen der Stöchiometrie von 1:1 weisen Anionen und Kationen dieselbe Koordinationszahl 4
auf, wobei allerdings die Anionen (grün) tetraedrisch, und die Kationen (rot) quadratsich planar (vgl. die Koordinationschemie
der genannten Metallionen und die LFSE von d8-Ionen) koordiniert sind.
Im Einzelnen:
- PdO und PtO sind schwarz und säureunlöslich.
- CuO ist ebenfalls schwarz und kann aus Kupfer und Sauerstoff unterhalb von 900 oC hergestellt werden.
- AgO ist ebenfalls isotyp.
-
HgO ist dimorph. Beide Modifikationen enthalten Hg in linearer und Sauerstoff in gewinkelter Koordination
(CNHg=CNO=2), d.h. in beiden Formen liegen Ketten -O-Hg-O-Hg- mit Winkelung am Sauerstoff vor.
- Die Struktur der roten, orthorhombischen Form von HgO
enthält planare Ketten (rot: O; gelb: Hg).
Sie kann aus den Elementen bei ca. 300 oC hergestellt werden und
zerfällt oberhalb von 400oC wieder in die Elemente.
- Die gelbe, trigonale Form von HgO
kristallisiert isotyp zum Zinnober (HgS) und enthält die Ketten in geschraubter Anordnung (rot: O; gelb: Hg).
Diese Form entsteht bei der Fällung aus Lösungen.
- M3O4:
Diese Zusammensetzung resultiert, wenn z.B. ein zwei- und zwei drei-wertiges Metallionen
ein Oxid bilden. Diese Oxide kristallisieren überwiegend in der
Spinell-Struktur, die bereits von der γ-Form
von Al2O3 bekannt ist.
In der Kristallstruktur der Spinelle (Grundverbindung: MgAl2O4)
bilden die Sauerstoffionen ein kubisch flächenzentriertes Gitter, in dem
1/8 der Tetraeder und die Hälfte der Oktaederlücken besetzt ist. Je
nach Kationenverteilung unterscheidet man in:
- Normalspinell: MII(TL)MIII(OL)2O4
- Inversspinell: MIII,TL[MIIIMII]OLO4
Die einzelnen Verbindungen:
- Mn3O4 (Hausmannit)
- Fe3O4 (Magentit, Inversspinell) Foto
- Co3O4 (Normalspinell). Andere Cobalt-Spinelle sind von der
Analytik her bekannt, z.B. dient ZnCo2O4 (Rinmanns-Grün)
zum Nachweis von Zink, mit CoAl2O4 (Thenards-Blau) kann Aluminium
nachgewiesen werden.
- zur Mineralogie
- MIII2O3
Die Oxide der dreiwertige Metallionen sind von den Oxiden der Metalle der dritten Hauptgruppe (13. Gruppe)
bekannt. Die Korund-Struktur ist auch bei den Übergangsmetallverbindungen sehr häufig. Im Einzelnen:
- In der Korundstruktur
befinden sich die M3+-Ionen in oktaederischer Koordination (CN 6).
Die MO6-Oktaeder sind über Flächen zu Doppeln verknüpft.
Umgekehrt läßt sich die Struktur auch durch eine 2/3-Besetzung der Oktaederlücken
in einer hexagonal dichten Kugelpackung beschreiben. Einige wichtige Verbindungen
mit Korund-Struktur:
- Co2O3
- Mn2O3
- Cr2O3 (dunkelgrün, Schmelzpunkt 2275oC)
- α-Fe2O3 (Hämatit, Foto)
- Rh2O3
- Auch die Struktur von γ-Al2o3 (Defekt-Spinell
, d.h. CN 6 und CN 4 für M) tritt bei den Übergangsmetalloxiden auf, z.B. in
γ-Fe2O3, das für Magnetbänder Verwendung findet.
- In Au2O3
(die Quadrate entsprechen einer AuO4-Einheit) und der isotypen Silber-Verbindung
sind die d8-Metallzentren quadratisch planar von Sauerstoff koordiniert.
- A-, B- oder C-Struktur (CNM > 6) kommen wie in den Lanthanoid-Oxide auch in der Sc-Gruppe vor.
- Die überwiegende Zahl der MIV-Dioxide MO2 bildet
den Rutil-Typ aus.
- Rutil
Foto Pyrolusit MnO2
Mineralogie Ramsdellit MnO2
Im Einzelnen:
- MoO2 und WO2
- VO2
- CrO2: braunschwarz, ferromagnetisch, Verwendung für Tonbänder
- MnO2: Braunstein, Verwendung in Trockenbatterien
- ReO2: blauschwarz
- VO2
- RuO2: blauschwarz
- OsO2: kupferfarben
- Im Fall von TiO2 existieren zusätzlich die beiden Modifikationen Anatas und Brookit
(s. TiO2-Special).
- In der Struktur von ZrO2 (Baddeleyit)
ist die Koordinationszahl von Zr mit 7 größer als 6, aber kleiner als 8.
Die Struktur kann vom Fluorit-Typ durch Verzerrung abgeleitet werden (CN von 8 auf
7 erniedrigt).
ZrO2 geht oberhalb von 2300oC in den unterzerrten Fluorit-Typ über.
Die Verbindung ist ein Sauerstoffionenleiter und daher für die Anwendung in Brennstoffzellen und als
λ-Sonde wichtig.
- Die Oxide MV2O5
bilden unterschiedliche z.T. sehr komplizierte Strukturen, deren Basis meist
Oktaeder MO6 sind (Scherstrukturen: s. auch Kap. 4 der Vorlesung
Strukturchemie der Oxide).
- V2O5 ist amphoter und bildet im alkalisch Ionen wie z.B.
VO43-, im saueren z.B. VO2+.
- Die Oxide MVIO3
bilden drei sehr unterschiedliche Arten von Verbindungen:
- Eine Raumnetzstruktur aus eckverknüpften Oktaedern findet sich in
ReO3.
Die Verbindung, die bei 160 oC schmilzt, ist rot und weist metallischen Glanz auf.
Oberhalb von 300 oC disproportioniert sie in ReO2 und Re2O7.
WO3 ist isotyp und die Stammverbindung der sogenannten Wolframbronzen NaxWO3 (x=0-1).
- CrO3 (Mp 198 oC) enthält,
(ähnlich sie asbestartiges SO3) Ketten eckverknüpfter Tetraeder.
- Oktaederschichten sind das wichtigste Strukturelement in MoO3
(Mp. 795 oC)
(s.a. Scherstrukturen, Magneli-Phasen, s. auch Kap. 4 der Oxid-Vorlesung).
- Bei den Oxiden MVII2O7 gibt es zwei
unterschiedliche Gruppen:
- Mn2O7 besteht aus Doppeltetraedern
und ist ein grünschwarzes Öl mit einem Schmelzpunkt von 6oC.
Es ist ein starkes Oxidationsmittel und reagiert mit organischen Substanzen unter Explosion.
Mn2O7 kann aus KMnO4 durch Entwässern mit konzentrierter
H2SO4 hergestellt werden.
- Die Struktur von Re2O7
besteht aus eck-verknüpften ReO6-Oktaedern (hellblau) und ReO4-Tetraedern (rot).
Entsprechend dieser zweidimensionalen Struktur schmilzt die gelbe, hygroskopische
Verbindung (im Unterschied zu Mn2O7) erst bei 303oC.
- Die Oxide der maximalen Oxidationsstufe +VIII, MVIIIO4,
existieren nur von Ruthenium und Osmium.
Als Strukturelement treten (auch in Übereinstimmung mit den geringen Ionenradien)
isolierte Tetraeder auf, was sich auch in
den Eigenschaften dieser Oxide bemerkbar macht:
- RuO4 schmilzt bei 25 oC, ist gelb, flüchtig und sehr giftig.
Oberhalb von 180oC zerfällt es unter Explosionserscheinung zu RuO2 und elementaren Sauerstoff.
- OsO4 hat einen Schmelzpunkt von 40 oC, ist farblos und ebenfalls sehr giftig!
Entsprechend der Tendenzen zur Stabilität der Oxidationsstufen im Periodensystem ist es beständiger als RuO4.
OsO4 ist in CCl4 gut löslich.

